球囊损伤联合高脂及维生素D3致大鼠动脉粥样硬化的方法学优化
研究报告
球囊损伤联合高脂及维生素D3致大鼠动脉粥样硬化的方法学优化
杨钦钦,马全鑫,奚晓青,张利棕,方明笋,朱科燕,陈方明,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州310053)
【摘要】目的比较腹腔注射维生素D3 (VD3)1、2、3周后实行球囊手术对动脉粥样硬化形成的影响,探寻大鼠动脉粥样硬化造模的优化方法。方法选取雄性SD大鼠36只,随机分为正常组、模型组1、模型组2、模型组3,正常组6只,其余每组10只。对照组饲喂普通饲料,模型组1、2、3在实验开始时饲喂高脂饲料并腹腔注射VD3 40万IU/kg,分别于1、2、3周后行左侧颈总动脉球囊损伤手术,术后第0、2周再注射VD310万IU/kg。手术4周后,处理动物,测定TG、TC、HDL-C、LDL-C水平,检测血清中炎症因子hsCRP、IL-6、TNFα含量,观察HE染色的胸主动脉病理变化,分析血管壁厚度、斑块面积(PA)、血管横截面积(CVA)及校正斑块面积(PA/CVA)。结果与正常对照组相比,模型组2、3中TC、LDL-C含量显著升高(P<0.05);模型组1、2、3的hsCRP、IL-6及TNFα水平较对照组明显升高(P<0.05),模型组3的hsCRP、IL-6及TNFα水平明显高于模型组1(P<0.05);病理观察显示模型组1、2、3均出现不同程度的AS斑块,血管壁厚度及PA/CVA均显著大于对照组(P<0.05);模型组3有大量脂质泡沫沉积,而且PA、CVA及PA/CVA相比于模型组1、2均明显增加(P<0.05)。结论大鼠在高脂饮食和VD3腹腔注射基础上于3周后行颈总动脉球囊损伤手术,是诱导动脉粥样硬化模型的理想优化方法。
【关键词】球囊损伤;高脂;维生素D3;动脉粥样硬化
[基金项目]国家科技重大专项子课题(2012zx09103101-008)。
[作者简介]杨钦钦(1988-),女,硕士生,研究方向:中药药理与比较医学,E-mail: qqy_mengxiangz8@163.com。
[通讯作者]陈民利(1963-),女,教授、硕士,研究方向:实验动物与比较医学,E-mail: cmli991@126.com。
【中图分类号】R332【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.001.006
Methodological research of establishing atherosclerosis
model with ballon injury plus high-fat diet and vitamin D3in rats
YANG Qin-qin,MA Quan-xin,XI Xiao-qing,ZHANG Li-zong,FANG Ming-sun,ZHU Ke-yan,CHEN Fang-ming,CHEN Min-li
(Laboratory Animal Research Center, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Abstract【】ObjectiveTo compare the effects of forming atherosclerosis by conducting ballon injury operation after 1th, 2th and 3th week of Vitamin D3(VD3) i.p., exploring the best method for atherosclerosis modeling. Methods 36 male rats were selected for balloon-injured carotid artery. SD rats were divided into 4 groups randomly: control group (n=6), Model group1 (n=10), Model group2(n=10), Model group3 (n=10). Control group were fed up with common diet. Model groups were fed up with high-fat diet and injected 4.0×105IU/kg VD3 through enterocoelia in the beginning, followed by the balloon-injured left carotid artery operation after 1th, 2th and 3th week respectively and 1.0×105IU/kg VD3 injection at 0th, 2th week after operation. The rats were killed at 4th week after operation. The serum levels of TG, TC, HDL-C and LDL-C were checked. ELISA was used to detect the content of hsCRP, IL-6 and TNFα. HE staining was used to observe the pathological changes in the thoracic aorta, and the thoracic aorta thickness, plaque area(PA), cross-sectional area of vessel(CVA) and the ratio of PA to CVA(PA/CVA) were analyzed. ResultsAfter 4 weeks of operation, levels of TC and LDL-C were significantly increased in Model group2 and 3 compared with that of the control group (P<0.05). Furthermore, contents of hsCRP, IL-6 and TNFα of model groups were also seriously higher than that of the control group (P<0.05), and that of Model group 3 were the highest. Typical AS plagues were observed in different degrees in model groups, and thoracic aorta thickness and PA/CVA were obviously increased than that of control group (P<0.05). Model group 3 turned out masses of lipid foam cells accumulated, and PA, CVA and PA/CVA were significantly increased than that of Model group2 or 3. Conclusion The AS model can be established successfully in rats with ballon injury after 3 weeks of high-fat diet plus VD3 i.p., which is the ideal method to induced atherosclerosis model.
【Key words】Balloon injury;High-fat diet;Vitamin D3;Atherosclerosis
动脉粥样硬化(atherosclerosis,AS)是一种慢性动脉炎症性疾病,可引发多种心血管疾病,严重威胁人类生命健康。因此,建立一种脂质代谢和斑块与人类相仿的实验性AS模型,对探明病因、发病机制及防治均具有重要意义。高脂饲喂、维生素D3(vitamin D3,VD3)注射和球囊损伤术是常用的一种AS造模手段,其原理是基于“内皮损伤反应学说”球囊直接损伤了大鼠动脉内皮,脂质易于浸润沉积,符合临床AS疾病的发生发展过程,可形成与人类AS类似的较成熟斑块硬化AS模型[1]。内膜损伤能造成内膜脱落,同时给予高脂饲料及VD3负荷促使脂质及钙盐沉积,加速大鼠AS的形成[2]。但目前,各类文献报道的方法不一,VD3注射剂量、注射时间以及行球囊手术的时间不尽相同,形成的AS模型也有差异。我们在前期研究发现VD3腹腔注射剂量、时间、注射方式及实行球囊手术的时间直接影响AS的形成。为此,我们在前期研究的基础上结合相关参考文献[3],将高脂饲喂、VD3注射和球囊损伤术联合应用的造模方法进行了优化研究。
1材料和方法
1.1实验动物及实验环境
SPF级雄性SD大鼠36只,体重220~250 g,购自上海斯莱克实验动物有限公司【SCXK(沪)2012-0002】;饲养在浙江中医药大学动物实验中心屏障系统【SYXK(浙)2013-0184】,每笼3只饲养,自由饮食和饮水;并按实验动物使用的“3R”原则给以人道主义关怀。
1.2主要试剂与仪器
维生素D3注射液,上海通用药业股份有限公司,国药准字H31021404;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C),上海申能德赛诊断技术有限公司,批号分别为07068/00000877、07069/00000994、18890/00001066、18991/00001244;大鼠白细胞介素6(IL-6)ELISA试剂盒、大鼠超敏C反应蛋白(hs-CRP)ELISA试剂盒、大鼠肿瘤坏死因子α(TNFα)ELISA试剂盒,杭州诚维生物科技有限公司,批号分别为:E2014082604、E2014082602、E2014082603。PTCA球囊扩张导管(直径2F,美国Medronic公司),7020型全自动生化分析仪(日本日立公司),Thermo光谱扫描多功能酶标仪(美国Thermo公司),ST5010染色机(德国Leica公司),80I相差显微镜(日本Nikon公司)。
1.3实验方法
1.3.1动物分组与模型制备
36只雄性SD大鼠,经适应性饲养后,随机分为4组,即正常对照组(control group)6只、模型组1(model group 1)10只,模型组2(model group 2)10只和模型组3(model group 3)10只。正常对照组喂普通饲料。模型组在实验开始时均以高脂饲料(胆固醇1%、猪油10%、蛋黄粉10%、3号胆盐0.5%、基础饲料78.5%)喂养,同时在腹腔注射40万IU/kg的VD3注射液。之后,模型组1、2、3分别于VD3注射1、2、3周后行大鼠主动脉球囊损伤术,在术后第0、2周分别注射10万IU/kg VD3注射液。
1.3.2大鼠主动脉内膜球囊损伤手术[4-5]
模型组大鼠用3%的戊巴比妥钠(45 mg/kg)腹腔麻醉,颈部剃毛,背部固定于鼠板。碘酒消毒颈部皮肤,无菌条件下作颈部正中开口,钝性分离大鼠左侧颈总动脉,结扎远心端,动脉夹夹闭近心端,暂时阻断左侧颈总动脉近心及远心端血流。在两端之间的动脉壁上约呈45°显微剪剪开一“V”形开口,向近心端仔细轻柔插入2.0 mm×20 mm直径球囊导管,松开动脉夹,使球囊进入近心端动脉,并向颈总动脉起始部推送8~10 cm。手推式压力泵注入生理盐水,将球囊充盈,用4~6 ATM加压球囊,然后,回抽球囊(以回来时有明显阻力感,又可以拉动球囊为宜),当球囊回撤至切口处时球囊完全减压,然后再将球囊导管推送入主动脉,再次充盈球囊、回撤减压,使之与动脉内膜摩擦,造成内膜机械损伤。如此来回摩擦5次后,释放球囊气体,退出导管,结扎近心端颈总动脉。然后,生理盐水冲洗伤口,并洒上青霉素钠以防感染,缝合肌肉和皮肤,碘酒再次消毒皮肤,将动物放入护理框中保暖护理待其苏醒。术后,每天观察各模型组动物状况且每周称重,高脂饲料继续喂养4周。
1.3.3血清中血脂检测
球囊手术后第4周实验结束,各组动物禁食12 h后,用3%戊巴比妥钠(45 mg/kg)腹腔麻醉,打开腹腔, 腹主动脉取血10 mL,静置30 min,3000 r/min离心10 min,取上清分成3份,其中一份用全自动生化仪测定TG、TC、HDL-C、LDL-C数值。另外两份置-80℃冰箱中冻存备用。
1.3.4血清中炎症因子hsCRP、IL-6、TNF-α检测
取一份-80℃中冻存的血清,采用双抗体一步夹心法酶联免疫吸附法(ELISA)分别测定上清液中hsCRP、IL-6和TNF-α的含量。
1.3.5血管组织病理学观察及主动脉内膜增生的检测
术后第4周取材,动物麻醉取血后,暴露出心脏及整条主动脉,取出胸主动脉(损伤部位主动脉弓下面一段血管)约1.0 cm,生理盐水冲洗干净。然后,将标本置于4%甲醛溶液中固定1~2 d,石蜡包埋后行病理切片,HE染色后在光镜下观察血管病理形态学改变情况。同时,观察内膜增生程度及斑块形成情况,采用Image Pro Plus 6.0专业图像分析软件进行分析,计算血管壁厚度、斑块面积(PA)、血管横截面积(CVA)及校正斑块面积(PA/CVA)。
1.4统计学方法
2结果
2.1一般状况
本实验中共26只大鼠,有6只大鼠死亡,手术中死亡4只,均因胸腔血管破裂出血致死;术后死亡2只,其原因可能是手术中出血较多恢复力较差而死。其中模型组1在手术中死亡3只,手术后死亡1只;模型组2在手术中及手术后各死亡1只;模型组3动物全部存活。正常对照组无死亡,动物精神状态良好,毛色较白有光泽,进食量稳定,行为活跃。模型组动物毛色偏黄粗糙,体型较正常组肥胖,少动,精神欠佳,饮食尚可。
2.2血脂水平
与正常对照组相比,模型组1、2、3大鼠在球囊手术四周后血清TC显著升高(P<0.05);各模型组血清LDL-C水平较对照组明显上升(P<0.05);模型组1、3血清HDL-C较对照组显著降低(P<0.05),模型组2无显著变化(P>0.05);各模型组血清TG水平与正常对照组相比有升高的趋势,但无显著性差异(P>0.05)(表1)。
2.3血清中hs-CRP、IL-6、TNFα含量检测
与正常对照组相比,各模型组大鼠血清hs-CRP、IL-6、TNFα含量均显著升高(P<0.05)。与模型组1相比,模型组3血清中hs-CRP、IL-6、TNFα含量均显著增加(P<0.05),模型组2无显著性差异(P>0.05)(图1)。
2.4主动脉病理学变化
2.4.1胸主动脉组织学观察(彩插均见彩插1)
胸主动脉HE染色显示,正常组大鼠血管管腔呈光滑椭圆形,血管壁分为内膜、中膜和外膜,三层界限清晰,内膜平整完好,血管组织结构正常,未见明显病理改变(图2A、A1)。与正常组相比较,各个模型组胸主动脉均见典型的AS斑块形成。模型组1大鼠血管内膜轻微增生,管腔略狭窄,斑块中可见一定的泡沫细胞、脂质沉积和胆固醇结晶(图2B、B1)。模型组2大鼠血管内膜比模型组1增生较严重,弹力纤维排列疏松,斑块突入管壁致管腔更狭窄,有较多的泡沫细胞和脂质沉积(图2C、C1)。模型组3的内膜增生程度及管腔狭窄度最大,内弹力板排列紊乱变性坏死,脂质斑块内可见大量泡沫细胞聚集、胆固醇晶体沉积及炎症细胞浸润,脂核相对较大(图2D、D1)。
2.4.2胸主动脉内膜增生情况
与正常对照组相比较,球囊手术4周后,各个模型组大鼠的胸主动脉厚度、CVA显著增加(P<0.05)。与模型组1相比较,模型组2、3的胸主动脉厚度、PA、CVA及PA/CVA均明显升高(P<0.05)。模型组3相比于模型组2,其胸主动脉厚度、PA、CVA及PA/CVA亦显著增加(P<0.05)(表2)。

表1 各组大鼠术后4周血脂水平变化(mmol/L)
注:*:与正常对照组相比,P<0.05。
Note: Compared with the control group,P<0.05.
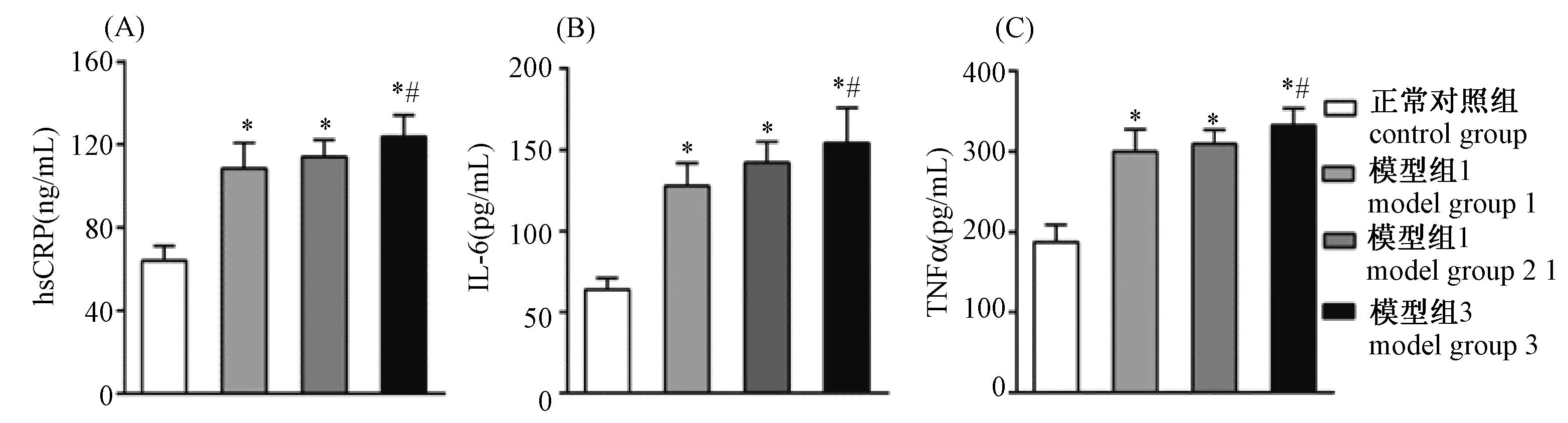
注: *:与正常对照组相比,P<0.05; #:与模型组1相比,P<0.05。 图1 血清中hs-CRP、IL-6、TNFα含量比较 Note: *: Compared with the control group, P<0.05; #: compared with the model group 1, P<0.05. Fig.1 Comparison of the content of hs-CRP, IL-6, TNFα in serum

组别(Groups)胸主动脉厚度(μm)Thoracicaortathickness(μm)PA(mm2)CVA(mm2)PA/CVA(%)正常对照组(Controlgroup)114.19±1.37—0.63±0.01—模型组1(Modelgroup1)132.28±0.46a0.033±0.0020.72±0.13a4.58±0.24模型组2(Modelgroup2)149.16±2.10ab0.086±0.010b0.79±0.23ab10.92±1.35b模型组3(Modelgroup3)165.25±1.61abc0.116±0.004bc0.82±0.17abc14.13±0.51bc
注:a:与正常对照组相比,P<0.05;b:与模型组1相比,P<0.05;c:与模型组2相比,P<0.05。
Note: a: Compared with the control group,P<0.05; b: compared with the model group 1; c: compared with the model group 2,P<0.05.
3讨论
高脂饲料、VD3腹腔注射联合颈总动脉球囊损伤方法建立AS模型已较多地应用于AS研究[2],但各类文献报道的VD3注射剂量、注射时间等不尽相同,对VD3注射后行球囊手术的时间也缺乏统一认识[6-7],而这些因素的改变都会导致AS的病理进程产生差异。我们前期研究发现在VD3腹腔注射后不同时间实行球囊手术,AS形成的程度也不同。由此可知AS模型的形成与各实验因素相关,本实验主要从VD3注射剂量、注射方式(注射时间与分次剂量)、手术时间等方面对AS模型制作进行了优化。文献报道一次性注射大剂量VD37.0×104IU/kg会引起动物腹泻、厌食消瘦、死亡率升高等[8],我们将VD3首次注射剂量优化为4.0×104IU/kg,动物状态普遍良好;周红等[3]发现在造模初期仅一次注射VD3会导致AS模型不明显、不易形成典型的血管病变,我们在术后第0、2周继续分次补充注射VD3,提高了模型成功率;本实验将VD3注射后第1、2、3周做球囊损伤手术动物经对比发现注射VD3后第3周行颈动脉球囊手术可降低动物的死亡率,AS模型较为理想和稳定;大鼠术后立即采取保暖、补水、注射抗生素、祛痰等护理措施,遵从了动物福利原则,有利于动物恢复并提高了大鼠的成活率。
AS的发生与血脂异常密切相关。本实验结果显示各模型组大鼠在球囊手术4周后血清TG、TC和LDL升高,HDL降低,这与佘颜等[9]报道的实验结果相符,表明各模型组动物血脂代谢出现了紊乱。其中模型组3的血脂异常更为明显。通过病理观察进一步发现各模型组均形成了不同程度的粥样斑块,内膜普遍增厚,血管壁斑块向管腔突出,斑块中含有泡沫细胞、平滑肌细胞、胆固醇结晶及炎症细胞。而模型组3内膜增厚的幅度最大,形成的斑块也最为明显。从血脂及病理形态学结果可看出在VD3注射后1、2、3周行球囊手术均能形成AS模型,而且在VD3注射后第3周行球囊手术则更有利于血脂沉积及斑块形成。
近来研究表明AS主要是在血管内皮细胞损伤的基础上发生的一系列慢性炎症反应[10-12],其中IL-6、TNFα、hsCRP已作为AS发展过程中的重要炎症标志物[13-14]。本实验结果显示各模型组大鼠术后4周血清hsCRP、IL-6、TNFα含量均显著升高,说明在VD3注射后第1、2、3周行球囊手术的动物均出现了明显的炎症反应。此外,我们发现VD3注射后第3周行球囊手术大鼠血清中炎症介质含量最高,在这长期慢性炎症刺激下平滑肌细胞(SMC)大量迁移增殖,血管壁大幅增厚及泡沫细胞增多,更能促进AS斑块演变发展。故我们推论在腹腔注射VD3后第3周行球囊手术更好,更有利于AS模型的建立。
综上所述,以高脂饲料为诱导联合腹腔注射VD3和球囊手术的方法成功复制出了斑块成熟的AS模型。本实验研究结果表明,在大鼠腹腔注射VD33周后进行球囊手术并在术后第0、2周继续腹腔注射VD3是一个较为优化的AS造模方法。该模型具有血脂高、炎症反应程度高、斑块明显、动物死亡率低、模型稳定等优点。
参考文献:
[1]李迎新, 黄霖. 动脉粥样硬化动物模型制作方法的介绍[J]. 中国比较医学杂志, 2008, 18(5): 70-73.
[2]郭延松, 吴宗贵, 杨军柯,等. 三种大鼠动脉粥样硬化模型复制方法的比较[J]. 中国动脉硬化杂志, 2003, 11(5): 465-469.
[3]周红, 吴晓燕, 袁艺标,等. 三种剂量维生素D3结合高脂饲料建立大鼠动脉粥样硬化模型的比较[J]. 中国动脉硬化杂志, 2012, 20(11): 995-998.
[4]Tulis DA. Histological and morphometric analyses for rat carotid balloon injury model[J]. Methods Mol Med, 2007, 139: 31-66.
[5]陆红玲, 汤阳, 黄跃, 等. 颈动脉球囊损伤对高同型半胱氨酸诱导兔动脉粥样硬化病变的形成无明显影响[J]. 中国比较医学杂志, 2014, 24(4): 43-46.
[6]钟武, 关霞, 龙汉安, 等. 球囊损伤加高脂喂养建立大鼠髂动脉粥样硬化模型[J]. 中外医疗, 2008, 7(21):004-005.
[7]徐伟华. 大鼠动脉粥样硬化模型细胞凋亡的研究及药物干预[D]. 山东大学, 2006.
[8]赵娟, 李相军, 孙波. 维生素 D3联合高脂饲料建立大鼠动脉粥样硬化模型[J]. 实用医学杂志, 2009, 25(21): 3569-3571.
[9]佘颜, 张国明, 蔺晓源, 等. 苦丁茶对动脉粥样硬化大鼠血管内皮功能的影响[J]. 中国中医急症, 2014, 23(2): 220-222.
[10]Hansson GK, Hermansson A. The immune system in atherosclerosis[J]. Nat Immunol, 2011, 12(3): 204-212.
[11]Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011, 473(7347): 317-325.
[12]Björkegren JL, Hägg S, Talukdar HA,etal. Plasma cholesterol-induced lesion networks activated before regression of early, mature, and advanced atherosclerosis[J]. 2014, PLoS Genet, 2014, 10(2): e1004201.
[13]董西刚, 孙林, 张戈. 易损斑块的血清标记物研究进展[J]. 中国动脉硬化杂志, 2012, 20(6): 568-572.
[14]刘虹, 徐庆科, 夏伟, 等. 冠心病与炎症因子 IL-6, IL-8, IL-10, hs-CRP 及 TNF 的相关性研究[J]. 实用心脑肺血管病杂志, 2011, 19(9): 1446-1447.
〔修回日期〕2014-11-24

