高铁酸钾与双氧水联用处理含苯废水
高铁酸钾与双氧水联用处理含苯废水
平成君1,梁建奎2,金士威1,3,欧阳怡德1,肖磊1,刘旦1
(1.武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,湖北 武汉 430073;2.南水北调中线干线工程建设管理局,北京 100038;3.中南民族大学化学与材料科学学院,湖北 武汉 430074)
摘要:研究了高铁酸钾和H2O2联用对模拟含苯废水的处理效果。考察了高铁酸钾和H2O2用量、pH值、反应温度和反应时间等因素对苯去除率的影响。结果表明,在高铁酸钾与苯的物质的量比为2∶1、H2O2与苯的质量比为8∶1、pH值为3.5、反应温度为40 ℃、反应时间为30 min时,苯去除率可达87.5%以上。通过对苯降解中间产物的红外光谱分析,推测了苯的降解机理。
关键词:含苯废水;高铁酸钾;双氧水;降解机理
基金项目:湖北省自然科学基金资助项目(2014CFB774),湖北省新型反应器与绿色化学工艺重点实验室开放基金资助项目(RGCT201303),武汉工程大学研究生教育创新基金资助项目(CX2013012)
收稿日期:2015-05-24
作者简介:平成君(1988-),男,湖北荆州人,硕士研究生,研究方向:新型有机污染物削减技术,E-mail:heiseijun@sina.com;通讯作者:金士威,教授,博士,博士生导师,E-mail:newjsw@sina.com。
doi:10.3969/j.issn.1672-5425.2015.09.013
中图分类号:X 703文献标识码:A
苯在常温下为无色、有甜味的透明液体,具有一定的挥发性,是致癌物质。苯被广泛地应用在石油、医药、涂料等现代化学工业中。含苯废水会严重污染环境,给人体和农作物带来极大的伤害[1-2]。因此,含苯废水引起了环境工作者的极大关注。张祯等[3]研究了Fenton试剂处理苯、氯苯废水,在pH值为4~6、H2O2的最佳用量为水样质量的1.5‰~2‰、FeSO4·7H2O 的用量为水样质量的0.4%、氧化时间30 min的条件下,苯、氯苯的去除率均为98.82%。张波等[4]采用粘土吸附的方式处理含苯废水,烷基胺改性后的粘土对苯的吸附量达到46%。邹东雷等[5]运用微电解的方法在最优的工艺条件下对含苯废水中苯的去除率也可达到90%左右。高铁酸钾是具有氧化、混凝等多种功能的新型水处理剂,具有很好的污水处理效果。高铁酸钾与H2O2联用处理含苯废水,可以利用高铁酸钾的强氧化性及高铁酸钾氧化产生的Fe2+和H2O2形成的Fenton体系所具有的氧化性,使苯得到进一步的降解,对于减少高铁酸钾用量、降低高铁酸钾降解含苯废水的成本具有重要的现实意义。
1实验
1.1 试剂与仪器
苯、高铁酸钾、氢氧化钠、双氧水(30%H2O2)、37%盐酸,均为分析纯。
MSA124S-0CE-DA型分析天平,Sartorius;PHS-25型pH计;DF-101S型集热式恒温加热磁力搅拌器;UV-1600型紫外可见分光光度计;80-2型离心机。
1.2 方法
1.2.1标准曲线的绘制
分别配制浓度为5 mg·L-1、4 mg·L-1、3 mg·L-1、2 mg·L-1、1 mg·L-1、0.5 mg·L-1的苯溶液。在255 nm波长下测定苯溶液的吸光度并绘制标准曲线。
1.2.2含苯废水的处理
用50 mL的移液管移取100 mL 0.5 g·L-1的含苯模拟废水于锥形瓶中,加入一定体积的双氧水,用0.1 mol·L-1的盐酸和0.1 mol·L-1氢氧化钠溶液调节废水的pH值,同时加入一定量的高铁酸钾,充分搅拌后放入指定温度的水浴箱中反应一定时间,取上层清液10 mL加入一定量的9 g·L-1的盐酸羟胺溶液终止反应。在255 nm波长下测定溶液的吸光度。以相同条件下未加入苯的反应体系作为空白,根据苯的标准曲线即可计算出剩余苯的浓度,计算得到苯去除率。
1.2.3反应条件对苯去除率的影响研究
以苯去除率为考核指标,分别考察高铁酸钾、双氧水用量、pH值、反应温度、反应时间对苯去除率的影响。
1.2.4苯的降解机理推断
取0.01 g·L-1的含苯模拟废水200 mL,控制反应条件,在反应进行5 min后取50 mL反应水样,加入1 mL的盐酸羟胺终止反应并用一定量的二氯甲烷萃取,测定反应中间产物的红外光谱并与苯的红外光谱进行对照,据此推断苯的降解机理。
2结果与讨论
2.1 高铁酸钾、双氧水用量对苯去除率的影响
在pH值为3.0、反应温度35 ℃、反应时间30 min的条件下,高铁酸钾、双氧水用量对苯去除率的影响如图1所示。
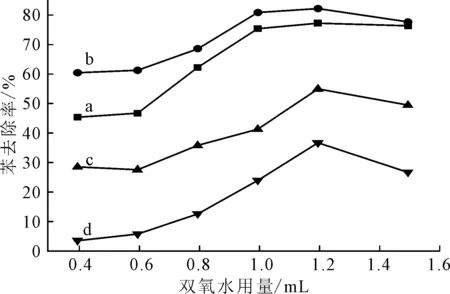
a~d, n(高铁酸钾)∶ n(苯):1∶1,2∶1,5∶1,10∶1 图1 高铁酸钾、双氧水用量对苯去除率的影响 Fig.1 Effect of K 2FeO 4 and H 2O 2 dosage on removal rate of benzene
由图1可知,在高铁酸钾用量一定的条件下,随着双氧水用量的增加,苯去除率先升高后下降;双氧水用量为1.2 mL(即H2O2质量约为0.4 g,H2O2与苯的质量比为8∶1)时,苯去除率达到最大值。这是由于,高铁酸钾的水解产物为Fe3+[6],当H2O2用量偏小时,Fe3+和H2O2反应,被还原成Fe2+[7],消耗了一部分H2O2,使得Fe2+催化产生的·OH减少,影响了降解效果。反应如下:
Fe3++H2O2→Fe2++HO++HO2·
(1)
Fe2++H2O2→Fe3++HO-+HO·
(2)
HO·+H2O2→H2O+HO2·
(3)
随着H2O2用量的增加,Fe2+催化产生的·OH逐渐增多,降解效果显著提高。但若H2O2过量,H2O2反而会消耗·OH,抑制苯的降解效果。在双氧水用量一定的条件下,随着高铁酸钾用量的增加,苯去除率先升高后降低。原理类似于H2O2过量后苯去除率降低的过程。
在相同条件下研究高铁酸钾用量对苯去除率的影响,结果如图2所示。

图2 高铁酸钾用量对苯去除率的影响 Fig.2 Effect of K 2FeO 4 dosage on removal rate of benzene
由图2可知,当高铁酸钾与苯物质的量比为2∶1 时,苯去除率达到60%左右,继续增加高铁酸钾用量,苯去除率趋于稳定。对照图1、图2可知,高铁酸钾与H2O2联用对苯降解的协同作用明显。
2.2 pH值对苯去除率的影响
在双氧水用量1.2 mL、高铁酸钾用量0.2538 g(高铁酸钾与苯物质的量比为2∶1 )、反应温度30 ℃、反应时间30 min的条件下, pH值对苯去除率的影响如图3所示。
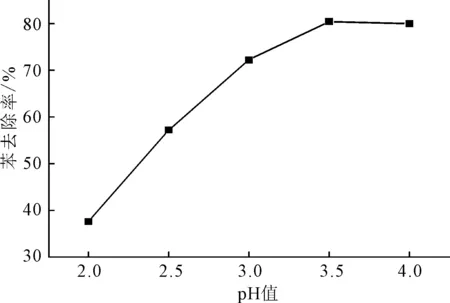
图3 pH值对苯去除率的影响 Fig.3 Effect of pH value on removal rate of benzene
由图3可知,随着pH值的增大,苯去除率逐渐上升,当pH值为3.5时,苯去除率最高可达80.41%;当pH值大于3.5时,苯去除率略有下降。较低的pH值有利于高铁酸钾的水解,反应如下[8]:
(4)
[O]+H2O→2HO·
(5)
2HO·→H2O2
(6)
对于Fenton体系,溶液pH值在2.5~3.5 时,·OH有较高的生成速率[9],能加快对苯的降解。但当pH值较低时,反应产物以Fe3+存在,消除了Fe(OH)3对苯的絮凝作用,导致苯去除率降低。随着pH值的增大,Fe(OH)3对苯的絮凝作用逐渐恢复,因此苯去除率随之上升。当pH值继续增大,阻碍了·OH的生成[8],苯去除率随之下降。因此,选择最佳pH值为3.5。
2.3 反应温度对苯去除率的影响
在双氧水用量1.2 mL、高铁酸钾用量0.2538 g、pH值为3.5、反应时间30 min条件下,反应温度对苯去除率的影响如图4所示。

图4 反应温度对苯去除率的影响 Fig.4 Effect of reaction temperature on removal rate of benzene
由图4可知,反应温度为10~40 ℃时,随着反应温度的升高苯去除率提高,当反应温度超过40 ℃时,苯去除率急剧下降。这是由于,该反应是吸热反应,在一定温度范围内升温会促进反应的进行,苯去除率上升;但温度过高时会加剧H2O2的分解,导致苯去除率下降。因此,选择最佳反应温度为40 ℃。
2.4 反应时间对苯去除率的影响
在双氧水用量1.2 mL、高铁酸钾用量0.2538 g、pH值为3.5、反应温度40 ℃条件下,反应时间对苯去除率的影响如图5所示。
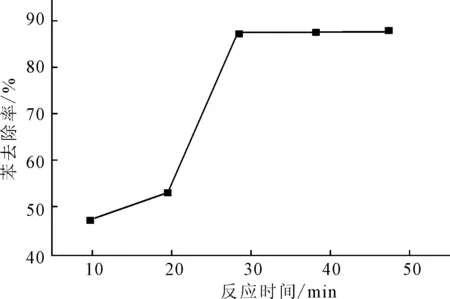
图5 反应时间对苯去除率的影响 Fig.5 Effect of reaction time on removal rate of benzene
由图5可知,随反应时间的延长苯去除率不断上升,在30 min时苯去除率达到最大,为87.5%;超过30 min后,苯去除率变化不大。因此,选择最佳反应时间为30 min。
2.5 反应机理推测
苯与苯降解反应5 min的中间产物的红外光谱见图6。
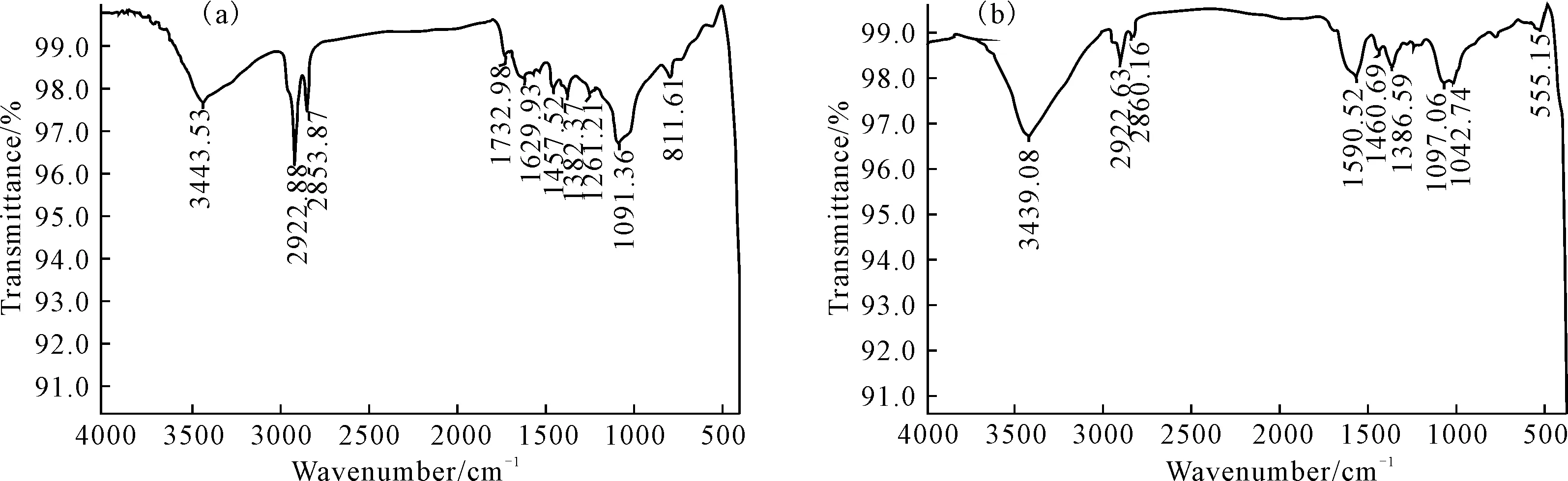
图6 苯(a)和苯降解反应5 min中间产物(b)的红外光谱 Fig.6 IR Spectra of benzene(a) and intermediate of benzene degradation for 5 min(b)
由图6a可以看出,3 443 cm-1处为H2O的-OH伸缩振动,2 923 cm-1、2 853 cm-1处分别为苯环上=CH和C-H的伸缩振动。苯环上C-H面外弯曲振动在1 091 cm-1处。由图6b可以看出,反应进行5 min后,苯的特征红外吸收有明显的减弱,表明苯被迅速地降解。1 590 cm-1附近、1 097 cm-1、1 042 cm-1处分别为中间产物C=C、C=O伸缩振动、仲醇伸缩振动、酚类C-OH弯曲振动。故推测苯的降解机理如图7所示。
3结论
高铁酸钾与双氧水联用降解含苯废水的最佳反应条件为:高铁酸钾与苯物质的量比为2∶1、双氧水用量为1.2 mL、pH值为3.5、反应时间为30 min、反应温度为40 ℃,苯去除率可达87.5%。
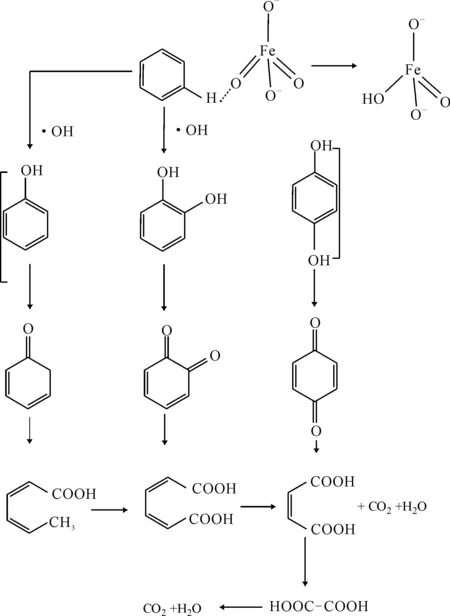
图7 苯的降解过程示意图 Fig.7 The degradation process diagram of benzene
高铁酸钾在酸性条件下有较好的氧化性,且和H2O2的最佳反应条件相匹配,两者的协同作用明显,高铁酸钾与H2O2联用处理含苯废水,可以减少高铁酸钾的用量,降低成本,并提高苯去除率。
参考文献:
[1]于方磊.三种水生植物对苯的净化作用研究[D].太原:山西大学,2012.
[2]北京市农业科学院农业环境保护研究室.苯与农作物[J].环境保护,1975,(4):39-40.
[3]张祯,孔瑾.Fenton 试剂处理苯、氯苯废水的实验研究[J].工程技术,2007,(34):289-292.
[4]张波,霸广忠,陈云伟,等.处理含苯废水的吸附实验研究[J].北方环境,2001,(3):36-38.
[5]邹东雷,李萌,邹昊辰,等.新型铁碳微电解填料处理含苯污染地下水的实验[J].吉林大学学报(地球科学版),2010,40(6):1441-1445.
[6]姜洪泉,于秀娟,王鹏,等.高铁酸钾预氧化去除水中苯酚及其机理[J].中国给水排水,2003,19(Z1):47-48.
[7]MA Y S.Improvement in carbofuran degradation by different Fentons reagent dosing processes[J].Toxicology and Industrial Health,2011,27(10):934-944.
[8]RUSH J D,BEILSKI B H J.Kinetics of ferrate(Ⅴ) decay in aqueous solution:A pulse-radiolysis study[J].Inorganic Chemistry,1989,28(21):3947-3951.
[9]高迎新,张昱,杨敏,等.Fe3+或Fe2+均相催化H2O2生成羟基自由基的规律[J].环境科学,2006,27(2):305-309.
[10]ARISTOVA N A,IVANOVA I P,TROFIMOVA S V,et al.Influence of luminol on the chemiluminescence intensity in Fent-on′s reaction[J].High Energy Chemistry,2011,45(6):505-509.
[11]SARMA R,ANGELES-BOZA A M,BRINKLEY D W,et al.Studies of the di-iron(Ⅵ) intermediate in ferrate-dependent oxygen evolution from water[J].Journal of the American Chemical Society,2012,134(37):15371-15386.
[12]HIGHTOWER S M,LORENZ B B,BERNARD J G,et al.Oxidation of phosphorus centers by ferrate(Ⅵ):Spectral observation of an intermediate[J].Inorganic Chemistry,2012,51(12):6626-6632.
[13]LEE Y,KISSNER R,von GUNTEN U.Reaction of ferrate(Ⅵ) with ABTS and self-decay of ferrate(Ⅵ):Kinetics and mechanisms[J].Environmental Science & Technology,2014,48(9):5154-5162.
[14]吴启模,吴建忠,杨兵,等.Fe2+-H2O2氧化法处理农药废水[J].环境工程,2005,23(5):88-89.
[15]ANQUANDAH G A K,SHARMA V K,KNIGHT D A,et al.Oxidation of trimethoprim by ferrate(Ⅵ):Kinetics,products,and antibacterial activity[J].Environmental Science & Technology,2011,45(24):10575-10581.
[16]OHTA T,KAMACHI T,SHIOTA Y,et al.A theoretical study of alcohol oxidation by ferrate[J].J Org Chem,2001,66(12):4122-4131.
[17]MIJANGOS F,VARONA F,VILLOTA N.Changes in solution color during phenol oxidation by Fenton reagent[J].Environ Sci Technol,2006,40(17):5538-5543.
[18]ZAZO J A,CASAS J A,MOHEDANO A F,et al.Chemical pathway and kinetics of phenol oxidation by Fenton′s reagent[J].Environ Sci Technol,2005,39(23):9295-9302.
[19]MUNOZ M,de PEDRO Z M,PLIEGO G,et al.Chlorinated byproducts from the Fenton-like oxidation of polychlorinated phenols[J].Ind Eng Chem Res,2012,51(40):13092-13099.
Treatment of Wastewater Containing Benzene by Potassium Ferrate
Combined with Hydrogen Peroxide
PING Cheng-jun1,LIANG Jian-kui3,JIN Shi-wei1,2,OUYANG Yi-de1,XIAO Lei1,LIU Dan1
(1.SchoolofChemicalEngineering&Pharmacy,WuhanInstituteofTechnology,Key
LaboratoryforGreenChemicalProcessofMinistryofEducation,Wuhan430073,China;
2.SchoolofChemistry&MaterialsScience,South-CentralUniversityforNationalities,
Wuhan430074,China;3.ConstructionandAdministrationBureauofSouth-to-North
WaterDiversionMiddleRouteProject,Beijing100038,China)
Abstract:The degradation of wastewater containing benzene was studied using potassium ferrate(K2FeO4) combined with H2O2.The effects of dosage of potassium ferrate and H2O2,pH value,reaction temperature and reaction time on removal rate of benzene were studied.The results showed that the optimal reaction conditions were as follows:mass ratio of potassium ferrate to benzene was 2∶1,dosage of H2O2 was 1.2 mL,pH value was 3.5,reaction temperature was 40 ℃,reaction time was 30 min.The removal rate of benzene reached 87.5%.The degradation mechanism was concluded by IR analysis of the degradation intermediate of benzene as well.
Keywords:wastewater containing benzene;potassium ferrate;hydrogen peroxide;degradation mechanism

