低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能、体组成、血清免疫和抗氧化指标的影响
裘金木孙育平曹俊明,3,4胡俊茹王国霞陈 冰黄燕华,3,4∗∗
(1.广东省农业科学院动物科学研究所,广州510640;2.华中农业大学水产学院,武汉430070;3.广东省动物育种与营养公共实验室,广州510640;4.广东省畜禽育种与营养研究重点实验室,广州510640)
低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能、体组成、血清免疫和抗氧化指标的影响
裘金木1,2孙育平1,3,4∗曹俊明1,2,3,4胡俊茹1,3,4王国霞1,3,4陈 冰1,3,4黄燕华1,2,3,4∗∗
(1.广东省农业科学院动物科学研究所,广州510640;2.华中农业大学水产学院,武汉430070;3.广东省动物育种与营养公共实验室,广州510640;4.广东省畜禽育种与营养研究重点实验室,广州510640)
摘 要:本试验旨在研究低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能、体组成、血清免疫和抗氧化指标的影响。试验选取初始体重为(2.00±0.01)g的凡纳滨对虾960尾,随机分成6组(HT0、LT0、LT1、LT2、LT3、LT4),每组4个重复,每个重复40尾虾。HT0、LT0、LT1、LT2、LT3、LT4对虾分别投喂含40.79%粗蛋白质的高蛋白质饲料,以及含37.01%粗蛋白质并分别添加0、1.20、2.50、5.00和10.00 g/kg色氨酸的低蛋白质饲料,试验期为8周。结果表明:LT2、LT3对虾的终末体重、增重率和特定生长率显著高于HT0(P<0.05);LT1、LT2、LT3的摄食量显著高于HT0和LT0(P<0.05);LT0、LT3、LT4的蛋白质效率显著高于HT0(P<0.05);饲料系数在HT0、LT0、LT3、LT4之间无显著差异(P>0.05);除LT1和LT3成活率较低外,其他组间无显著差异(P>0.05);与HT0和LT0相比,LT1、LT2、LT3、LT4肝胰指数、全虾水分和粗灰分含量均无显著变化(P>0.05)。全虾粗蛋白质含量LT2、LT3、LT4与HT0无显著差异(P>0.05),但LT4显著高于LT0和LT1(P<0.05);全虾粗脂肪含量LT0、LT2、LT3与HT0相比无显著差异(P>0.05),但LT1、LT4显著低于HT0(P<0.05)。对虾血清酚氧化酶、碱性磷酸酶、总超氧化物歧化酶活性及总抗氧化能力各组间均无显著差异(P>0.05);LT2血清过氧化氢酶活性显著高于LT0(P<0.05);LT2、LT3和LT4血清丙二醛含量均显著低于LT0(P<0.05),但与HT0相比无显著差异(P>0.05)。由此可见,在低蛋白质饲料中添加色氨酸可增加凡纳滨对虾的机体蛋白质沉积,增强对虾免疫和抗氧化能力,提高生长性能。本试验条件下,分别以增重率和血清过氧化氢酶活性为评价指标,通过回归方程得出含37.01%粗蛋白质的低蛋白质饲料中色氨酸的适宜含量分别为7.53和8.04 g/kg。
关键词:凡纳滨对虾;低蛋白质饲料;色氨酸;生长性能;血清生化指标
∗同等贡献作者
∗∗通信作者:黄燕华,研究员,硕士生导师,E⁃mail:huangyh111@126.com
饲料蛋白质是决定水产动物生长最关键的营养物质,同时也是影响饲料成本的主要因素[1],饲料蛋白质作为能量利用时还将伴随着氮的排泄而影响水体环境[2]。因此,如何调控动物生长并提高水产动物饲料蛋白质的利用率成为国内外学者研究的重要课题。近年来,我国水产养殖业迅猛发展,水产养殖业已经成为我国农业生产的一大重要支柱产业。然而,随着水产养殖动物规模的扩大,饲料蛋白质日益匮乏。据估测,2015年我国的蛋白质资源缺口达到2 520万t[3]。蛋白质饲料原料的短缺已成为水产养殖和饲料工业发展的主要限制因子。同时,高蛋白质饲料的使用将释放一部分氮到水体环境中,对水体环境造成负面影响[3]。因此,在寻找新型饲料蛋白质源的同时,开展降低水产动物饲料蛋白质水平、提高饲料蛋白质利用效率的研究,对于降低水产动物养殖成本,缓解我国蛋白质资源短缺以及减少对环境污染等方面都有很大的积极意义。
目前,营养调控是提高动物生长性能和降低饲料蛋白质水平的主要手段之一。氨基酸是生命活动的物质基础,是动物营养学研究的热点。动物对蛋白质的需要,实际是对氨基酸的需要。饲料中适宜的氨基酸含量可以最大限度地调控动物的生长和饲料转化率。色氨酸作为一种功能性的氨基酸,在动物体组成、免疫、摄食、抗应激等方面发挥积极的作用[4-10]。在畜禽动物的研究中发现,在低蛋白质饲料中添加色氨酸,可以提高摄食量、促进蛋白质沉积和营养物质的消化吸收,从而提高生长性能,可获得与高蛋白质饲料相似的生长性能[11-14],但国内外对色氨酸在水产动物低蛋白质饲料中的研究尚未见报道。
凡纳滨对虾(Litopenaeus vannamei)被公认为是世界上三大优良对虾种之一,具有适应盐度范围广、抗逆境能力强、肉质鲜美、营养价值较高等优点,该虾种自1988年引入我国后,其养殖迅速遍及全国,已成为我国水产养殖的支柱产业[15]。据调查显示,2013年我国水产饲料产量为1 900万t,其中对虾料约136万t。在集约化养殖条件下,凡纳滨对虾一般使用高蛋白质、高鱼粉饲料。NRC(2011)推荐体重为0.1~5.0 g的凡纳滨对虾对蛋白质的需要量为40%。而近年来鱼粉价格不断上涨、品质不一,致使高比例的植物蛋白质源和低蛋白质饲料在对虾养殖中开始应用。然而,高比例植物蛋白质源饲料通常会出现对虾所需必需氨基酸的缺乏,而饲料蛋白质水平过低又会对对虾的生长和免疫抗病能力产生不良影响。色氨酸是对虾的必需氨基酸[16],Akiyama等[17]和Forster等[18]根据凡纳滨对虾肌肉的氨基酸组成得出凡纳滨对虾对饲料中色氨酸的需要量为0.8%。本课题组前期研究表明,在饲料中添加色氨酸可提高凡纳滨对虾的蛋白质效率和生长性能[9]。
鉴于畜禽动物添加色氨酸使用低蛋白质饲料的效果,若可通过添加色氨酸改善对虾的生长性能,既可有效缓解对虾养殖饲料蛋白质资源短缺的问题,还可降低对虾饲料成本和减少水体氮排放。因此,本试验通过在凡纳滨对虾低蛋白质饲料中添加色氨酸,研究其对凡纳滨对虾生长性能、体组成和血清免疫和抗氧化指标的影响,为凡纳滨对虾色氨酸营养研究提供依据,并为探讨凡纳滨对虾低蛋白质饲料替代高蛋白质饲料在生产中应用的可行性提供一种新途径。
1 材料与方法
1.1 试验材料
晶体色氨酸(L-色氨酸,食品级,纯度≥98%,日本味之素产品),购自广州市毅盈贸易有限公司。
1.2 试验饲料
对照组(HT0)投喂含40.79%粗蛋白质、4.1 g/kg色氨酸(估测值)的高蛋白质饲料,试验组投喂含37.01%粗蛋白质、3.9 g/kg色氨酸(估测值)并分别添加0(LT0)、1.20(LT1)、2.50(LT2)、5.00(LT3)和10.00 g/kg(LT4)色氨酸的低蛋白质饲料。高蛋白质饲料与低蛋白质饲料组成及营养水平见表1。原料经粉碎过80目筛,混合均匀后用SLX-80型双螺杆挤压机制成1.00 mm的颗粒饲料,55℃烘干,自然冷却后放入塑料自封袋中,置于-20℃冰箱中保存备用。实测HT0、LT0、LT1、LT2、LT3、LT4饲料中色氨酸含量分别为3.90、3.10、5.50、6.40、8.20、11.40 g/kg,试验饲料中其他氨基酸含量如表2所示。
1.3 饲养管理
饲养试验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖系统(水体容积300 L)中进行。试验共有6组,每组4个重复,每个重复挑选健康活泼的凡纳滨对虾40尾并称重,初始体重为(2.00±0.01)g。每组随机投喂1种试验饲料,分别在08:00、14:30和20:00进行饱食投喂,饲养周期为8周。每天观察凡纳滨对虾的健康状况和吃食情况,记录摄食量、死亡虾数并称重。试验期间为自然光照,保持盐度5‰~7‰,水温为28.0~30.5℃,溶氧量≥5 mg/L,pH 7.8~ 8.2,氨氮浓度≤0.1 mg/L,亚硝态氮浓度≤0.01 mg/L。

表1 高蛋白质饲料与低蛋白质饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of high protein diet and low protein diet(air⁃dry basis) %

表2 试验饲料氨基酸组成(风干基础)Table 2 Composition of amino acids in experimental diets(air⁃dry basis) %

续表2
1.4 样品采集与分析
饲养试验结束前停食24 h,捞取每个重复的虾进行计数,称重和测量体长;并随机挑选5尾虾,分别剥离肝胰腺后称重,计算摄食量(FI)、增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)、存活率(SR)、肝胰指数(HSI);另每个重复随机取13尾虾,从围心腔取血,血液采集后静置4 h后,10 000 r/min离心10 min,取血清分装,将血清置于-80℃冰箱保存,用于血清免疫和抗氧化指标测定。血清碱性磷酸酶(alkaline phosphatase,AKP)、总超氧化物歧化酶(total superoxide dismutase,T⁃SOD)活性及丙二醛(malondialdehyde,MDA)含量均采用南京建成生物工程研究所生产的试剂盒进行测定,测定方法按照试剂盒说明书进行。血清酚氧化物酶(phenol oxidase,PO)活性的测定参考Ashida[19]的方法。
每个重复再取6尾虾用于虾体成分分析。其中,粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)、粗脂肪含量采用索氏抽提法(GB/T 6433—1994)、粗灰分含量采用550℃灼烧法(GB/T 6438—1992)、水分含量采用105℃烘箱干燥法(GB/T 6435—1986)进行测定。
1.5 计算公式
WGR(%)=100×(Wt-W0)/W0;
SGR(%/d)=100×(lnWt-lnW0)/t;
FCR=F/(Wt-W0);
HSI(%)=100×Wh/Wt;
PER(%)=100×(Wt-W0)/(F×Pf);
SR(%)=100×Nf/Ni;
FI(g/尾)=F/[(Ni+Nf)/2]。
式中:W0为试验开始时虾体重(g);Wt为试验结束时虾体重(g);F为饲料摄入量(g);t为试验天数(d);Nf为终末尾数;Ni为初始尾数;Wh为肝胰脏重量(g);Pf为饲料粗蛋白质含量(%)。
1.6 统计分析
试验结果用平均值±标准差(mean±SD)表示,采用SPSS 17.0统计软件进行单因素方差分析(one⁃way ANOVA),利用Duncan氏法进行组间显著性分析,差异显著性水平为P<0.05。
2 结 果
2.1 低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能的影响
由表3可知,各组对虾初始体重均无显著差异(P>0.05)。LT0、LT1、LT4终末体重、WGR、SGR与HT0相比无显著差异(P>0.05),但LT2、LT3显著高于HT0(P<0.05)。低蛋白质饲料中添加色氨酸可提高对虾的FI,其中,LT1、LT2、LT3显著高于HT0和LT0(P<0.05),但HT0、LT0和LT4之间无显著差异(P>0.05)。LT1的FCR显著高于LT0和HT0(P<0.05),但HT0、LT0、LT3、LT4之间无显著差异(P>0.05)。LT0、LT3、LT4的PER显著高于HT0(P<0.05),而LT1显著低于LT0(P<0.05),但LT0、LT2、LT3、LT4之间均无显著差异(P>0.05)。除LT1和LT3的SR较低外,其他组间无显著差异(P>0.05)。各组HSI均无显著差异(P>0.05)。

表3 低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能的影响Table 3 Effects of low protein diet supplemented with tryptophan on growth performance of Litopenaeus vannamei
2.2 低蛋白质饲料中添加色氨酸对凡纳滨对虾体组成的影响
由表4可知,对虾全虾水分、粗灰分含量各组间无显著差异(P>0.05)。全虾粗蛋白质含量LT2、LT3、LT4与相比HT0无显著差异(P>0.05),但LT4显著高于LT0和LT1(P<0.05)。全虾粗脂肪含量LT0、LT2、LT3与HT0相比无显著差异(P>0.05),但LT1、LT4显著低于HT0(P<0.05)。
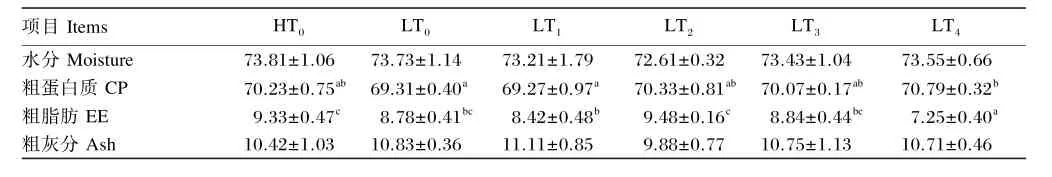
表4 低蛋白质饲料中添加色氨酸对凡纳滨对虾体组成的影响(干物质基础)Table 4 Effects of low protein diet supplemented with tryptophan on body composition ofLitopenaeus vannamei(DM basis) %
2.3 低蛋白质饲料中添加色氨酸对凡纳滨对虾血清免疫和抗氧化指标的影响
由表4可知,各试验组对虾血清PO、AKP、T⁃SOD活性及T⁃AOC与HT0相比均无显著差异(P>0.05)。LT2血清CAT活性显著高于LT0(P<0.05),其他组间无显著差异(P>0.05)。LT2、LT3和LT4血清MDA含量显著低于LT0(P<0.05),但与HT0相比没有显著差异(P>0.05)。
2.4 凡纳滨对虾低蛋白质饲料中色氨酸的适宜含量
抛物线模型拟合回归方程分析得出,低蛋白质饲料中色氨酸含量与对虾WGR和血清CAT活性之间的关系曲线分别见图1和图2,并分别获得方程y=-1.373 9x2+20.681x+561.37(R2=0.578 2)(y表示凡纳滨对虾WGR,x表示低蛋白质饲料中色氨酸含量)、y=-0.105 3x2+1.694 1x- 0.828 2(R2=0.705 0)(y表示凡纳滨对虾血清CAT活性,x表示低蛋白质饲料中色氨酸含量)。以凡纳滨对虾WGR和血清CAT活性为评价指标,通过回归方程计算得出本试验条件下低蛋白质饲料中色氨酸的适宜含量分别为7.53和8.04 g/kg。
3 讨 论
3.1 低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能的影响
蛋白质是对虾饲料中必需的核心营养物质,蛋白质不足影响对虾的生长性能和SR。本研究结果表明,在低蛋白质饲料(含37.01%粗蛋白质)中添加适量色氨酸可显著地提高凡纳滨对虾的WGR、SGR,获得比高蛋白质饲料(含40.79%粗蛋白质)更好的生长性能。王荣发等[11]研究表明,将(23.60±2.17)kg生长猪饲粮的蛋白质水平降低4%,补充0.146%的色氨酸后,并不影响猪的生长性能。也有研究发现将22 kg左右仔猪饲粮的粗蛋白质含量降低3%,补充赖氨酸、蛋氨酸和苏氨酸以及在此基础上继续添加色氨酸,对仔猪的生长性能均没有产生显著不利的影响[12]。苏有健等[13]研究仔猪低蛋白质饲粮时发现,在蛋白质水平降低3%的饲粮中补充0.06%的色氨酸以后,与高蛋白质饲粮组的生长性能没有显著差异。梁福广[14]研究发现,将生长猪的基础饲粮的蛋白质水平降低4%,并使可消化色氨酸水平达到0.41%,可取得较好的生长性能,本试验的结果与以上研究一致,表明饲料中添加适宜色氨酸可提高凡纳滨对虾的生长性能,从而降低饲料中蛋白质水平,达到节约饲料成本的目的。本试验中,WGR和SGR在HT0和LT0之间无显著差异,这可能与投喂方式、养殖环境等有关[20],但具体原因还有待进一步研究。

表4 低蛋白质饲料中添加色氨酸对凡纳滨对虾血清免疫和抗氧化指标的影响Table 4 Effects of low protein diet supplemented with tryptophan on immunity and antioxidant indexes in serum of Litopenaeus vannamei

图1 低蛋白质饲料中色氨酸含量与凡纳滨对虾增重率的关系Fig.1 Relationship between tryptophan content in the low protein diet and WGR of Litopenaeus vannamei
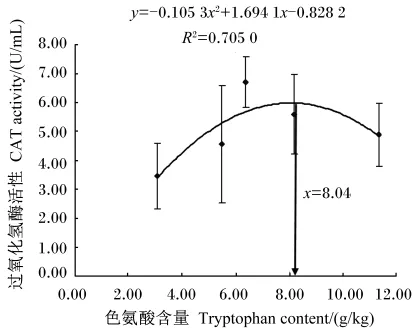
图2 低蛋白质饲料中色氨酸含量与凡纳滨对虾过氧化氢酶活性的关系Fig.2 Relationship between tryptophan content in the low protein diet and serum CAT activity of Litopenaeus vannamei
摄食是动物生长的前提和物质基础,与生长、发育、繁殖等生产性能密切相关,但低蛋白质饲料可对动物的摄食产生不良的影响。色氨酸是一种较早被发现具有摄食调控作用的氨基酸。有研究表明,色氨酸提高动物的生长性能可能与其提高动物的摄食量有关[21-24]。魏宗友等[21]在扬州鹅饲粮中添加高、中、低水平的色氨酸后,与高、低色氨酸组相比,中色氨酸组扬州鹅的采食量和日增重率显著增加。Tang等[22]在建鲤饲料添加不同水平色氨酸以后,随着色氨酸含量的提高,建鲤的FI和WGR同步提高。Basic等[23]和Wen等[24]分别在大西洋鲟(Acipenser sturio)和草鱼中也得出类似的结论。从本试验结果可以看出,当在饲料中添加0.25%的色氨酸时,对虾的FI达到最大,而WGR与FI的此规律一致,即添加0.25%色氨酸的LT2高于HT0、LT0、LT4。这表明色氨酸可能通过调控对虾的摄食提高其生长性能,但其调控机理有待进一步研究。
FCR是衡量虾对饲料利用效果的重要指标,FCR的高低除与饲料质量有关外,还与虾对饲料的消化、吸收以及代谢有关[20]。在饲料蛋白质水平较低的情况下,对虾为了获得足够的营养,会摄取更多的饲料来满足生长而导致FCR升高[2,25],本试验结果与此相似。本试验过程中,LT1、LT3个别重复因虾蜕皮不完全造成虾死亡,引起死亡率升高,尽管SR均大于80%,但还是对试验结果产生了一定影响。本试验中,投喂低蛋白质饲料对虾的SR较投喂高蛋白质饲料的降低,这与以往研究结果[2,26]相似,证明了低蛋白质饲料会导致对虾SR下降。除LT1、LT3外,低蛋白质饲料中添加色氨酸后可提高SR,与添加色氨酸后可明显提高虹鳟SR的报道[27]一致,也与当饲料中含有0.7%~1.0%色氨酸时,锯缘青蟹(Scylla serrate)SR最高的结果[28]一致。这进一步证实了饲料中添加色氨酸对提高动物SR具有一定的作用。有研究者推测,色氨酸提高动物SR与色氨酸衍生的5-羟色胺(5⁃HT)调控有关[29]。
3.2 低蛋白质饲料中添加色氨酸对凡纳滨对虾体组成的影响
许多学者研究发现,饲料中色氨酸缺乏导致试验鱼生长缓慢,鱼体蛋白质合成降低,表现为蛋白质沉积下降,但添加色氨酸后则明显改善上述状况[8,30]。本试验结果表明,在低蛋白质饲料中添加适量色氨酸后能够显著提高全虾粗蛋白质含量,且与投喂高蛋白质饲料对虾相比没有显著差异。研究认为,这可能主要是由于色氨酸可通过5⁃HT对能量物质如蛋白质等的代谢比例分配调节具有决定性意义[30]。此外,色氨酸还能参与脂肪代谢。本试验中,在低蛋白质饲料中添加色氨酸,凡纳滨对虾全虾粗脂肪含量呈下降趋势,与饲料中添加色氨酸可降低印度鲮[8]和凡纳滨对虾[9]体脂肪含量的结果相似。Ahmed等[8]在印度鲮饲料中添加不同水平的色氨酸后,全鱼脂肪含量呈上升趋势,当饲料中的色氨酸含量达到0.36%时,全鱼脂肪含量达到最低。本试验中LT4的全虾粗蛋白质含量达到最大,但粗脂肪含量显著低于其他各组,与Ahmed等[8]的研究结果相似,说明过高的色氨酸含量会影响降低体脂肪的沉积。这可能与色氨酸的不断累积和肝胰腺及神经组织中5⁃HT水平升高对脂质过氧化作用产生影响有关。因此,添加色氨酸可减少肝脏脂肪(尤其是甘油三酯)的含量,而且随着添加水平增加,机体脂肪的积累也将逐渐减少。有关色氨酸调节对虾体组成的机理相对复杂,有待进一步深入研究。
3.3 低蛋白质饲料中添加色氨酸对凡纳滨对虾血清免疫和抗氧化指标的影响
甲壳动物不具有特异性免疫功能,主要通过非特异性免疫发挥功能。酚氧化酶原激活系是甲壳动物重要的防御和识别系统,由丝氨酸蛋白酶和其他相关因子组成。酚氧化酶原激活系与脊椎动物的补体系统相似,在识别异物、提供调理素,促进血细胞的吞噬作用、包囊作用和结节的形成以及介导凝集和凝固产生杀菌物质等免疫功能方面发挥重要作用[31-32]。PO是酚氧化酶原激活系统的产物,是衡量机体免疫功能的重要指标。本研究表明,在低蛋白质饲料中添加色氨酸能够在一定程度提高血清PO活性,与高蛋白质饲料相比没有显著差异。在氨基酸促进PO活性方面,Zhou等[33]报道在凡纳滨对虾饲料中添加苏氨酸显著提高对虾血清PO活性,但关于氨基酸提高血清PO活性的机理尚未见报道。
AKP是一种能催化磷酸单脂水解酶及磷酸基团转移反应的磷酸单酯酶类,是动物体内重要免疫相关酶,与体内营养物质的消化、吸收、利用和转运有关。在甲壳动物体内,AKP还与动物对海水中钙质吸取、磷酸钙沉积、甲壳素分泌及形成直接相关。甲壳动物在生长过程都要经历蜕壳过程,该酶对于虾的生存具有特别重要的意义[34]。王用黎[10]在凡纳滨对虾饲料中添加色氨酸以后,显著提高了血清AKP活性,Tang等[22]在建鲤中也得出相似的结论。本试验结果也发现在低蛋白质饲料中添加色氨酸能够在一定程度上提高凡纳滨对虾血清AKP活性。
T⁃AOC在体内被分成抗氧化酶系统和非酶促系统2个部分,是反映机体抗氧化能力的综合性指标,其主要作用是分解和清除机体内代谢过程产生的活性氧。T⁃SOD和CAT是生物体内一类重要的抗氧化酶,具有特殊的生理活性,在生物体的自我防御系统以及免疫系统中起非常重要的作用[35-36]。MDA是机体被自由基氧化的产物之一,其含量的多少不仅可以反映出膜脂质过氧化的程度,也可间接的反映机体抗氧化作用的强弱。有研究表明,色氨酸在机体抗氧化方面发挥积极的作用。魏宗友等[21]研究表明,与低色氨酸组相比,中、高色氨酸组扬州鹅血清SOD活性和T⁃AOC显著升高,MDA含量有降低的趋势。在斑鸠上的研究发现,色氨酸可增强血清SOD活性,并降低血清MDA含量[37]。周斌[38]研究表明,饲粮中适量添加色氨酸,蛋鸡血清中MDA含量显著降低。本试验研究发现,在低蛋白质饲料中适量添加色氨酸能显著提高凡纳滨对虾血清CAT活性,同时对血清T⁃AOC和T⁃SOD活性也有一定程度地提高,血清MDA含量则显著降低,与上述研究结果相似。这可能与低蛋白质饲料添加色氨酸后,对虾摄食了较多色氨酸,导致过多的色氨酸降解,从而使动物机体中的抗氧化能力提高。
4 结 论
①在含37.01%粗蛋白质的低蛋白质饲料中适量添加色氨酸可改善凡纳滨对虾的营养物质沉积,增强免疫和抗氧化能力,获得比含40.79%粗蛋白质的高蛋白质饲料更好的生长性能。
②本试验条件下,以WGR和血清CAT活性为评价指标,通过回归方程得出含37.01%粗蛋白质的低蛋白质饲料中色氨酸的适宜含量分别为7.53和8.04 g/kg。
参考文献:
[1] 胡毅.凡纳滨对虾饲料配方优化及几种饲料添加剂的应用[D].博士学位论文.青岛:中国海洋大学,2007.
[2] 陈义方.不同规格凡纳滨对虾对蛋白质和蛋氨酸需要量研究[D].硕士学位论文.上海:上海海洋大学,2012.
[3] 刘明美.蛋白质饲料的开发利用现状[J].江西饲料,2012(6):17-19.
[4] COLOSO R M,TIRO L B,BENITEZ L V.Require⁃ment for tryptophan by milkfish(Chanos chanos Forsskal)juveniles[J].Fish Physiology and Biochem⁃istry,1992,10(1):35-41.
[5] CIJI A,SAHU N P,PAL A K,et al.Haemato⁃immu⁃nological responses of nitrite exposed Labeo rohita fed diets supplemented with vitamin E and L⁃tryptophan,challenged by Aeromonas hydrophila[J].Israeli Jour⁃nal of Aquaculture,2013,65:889-897.
[6] TEJPAL C S,PAL A K,SAHU N P,et al.Dietary supplementation of L⁃tryptophan mitigates crowding stress and augments the growth in Cirrhinus mrigala fingerlings[J].Aquaculture,2009,293(3/4):272-277.
[7] HÖGLUND E,SØRENSEN C,BAKKE M J,et al.At⁃tenuation of stress⁃induced anorexia in brown trout (Salmo trutta)by pre⁃treatment with dietary L⁃trypto⁃phan[J].British Journal of Nutrition,2007,97(4):786-789.
[8] AHMED I,KHAN M A.Dietary tryptophan require⁃ment of fingerling Indian major carp,Cirrhinus mriga⁃la(Hamilton)[J].Aquaculture Research,2005,36 (7):687-695.
[9] SUN Y P,GUAN L Z,XIONG J H,et al.Effects of L⁃tryptophan⁃supplemented dietary on growth perform⁃ance and 5⁃HT and GABA levels in juvenile Litope⁃naeus vannamei[J].Aquaculture International,2015,23(1):235-251.
[10] 王用黎.凡纳滨对虾幼虾对苏氨酸,亮氨酸,色氨酸和缬氨酸需要量的研究[D].硕士学位论文.湛江:广东海洋大学,2013.
[11] 王荣发,李敏,贺喜,等.低蛋白质饲粮条件下生长猪对色氨酸需要量的研究[J].动物营养学报,2011,23(10):1669-1676.
[12] 陈娥英,杨玉芬,乔建国.仔猪不同低蛋白日粮添加赖氨酸、蛋氨酸、苏氨酸和色氨酸的效果研究[J].江西农业大学学报,2006,27(5):764-768.
[13] 苏有健,李德发,邢建军,等.在低蛋白日粮中添加色氨酸对仔猪生产性能及血清游离氨基酸和尿素氮的影响[J].中国畜牧杂志,2005,41(1):26-28.
[14] 梁福广.生长猪低蛋白日粮可消化赖、蛋+胱、苏、色氨酸平衡模式的研究[D].博士学位论文.北京:中国农业大学,2005.
[15] 黄文文,郑昌区,霍雅文,等.凡纳滨对虾不同生长阶段的蛋白质需要量[J].动物营养学报,2014,26 (9):2675-2686.
[16] SHIAU S Y.Nutrient requirements of penaeid shrimps [J].Aquaculture,1998,164(1/2/3/4):77-93.
[17] AKIYAMA D M,DOMINY W G.Penaeid shrimp nu⁃trition for the commercial feed industry[C]//Texas shrimp farming manual:grow⁃out technology.College Station TX:Texas A&M University,1989:1-50.
[18] FORSTER I P,DOMINY W,TACPN A G J.The use of concentrates and other soy products in shrimp feeds [G]//Avances en Nutricion AcuicolaⅥ.Memorias delⅥSimposium Internacional de Nutricion Acuico⁃la.3⁃6 de Septiembre del 2002.Cancun,Quintana Roo,Mexico,2002.
[19] ASHIDA M.Purification and characterization of pre⁃phenoloxidase from hemolymph of the silkworm Bom⁃byx mori[J].Archives of Biochemistry and Biophys⁃ics,1971,144(2):749-762.
[20] 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996.
[21] 魏宗友.色氨酸对鹅组织蛋白质代谢调控机制的影响[D].硕士学位论文.扬州:扬州大学,2012.
[22] TANG L,FENG L,SUN C Y,et al.Effect of trypto⁃phan on growth,intestinal enzyme activities and TOR gene expression in juvenile Jian carp(Cyprinus carpio var.Jian):studies in vivo and in vitro[J].Aquacul⁃ture,2013,412-413:23-33.
[23] BASIC D,SCHJOLDEN J,KROGDAHL Å,et al.Changes in regional brain monoaminergic activity and temporary down⁃regulation in stress response from di⁃etary supplementation with L⁃tryptophan in Atlantic cod(Gadus morhua)[J].British Journal of Nutri⁃tion,2013,109(12):2166-2174.
[24] WEN H L,FENG L,JIANG W D,et al.Dietary tryp⁃tophan modulates intestinal immune response,barrier function,antioxidant status and gene expression of TOR and Nrf2 in young grass carp(Ctenopharyng⁃odon idella)[J].Fish&Shellfish Immunology,2014,40(1):275-287.
[25] WARD L R,CARTER C G,CREAR B J,et al.Opti⁃mal dietary protein level for juvenile Southern rock lobster,Jasus edwardsii,at two lipid levels[J].Aqua⁃culture,2003,217(1/2/3/4):483-500.
[26] 夏苏东,李勇,王文琪,等.蛋白质营养对高密度养殖凡纳滨对虾生长与免疫力的影响[J].海洋科学,2009,33(5):50-58.
[27] WALTON M J,COLOSO R M,COWEY C B,et al.The effects of dietary tryptophan levels on growth and metabolism of rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1984,51(2):279-287.
[28] LARANJA J L Q,QUINITIO E T,CATACUTAN M R,et al.Effects of dietary L⁃tryptophan on the agonistic be⁃havior,growth and survival of juvenile mud crab Scylla serrata[J].Aquaculture,2010,310(1/2):84-90.
[29] HSEU J R,LU F I,SU H M,et al.Effect of exogenous tryptophan on cannibalism,survival and growth in ju⁃venile grouper,Epinephelus coioides[J].Aquaculture,2003,218(1/2/3/4):251-263.
[30] AHMED I.Dietary amino acid L⁃tryptophan require⁃ment of fingerling Indian catfish,Heteropneustes fossi⁃lis(Bloch),estimated by growth and haemato⁃bio⁃chemical parameters[J].Fish Physiology and Bio⁃chemistry,2012,38(4):1195-1209.
[31] LE FlOĈH N,SEVE B.Biological roles of tryptophan and its metabolism:potential implications for pig feed⁃ing[J].Livestock Science,2007,112(1/2):23-32.
[32] 孟凡伦,张玉臻,孔健,等.甲壳动物中的酚氧化酶原激活系统研究评价[J].海洋与湖沼,1999,30(1):110-116.
[33] ZHOU Q C,WANG Y L,WANG H L,et al.Dietary threonine requirements of juvenile Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture,2013,392/393/394/395:142-147.
[34] 陈清西,陈素丽,石艳,等.长毛对虾碱性磷酸酶性质[J].厦门大学学报:自然科学版,1996,35(2):257-261.
[35] KOHEN R,NYSKA A.Invited review:oxidation of biological systems:oxidative stress phenomena,an⁃tioxidants,redox reactions,and methods for their quan⁃tification[J].Toxicologic Pathology,2002,30(6):620-650.
[36] NII C M,MUSCATINE L.Oxidative stress in the symbiotic sea anemone Aiptasia pulchella(Carlgren,1943):contribution of the animal to superoxide ion production at elevated temperature[J].The Biological Bulletin,1997,192(3):444-456.
[37] TERRÓN M P,DELGADO J,PAREDES S D,et al.Effect of melatonin and tryptophan on humoral immuni⁃ty in young and old ringdoves(Streptopelia risoria)[J].Experimental Gerontology,2009,44(10):653-658.
[38] 周斌.日粮色氨酸水平对蛋鸡生产性能与蛋品质的影响及其机理探讨[D].硕士学位论文.杭州:浙江大学,2010.
Effects of Low Protein Diet Supplemented with Tryptophan on Growth Performance,Body Composition,Immunity and Antioxidant Functions in Serum of Litopenaeus vannamei
QIU Jinmu
1,2
SUN Yuping
1,3,4∗
CAO Junming
1,2,3,4
HU Junru
1,3,4
WANG Guoxia
1,3,4
CHEN Bing
1,3,4
HUANG Yanhua
1,2,3,4∗∗
(责任编辑 菅景颖)
(1.Institute of Animal Science,Guangdong Academy of Agricultural Sciences,Guangzhou 510640 China;2.College of Fisheries,Huazhong Agricultural University,Wuhan 430070,China;3.Guangdong Public Laboratory of Animal Breeding and Nutrition,Guangzhou 510640,China;4.Guangdong Key Laboratory of Animal Breeding and Nutrition,Guangzhou 510640,China)
∗Contributed equally
∗∗Corresponding author,professor,E⁃mail:huangyh111@126.com
Abstract:This experiment was conducted to examine the effects of low protein diet supplemented with trypto⁃phan on growth performance,body composition,immunity and antioxidant functions in serum of Litopenaeus vannamei.A total of 960 Litopenaeus vannamei with the average body weight of(2.00±0.01)g were random⁃ly allocated into 6 groups(HT0,LT0,LT1,LT2,LT3and LT4)with 4 replicates per group and 40 shrimp per replicate.Shrimp in HT0were fed a high protein diet with 40.79%crude protein,and Shrimp in LT0,LT1,LT2,LT3and LT4were fed low protein diets which contained 37.01%crude protein and supplemented with 0,1.20,2.50,5.00 and 10.00 g/kg tryptophan,respectively.The feeding experiment lasted for 8 weeks.The re⁃sults showed that the final body weight,weight gain rate,specific growth rate in LT2and LT3were significant⁃ly higher than those in HT0(P<0.05);the feed intake in LT1,LT2and LT3was significantly higher than that in HT0and LT0(P<0.05);the protein efficiency ratio in LT0,LT3and LT4was significantly higher than that in HT0(P<0.05);the feed conversion rate was found no significant difference among HT0,LT0,LT3and LT4(P>0.05);the survival rate was lower in LT1and LT3,but the other four groups showed no significant differ⁃ence(P>0.05);the hepatosomatic index,moisture and ash contents of whole⁃body in LT1,LT2,LT3and LT4had no significant differences compared with HT0and LT0(P>0.05).There was no significant difference in the whole⁃body crude protein content among LT2,LT3,LT4and HT0(P>0.05),however,LT4was signifi⁃cantly higher than LT0and LT1(P<0.05);the ether extract content of whole⁃body in LT1and LT4was signifi⁃cantly reduced compared with HT0(P<0.05),while there no significant difference among LT0,LT2,LT3and HT0(P>0.05).The activities of phenol oxidase,alkaline phosphatase and total superoxide dismutase,and total antioxidant capacity in serum had no significant differences among all the groups(P>0.05);the serum cata⁃lase activity in LT2was significantly higher than that in LT0(P<0.05);the serum malonaldehyde content in LT2,LT3and LT4was significantly lower than that in LT0(P<0.05),but it in LT2,LT3and LT4showed no significant difference compared with HT0(P>0.05).In conclusion,tryptophan supplemented in the low protein diets can increase the whole⁃body protein deposition,improve the immunity and antioxidant functions,and en⁃hance the growth performance.Regression analysis base on weight gain rate and serum catalase activity indi⁃cates that the optimal dietary tryptophan content in low protein diet(37.01%crude protein)for L.vannamei is 7.53 and 8.04 g/kg,respectively.[Chinese Journal of Animal Nutrition,2015,27(7):2272⁃2281]
Key words:Litopenaeus vannamei;low protein diet;tryptophan;growth performance;serum biochemical in⁃dices
作者简介:裘金木(1990—),男,浙江绍兴人,硕士研究生,研究方向为水产动物营养与饲料。E⁃mail:1058654514@qq.com
基金项目:广东省海洋渔业科技推广专项项目(A201301B11);广州市科技计划项目(2014J4100239);广东省农业科学院院长基金项目(201431)
收稿日期:2015-01-29
doi:10.3969/j.issn.1006⁃267x.2015.07.035
文章编号:1006⁃267X(2015)07⁃2272⁃10
文献标识码:A
中图分类号:S963

