不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响
王猛强 周飘苹 黄文文 周歧存(宁波大学海洋学院,宁波315211)
不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响
王猛强 周飘苹 黄文文 周歧存∗
(宁波大学海洋学院,宁波315211)
摘 要:本试验旨在研究不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能、血清指标、肝脏糖酵解和糖异生关键酶活性、糖原含量以及消化酶活性的影响。采用2×3双因素试验设计,其中蛋白质水平设42%、48%2个水平,葡萄糖添加水平设10%、20%、30%3个水平,共配制6种试验饲料。每种饲料设3个重复,每个重复放养平均体重为(14.89±0.11)g的大黄鱼幼鱼50尾。试验期为8周。结果表明:饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼的增重率(WGR)和特定生长率(SGR)有显著影响(P<0.05),在42%蛋白质水平下,WGR和SGR均随饲料葡萄糖添加水平的增加呈上升趋势;而在48%蛋白质水平下,葡萄糖添加水平为10%组的WGR和SGR要高于葡萄糖添加水平为30%组(P>0.05)。饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼肝脏葡萄糖激酶(GK)、6-磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、葡萄糖-6-磷酸酶(G6Pase)、果糖-1,6-二磷酸酶(FBPase)及磷酸烯醇式丙酮酸羧激酶(PEPCK)活性有显著影响(P<0.05)。在42%蛋白质水平下,饲料葡萄糖添加水平对肝脏GK、PFK、PK、G6Pase、FBPase及PEPCK活性有显著影响(P<0.05),且GK活性随饲料葡萄糖添加水平的升高呈显著上升(P<0.05),PEPCK活性随饲料葡萄糖添加水平的升高呈降低的趋势;在48%蛋白质水平下,饲料葡萄糖添加水平对肝脏GK、G6Pase及FBPase活性有显著影响(P<0.05),且GK活性随着饲料葡萄糖添加水平的升高呈上升的趋势。饲料蛋白质水平和葡萄糖添加水平的交互作用对肝糖原含量有显著影响(P<0.05),在42%或48%蛋白质水平下,肝糖原含量随饲料葡萄糖添加水平的升高呈上升的趋势。饲料蛋白质水平和葡萄糖添加水平的交互作用仅对大黄鱼少量血清指标[如血清总蛋白(TP)、葡萄糖含量及丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性]有显著影响(P<0.05),且对胃蛋白酶及肠道淀粉酶和脂肪酶活性无显著影响(P>0.05)。由此得出,当蛋白质水平为42%时,随着饲料葡萄糖添加水平的升高,大黄鱼能够通过调节糖酵解和糖异生关键酶活性及肝糖原含量来维持血糖含量的平衡,改善对葡萄糖的利用能力;而当蛋白质水平为48%时,随着饲料葡萄糖添加水平的升高,大黄鱼对葡萄糖的利用能力降低。
关键词:大黄鱼;蛋白质;葡萄糖;糖酵解关键酶;糖异生关键酶
碳水化合物是鱼类饲料中重要的廉价能源物质,适宜的饲料碳水化合物水平能够减少蛋白质供能、减轻氮排泄对养殖水体的污染[1],在斑点叉尾(Ictalurus punctatus)、露斯塔野鲮(Labeo roh⁃ita)、麦瑞加拉鲮(Cirrhinus mrigala)、欧洲鳗鲡(Anguilla anguilla)、罗非鱼(Oreochromis niloticus×O.aureus)等的研究中均表明饲料碳水化合物对蛋白质有一定的节约作用[2-6],但与哺乳动物相比,鱼类不能有效利用碳水化合物,海水鱼饵料中适宜的碳水化合物水平不宜超过20%,淡水鱼饵料中适宜的碳水化合物水平不宜超过40%[7],过高的碳水化合物水平会引起持续的高血糖、肝糖原积累、免疫功能降低、抑制鱼体生长[8-10],但鱼类对碳水化合物利用能力低下的机制仍不清楚。在鱼类糖代谢中,主要涉及糖酵解、糖异生、三羧酸循环、戊糖磷酸途径、糖原合成与降解过程,其中主要是糖酵解和糖异生过程,由激素和营养状况维持的血糖含量的平衡主要依赖于糖酵解和糖异生关键酶活性高低和表达量多少[11],而血糖含量的持续升高可能抑制摄食,从而抑制鱼体生长[12]。研究表明饲料中碳水化合物水平能够调节糖酵解和糖异生关键酶的活性及表达量[13-14],目前在大菱鲆(Scophthalmus maximus L.)、欧洲鲈鱼(Dicentrarchus labrax)、金头鲷(Sparus aurata)、鲈鱼(Lateolabrax japonicus)、欧洲鳗鲡、瓦氏黄颡鱼(Pelteobagrus fulvidraco)、鱼(Elopichthys bambusa)等鱼类中均有研究[15-21],研究这些酶活性及表达量的变化有助于了解鱼类碳水化合物代谢机制,从而解释鱼类对碳水化合物利用能力差的原因。
大黄鱼(Pseudosciaena crocea Richardson)隶属鲈形目(Perciformes)石首鱼科(Sciaenidae)黄鱼属(Pseudosciaena),为暖温性近海中下层集群洄游性鱼类,主要分布在我国黄海南部、东海、台湾海峡以及南海北部[22],因其肉质鲜美而深受人们喜爱,是我国传统“海洋四大经济鱼类”之一[23],目前对大黄鱼的蛋白质、脂肪及部分氨基酸需求量、部分饲料原料消化率、蛋白质替代、大黄鱼风味及其营养成分均有研究[22-28],但缺乏大黄鱼糖代谢相关研究。研究表明(12.8±0.08)g的大黄鱼的蛋白质需要量为48.3%[24],本试验设计2个蛋白质水平(42%、48%),并在不同蛋白质水平饲料中分别设3个葡萄糖添加水平(10%、20%、 30%),研究在蛋白质水平较低的情况下,饲料中葡萄糖添加水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响,从而为大黄鱼资源节约型配合饲料的研制提供基础数据。
1 材料与方法
1.1 试验设计与试验饲料配制
本试验采用2×3双因素试验设计,以饲料蛋白质水平和葡萄糖添加水平为影响因素,其中饲料蛋白质水平分别为42%、48%,葡萄糖添加水平分别为10%、20%、30%,共配制6种试验饲料,即42/10、42/20、42/30、48/10、48/20、48/30。以鱼粉、豆粕、小麦蛋白粉为蛋白质源,葡萄糖为糖源,鱼油、豆油、卵磷脂为脂肪源,按照试验设计,配制6种等脂饲料,试验饲料组成及营养水平见表1,按照表1配方将各种固态原料混合后过80目筛,维生素和矿物质预混料等微量组成采用逐级扩大法混合,再加入鱼油、豆油和卵磷脂以及水混合均匀,用双螺杆挤条机制成粒径为2和4 mm的硬颗粒饲料,在烘箱中90℃熟化30 min,自然风干,饲料密封后保存在-20℃冰箱中。
1.2 饲养管理
养殖试验于浙江省象山县西沪港港湾鱼排上进行,试验鱼苗由象山港湾水产苗种有限公司提供,正式试验前先将所有鱼苗于鱼排上暂养2周,暂养结束后,挑选体质健壮、规格一致、初重为(14.89±0.11)g的大黄鱼900尾,随机分为6组(每组3个重复,每个重复50尾鱼),随机分配于18个小规格网箱(1.5 m×1.5 m×2.0 m),试验期为8周。试验期间每天于05:00、17:00进行饱食投喂,试验期间海水温度为26.5~31.5℃,盐度为32~36 g/L,溶解氧浓度不低于7.0 mg/L。
1.3 样品采集
养殖试验结束后饥饿24 h,将鱼捞出,并用丁香酚(1∶10 000)麻醉,然后称重并记录每个网箱的大黄鱼尾数及总重,用于计算增重率(WGR)、特定生长率(SGR),每个网箱随机取3尾称重、量体长,取其肝脏并称重,用于计算肥满度(CF)、肝体比(HSI);另取8尾鱼,从尾部静脉抽取血样(血样不混合),注入1.5 mL离心管中,4℃冰箱静置过夜,3 000 r/min离心5 min,取上清液置于-80℃冰箱备用;将部分取过血的大黄鱼肝脏、胃、前肠剥离,放置于2 mL离心管中(取完立即放入液氮中),用于检测肝脏葡萄糖激酶(GK)、6-磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、葡萄糖-6-磷酸酶(G6Pase)、果糖-1,6-二磷酸酶(FBPase)、磷酸烯醇式丙酮酸羧激酶(PEPCK),胃蛋白酶,肠道淀粉酶和脂肪酶活性以及肝糖原含量;取背鳍肌肉,装于密封袋中,用于检测肌糖原含量。

表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air⁃dry basis) %
1.4 指标测定
饲料水分含量采用105℃常压干燥法测定,粗蛋白质含量采用微量凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用550℃马弗炉灼烧法测定,可消化碳水化合物含量采用3,5-二硝基水杨酸法测定。
血清生化指标及酶活活性使用日立7600⁃110型全自动生化分析仪进行检测,肝脏酶及肠道脂肪酶活性均采用上海源叶生物科技有限公司生产的酶联免疫吸附试验(ELISA)试剂盒进行检测,胃蛋白酶、肠道淀粉酶活性及肝糖原和肌糖原含量采用南京建成生物工程研究所生产的试剂盒进行检测。其中,肝脏、胃和肠道中酶活性的测定均是指单位组织中的酶活性。
1.5 计算公式
WGR(%)=100×(终末体重-初始体重)/初始体重;
SGR(%/d)=100×(ln终末均重-ln初始均重)/试验天数;
HSI(%)=100×肝脏重量/鱼体重量;CF(g/cm3)=100×体重/体长3。
1.6 数据处理及统计分析
试验数据采用SPSS 17.0统计软件进行分析,先以饲料蛋白质和葡萄糖添加水平为影响因素进行双因素方差分析(two⁃way ANOVA),然后对相同蛋白质水平的试验组采用Duncan氏法进行多重比较,最后对相同葡萄糖添加水平的试验组采用t检验(independent⁃samples t test)进行检测,以P<0.05表示处理间差异显著。试验数据采用平均值±标准差(mean±SD)表示。
2 结 果
2.1 不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能和形态学指标的影响
由表2可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼的WGR、SGR、CF有显著影响(P<0.05),但对HSI无显著影响(P> 0.05)。在饲料蛋白质水平相同时,饲料葡萄糖添加水平对大黄鱼WGR、SGR、HSI、CF无显著影响(P>0.05)。在饲料葡萄糖添加水平为20%时,饲料蛋白质水平为48%组WGR、SGR显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对大黄鱼CF、HSI无显著影响(P>0.05);在饲料葡萄糖添加水平为10%或30%时,饲料蛋白质水平对WGR、SGR、HSI、CF无显著影响(P>0.05)。
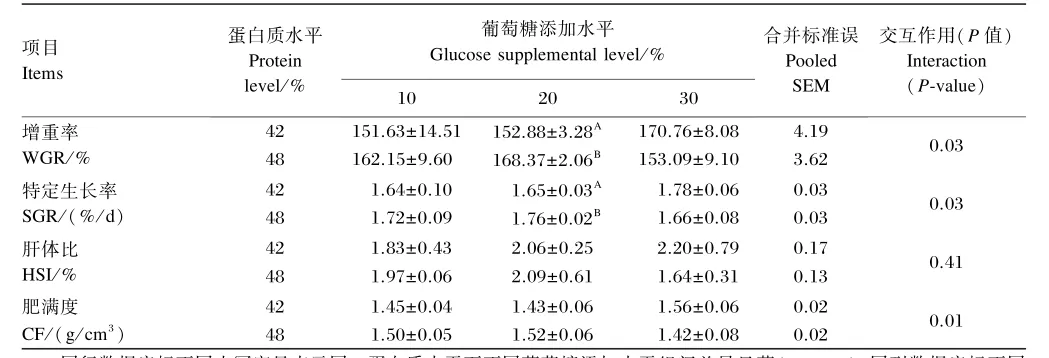
表2 不同蛋白质水平下葡萄糖添加水平对大黄鱼的生长性能和形态学指标的影响Table 2 Effects of glucose supplemental level at different protein levels on growth performance and morphological indices of large yellow croaker
2.2 不同蛋白质水平下葡萄糖添加水平对大黄鱼血清生化指标的影响
由表3可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼血清总蛋白(TP)、葡萄糖含量有显著影响(P<0.05),但对大黄鱼血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)含量无显著影响(P>0.05)。在饲料蛋白质水平为42%时,血清TG含量随饲料葡萄糖添加水平的升高而呈显著上升(P<0.05),血清HDL含量随饲料葡萄糖添加水平的升高呈下降的趋势且饲料葡萄糖添加水平为10%时显著高于饲料葡萄糖添加水平为30%时(P<0.05),但饲料葡萄糖添加水平对大黄鱼血清TP、TC、葡萄糖、LDL含量无显著影响(P>0.05);在饲料蛋白质水平为48%时,血清TP、HDL含量均随饲料葡萄糖添加水平的升高呈降低的趋势且饲料葡萄糖添加水平为10%时显著高于饲料葡萄糖添加水平为30%时(P<0.05),血清葡萄糖含量随饲料葡萄糖添加水平的升高呈上升的趋势且饲料葡萄糖添加水平为10%、20%时显著低于饲料葡萄糖添加水平为30%时(P<0.05),但饲料葡萄糖添加水平对大黄鱼血清TG、TC、LDL含量无显著影响(P>0.05)。在饲料葡萄糖添加水平为10%时,饲料蛋白质水平为48%组大黄鱼血清TP含量显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对血清TG、TC、LDL、HDL、葡萄糖含量无显著影响(P>0.05);在饲料葡萄糖添加水平为20%时,饲料蛋白质水平对大黄鱼血清TP、TG、TC、LDL、HDL、葡萄糖含量无显著影响(P>0.05);当饲料葡萄糖添加水平为30%时,饲料蛋白质水平为48%组大黄鱼血清葡萄糖含量显著高于且血清HDL含量显著低于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对血清TP、TG、TC、LDL含量无显著影响(P>0.05)。
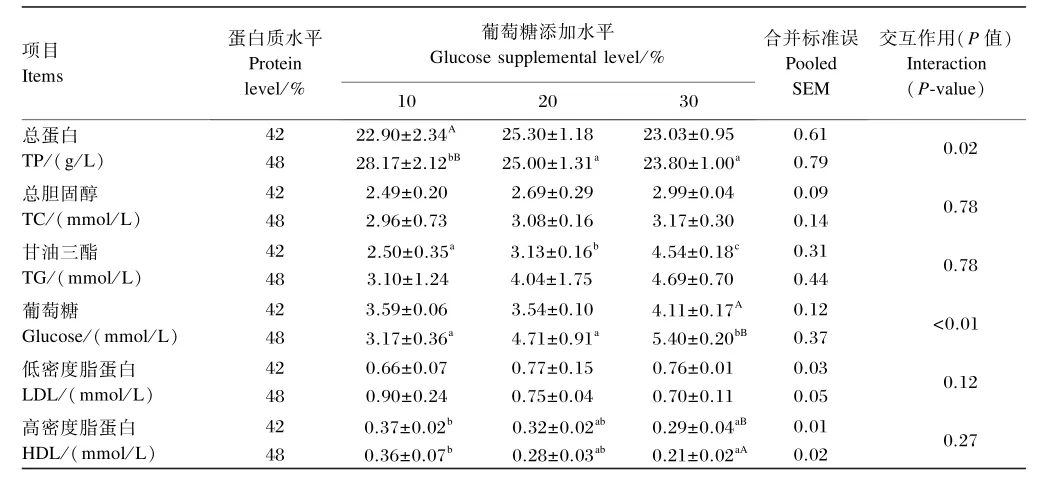
表3 不同蛋白质水平下葡萄糖添加水平对大黄鱼血清生化指标的影响Table 3 Effects of glucose supplemental level at different protein levels on serum biochemical indices of large yellow croaker
2.3 不同蛋白质水平下葡萄糖添加水平对大黄鱼血清酶活性的影响
由表4可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼血清ALT、AST活性有显著影响(P<0.05),但对大黄鱼血清AKP活性无显著影响(P>0.05)。在饲料蛋白质水平为42%时,血清ALT活性随饲料葡萄糖添加水平的升高呈上升的趋势且饲料葡萄糖添加水平为10%时显著低于饲料葡萄糖添加水平为30%时(P<0.05),血清AST活性随饲料葡萄糖添加水平的升高显著上升(P<0.05),但饲料葡萄糖添加水平对血清AKP活性无显著影响(P>0.05);在饲料蛋白质水平为48%时,血清AST活性随饲料葡萄糖添加水平的升高呈下降的趋势且饲料葡萄糖添加水平为30%时显著低于饲料葡萄糖添加水平为10%和20%时(P<0.05),但饲料葡萄糖添加水平对血清ALT和AKP活性无显著影响(P>0.05)。在饲料葡萄糖添加水平为10%时,饲料蛋白质水平为48%组大黄鱼血清AST活性显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对血清ALT和AKP活性无显著影响(P>0.05);在饲料葡萄糖添加水平为20%时,饲料蛋白质水平对血清AST、ALT和AKP活性均无显著影响(P>0.05);在饲料葡萄糖添加水平为30%时(P<0.05),饲料蛋白质水平为42%组大黄鱼血清AST 和ALT活性显著高于饲料蛋白质水平为48%组(P<0.05),但饲料蛋白质水平对血清AKP活性无显著影响(P>0.05)。
2.4 不同蛋白质水平下葡萄糖添加水平对大黄鱼肝脏糖酵解关键酶活性的影响
由表5可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼肝脏GK、PFK及PK活性有显著影响(P<0.05)。在饲料蛋白质水平为42%时,肝脏GK活性随饲料葡萄糖添加水平的升高显著上升(P<0.05),肝脏PFK和PK活性随饲料葡萄糖添加水平的升高呈先降低后上升的趋势;在饲料蛋白质水平为48%时,肝脏GK活性随着饲料葡萄糖添加水平的升高呈上升的趋势且饲料葡萄糖添加水平为10%时显著低于饲料葡萄糖添加水平为30%时,但饲料葡萄糖添加水平对肝脏PFK、PK活性无显著影响(P>0.05)。在饲料葡萄糖添加水平为10%时,饲料蛋白质水平为48%组大黄鱼肝脏GK活性显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对肝脏PFK和PK活性无显著影响(P>0.05);在饲料葡萄糖添加水平为20%或30%时,饲料蛋白质水平对肝脏GK、PFK及PK活性均无显著影响(P>0.05)。

表4 不同蛋白质水平下葡萄糖添加水平对大黄鱼血清酶活性的影响Table 4 Effects of glucose supplemental level at different protein levels on serum enzyme activities of large yellow croakerU/L
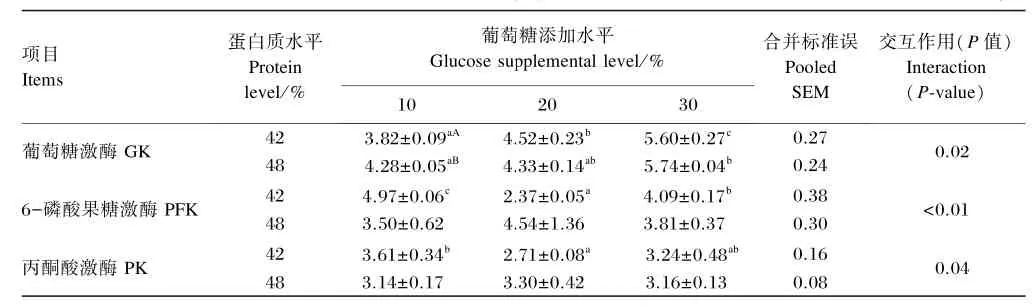
表5 不同蛋白质水平下葡萄糖添加水平对大黄鱼肝脏糖酵解关键酶活性的影响Table 5 Effects of glucose supplemental level at different protein levels on hepatic glycolysis key enzyme activities of large yellow croaker U/g
2.5 不同蛋白质水平下葡萄糖添加水平对大黄鱼肝脏糖异生关键酶活性的影响
由表6可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对肝脏G6Pase、FBPase及PEPCK活性有显著影响(P<0.05)。在饲料蛋白质水平为42%时,饲料葡萄糖添加水平对G6Pase、FBPase及PEPCK活性有显著影响(P<0.05),且肝脏G6Pase 和FBPase活性随饲料葡萄糖添加水平的升高呈先降低后上升的趋势,肝脏PEPCK活性随饲料葡萄糖添加水平的升高呈降低的趋势;在饲料蛋白质水平为48%时,饲料葡萄糖添加水平对肝脏G6Pase和FBPase活性有显著影响(P<0.05),且其活性随饲料葡萄糖添加水平的升高呈先升高后降低的趋势,但饲料葡萄糖添加水平对PEPCK活性无显著影响(P>0.05)。在饲料葡萄糖添加水平为10%时,饲料蛋白质水平为42%组肝脏G6Pase、FBPase及PEPCK活性均显著高于饲料蛋白质水平为48%组(P<0.05);在饲料葡萄糖添加水平为20%时,饲料蛋白质水平为48%组肝脏G6Pase和FBPase活性均显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对肝脏PEPCK活性无显著影响(P>0.05);在饲料葡萄糖添加水平为30%时,饲料蛋白质水平对肝脏G6Pase、FBPase及PEPCK活性均无显著影响(P>0.05)。
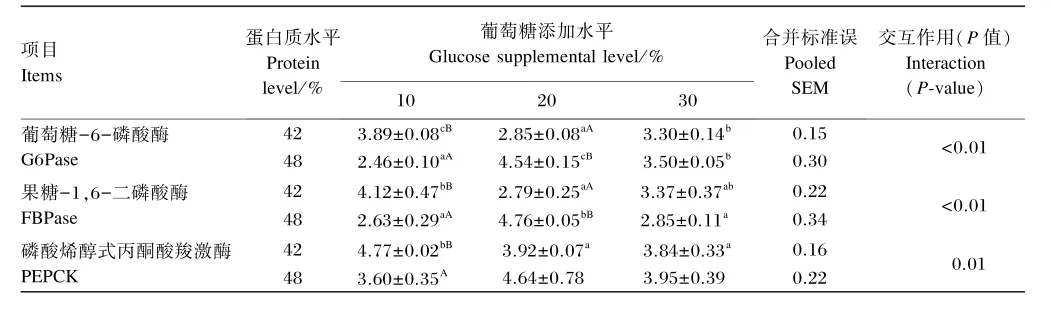
表6 不同蛋白质水平下葡萄糖添加水平对大黄鱼肝脏糖异生关键酶活性的影响Table 6 Effects of glucose supplemental level at different protein levels on hepatic gluconeogenic key enzyme activities of large yellow croaker U/g
2.6 不同蛋白质水平下葡萄糖添加水平对大黄鱼肝糖原和肌糖原含量的影响
由表7可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对肝糖原含量有显著影响(P<0.05),对肌糖原含量无显著影响(P>0.05)。在饲料蛋白质水平为42%或48%时,饲料葡萄糖添加水平对肝糖原含量有显著影响(P<0.05),且肝糖原含量随饲料葡萄糖添加水平的升高呈上升的趋势,但饲料葡萄糖添加水平对肌糖原含量无显著影响(P>0.05)。在饲料葡萄糖添加水平为10% 或20%时,饲料蛋白质水平对肝糖原和肌糖原含量均无显著影响(P>0.05);在饲料葡萄糖添加水平为30%时,饲料蛋白质水平为48%组肝糖原含量显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对肌糖原含量无显著影响(P>0.05)。

表7 不同蛋白质水平下葡萄糖添加水平对大黄鱼肝糖原和肌糖原含量的影响Table 7 Effects of glucose supplemental level at different protein levels on hepatic and muscle glycogen contents of large yellow croaker mg/g
2.7 不同蛋白质水平下葡萄糖添加水平对大黄鱼消化酶活性的影响
由表8可知,饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼胃蛋白酶及肠道脂肪酶和淀粉酶活性均无显著影响(P>0.05)。在饲料蛋白质水平为42%或48%时,饲料葡萄糖添加水平对大黄鱼胃蛋白酶及肠道脂肪酶和淀粉酶活性均无显著影响(P>0.05)。在饲料葡萄糖添加水平相同时,饲料蛋白质水平为48%组胃蛋白酶活性均显著高于饲料蛋白质水平为42%组(P<0.05),但饲料蛋白质水平对肠道淀粉酶和脂肪酶活性均无显著影响(P>0.05)。
3 讨 论
3.1 不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能及血清指标的影响
蛋白质和碳水化合物是鱼类重要的营养物质来源,饲料中蛋白质为鱼类提供氨基酸和氮源,用于合成机体蛋白质,对鱼类的生长发育具有重要作用,蛋白质占鱼体干物质质量的65%~75%[30]。碳水化合物对于鱼类的存活和生长并非必需的[31],但适宜的碳水化合物水平对鱼类的生长仍有促进作用[32-33]。本研究发现,饲料蛋白质水平和葡萄糖添加水平的交互作用对大黄鱼WGR和SGR有显著影响,在金头鲷的研究中也发现饲料蛋白质和碳水化合物水平对WGR和SGR有显著影响[34]。在本试验中,当饲料蛋白质水平为42%时,血清TG含量及AST、ALT活性随饲料葡萄糖添加水平的升高呈上升的趋势,其中当肝脏受到损伤或坏死时,会引起血液中AST和ALT活性升高[35-36],表明饲料葡萄糖添加水平的升高对肝功能有一定的负面影响,血清TC含量虽然没有显著差异,但也随着饲料葡萄糖添加水平的升高呈上升趋势,这可能是由于过多的碳水化合物转化为脂肪,进而引起血脂含量的升高,这与厚唇弱棘(Hephaestus fuliginosus)[37]、翘嘴红鲌(Erythroc⁃ulter ilishaeformis Bleeke)[38]的研究结果相似,并且高葡萄糖添加水平显著增加了肝糖原含量,这与在欧洲舌齿鲈(Dicentrarchuslabrax)[39]、虹鳟(Salmo gairdneri)[40]上的研究结果相似;但饲料葡萄糖添加水平的升高并未引起大黄鱼HSI和血清葡萄糖含量的变化,表明过高葡萄糖添加水平虽然引起大黄鱼肝糖原及血清部分物质含量的上升,但并未对大黄鱼的生长造成不利影响,并且改善了大黄鱼的WGR和SGR,这与在麦瑞加拉鲮[3]、露斯塔野鲮[4]上的研究结果相似。在饲料蛋白质水平为48%时,血清TP、HDL含量随饲料葡萄糖添加水平的升高呈下降趋势,其中肝功能障碍、营养不良或消耗增加等易造成血清TP含量降低,并且引起血清HDL含量的变化[41],表明添加30%的葡萄糖对大黄鱼肝功能有一定的负面影响,并且添加30%的葡萄糖显著增加了大黄鱼的血清葡萄糖含量和肝糖原含量;此外,虽然添加30%的葡萄糖并未显著增加大黄鱼HSI,但却对大黄鱼的生长造成了不利的影响。

表8 不同蛋白质水平下葡萄糖添加水平对大黄鱼消化酶活性的影响Table 8 Effects of glucose supplemental level at different protein levels on digestive enzyme activities of large yellow croaker
3.2 不同蛋白质水平下葡萄糖添加水平对大黄鱼糖酵解和糖异生关键酶活性的影响
糖酵解和糖异生在生理功能上分别是糖的分解与合成,其中糖酵解是所有生物体内葡萄糖代谢的唯一途径[42],糖异生是指将非糖物质转化成葡萄糖,主要在肝脏中进行[43],其中涉及的酶在鱼体内均存在[42,44],其关键酶有己糖激酶、GK、PFK、PK、G6Pase、FBPase、PEPCK。在本试验中,在饲料蛋白质水平为42%时,大黄鱼肝脏GK活性随着饲料葡萄糖添加水平的升高呈上升趋势,这与前人的研究结果[15,39,45-48]相似;肝脏PFK和PK活性随饲料葡萄糖添加水平的升高呈先降低后升高的趋势,表明当饲料葡萄糖添加水平过高时,大黄鱼糖酵解能力随之出现了适应性的增强;肝脏G6Pase和FBPase活性均随饲料葡萄糖添加水平的升高先下降后上升,在葡萄糖添加水平为20%和30%时的肝脏FBPase活性无显著差异,说明饲料葡萄糖添加水平对FBPase活性有一定抑制作用,这与在金头鲷[49]上的研究结果相似;肝脏PEPCK活性随饲料葡萄糖添加水平的升高而降低,在葡萄糖添加水平为20%与30%时无显著差异,表明饲料葡萄糖添加水平对大黄鱼肝脏PEP⁃CK活性抑制作用很强,这与在翘嘴红鲌[38,50]、大菱鲆[15]上的研究结果相似,表明大黄鱼在高葡萄糖添加水平下能够通过调节糖酵解和糖异生关键酶活性有效调节血糖含量,并且高葡萄糖添加水平还改善了大黄鱼的WGR和SGR。在饲料蛋白质水平为48%时,大黄鱼肝脏GK活性随着饲料葡萄糖添加水平的升高呈上升趋势,但饲料葡萄糖添加水平对肝脏PFK和PK活性均无显著影响,这与在南方鲇(Silurus meridionalis Chen)[51]、金头鲷[17]、塞内加尔鳎(Solea senegalensis,Kaup)[52]、虹鳟[19]上的研究结果相似,说明饲料葡萄糖添加水平的升高对肝脏PFK和PK活性无调节作用;肝脏G6Pase和FBPase活性均随饲料葡萄糖添加水平的升高先上升后下降,但高葡萄糖添加水平时的肝脏G6Pase活性显著高于低葡萄糖添加水平时,高葡萄糖添加水平时的FBPase活性与低葡萄糖添加水平时的无显著差异,表明高葡萄糖添加水平对大黄鱼肝脏G6Pase和FBPase活性无抑制作用;饲料葡萄糖添加水平对肝脏PEPCK活性无显著影响,表明大黄鱼在高葡萄糖水平不能有效调节糖酵解和糖异生关键酶活性,且高葡萄糖添加水平显著提高了血糖含量,进而降低了大黄鱼WGR和SGR。
4 结 论
与饲料蛋白质水平为48%时相比,在饲料蛋白质水平为42%时,大黄鱼能够通过调节肝脏糖酵解和糖异生关键酶活性及肝糖原含量来维持其血糖含量的平衡,从而使饲料中的葡萄糖得到有效利用。
参考文献:
[1] 罗毅平,谢小军.鱼类利用碳水化合物的研究进展[J].中国水产科学,2010,17(2):381-390.
[2] PAGE J W,ANDREWS J W.Interactions of dietary levels of protein and energy on channel catfish(Icta⁃lurus punctatus)[J].The Journal of Nutrition,1973,103(9):1339-1346.
[3] SINGH R K,BALANGE A K,GHUGHUSKAR M M.Protein sparing effect of carbohydrates in the diet of Cirrhinus mrigala(Hamilton,1822)fry[J].Aquacul⁃ture,2006,258(1):680-684.
[4] ERFANULLAH,JAFRI A K.Protein⁃sparing effect of dietary carbohydrate in diets for fingerling Labeo rohi⁃ta[J].Aquaculture,1995,136(3):331-339.
[5] DEGANI G,VIOLA S.The protein sparing effect of carbohydrates in the diet of eels(Anguilla anguilla)[J].Aquaculture,1987,64(4):283-291.
[6] SHIAU S Y,PENG C Y.Protein⁃sparing effect by car⁃bohydrates in diets for tilapia,Oreochromis niloticus× O.aureus[J].Aquaculture,1993,117(3/4):327-334.
[7] 蔡春芳,陈立侨.鱼类对糖的利用评述[J].水生生物学报,2006,30(5):608-613.
[8] MOON T W.Glucose intolerance in teleost fish:fact or fiction?[J].Comparative Biochemistry and Physi⁃ology Part B:Biochemistry and Molecular Biology,2001,129(2/3):243-249.
[9] 蔡春芳,陈立侨.鱼类对糖的代谢[J].水生生物学报,2008,32(4):592-597.
[10] KUMAR S,SAHU N P,PAL A K,et al.Effect of di⁃etary carbohydrate on haematology,respiratory burst activity and histological changes in L.rohita juveniles [J].Fish&Shellfish Immunology,2005,19(4):331-344.
[11] PILKIS S J,GRANNER D K.Molecular physiology of the regulation of hepatic gluconeogenesis and glycoly⁃sis[J].Annual Review of Physiology,1992,54(1):885-909.
[12] MELANSON K J,WESTERTERP⁃PLANTENGA M S,SARIS W H M,et al.Blood glucose patterns and appetite in time⁃blinded humans:carbohydrate versus fat[J].The American Journal of Physiology:Regulato⁃ry,Integrative and Comparative Physiology,1999,277 (2 Pt 2):R337-R345.
[13] ENES P,PANSERAT S,KAUSHIK S,et al.Nutrition⁃al regulation of hepatic glucose metabolism in fish [J].Fish Physiology and Biochemistry,2009,35(3):519-539.
[14] 王广宇,刘波,谢骏,等.鱼类糖代谢几种关键酶的研究进展[J].上海水产大学学报,2008,17(3):377-383.
[15] 聂琴,苗惠君,苗淑彦,等.不同糖源及糖水平对大菱鲆糖代谢酶活性的影响[J].水生生物学报,2013,37(3):425-433.
[16] ENES P,PANSERAT S,KAUSHIK S,et al.Effect of normal and waxy maize starch on growth,food utiliza⁃tion and hepatic glucose metabolism in European sea bass(Dicentrarchus labrax)juveniles[J].Compara⁃tive Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2006,143(1):89-96.
[17] ENES P,PANSERAT S,KAUSHIK S,et al.Growth performance and metabolic utilization of diets with n⁃ative and waxy maize starch by gilthead sea bream (Sparus aurata)juveniles[J].Aquaculture,2008,274 (1):101-108.
[18] 窦兵帅,梁萌青,郑珂珂,等.饲料中碳水化合物水平对鲈鱼生长、生理状态参数及体组成的影响[J].渔业科学进展,2014,35(1):46-54.
[19] SUÁREZ M D,SANZ A,BAZOCO J,et al.Metabolic effects of changes in the dietary protein:carbohydrate ratio in eel(Anguilla anguilla)and trout(Oncorhyn⁃chus mykiss)[J].Aquaculture International,2002,10 (2):143-156.
[20] 张世亮.饲料中糖结构、糖水平及糖脂比对瓦氏黄颡鱼幼鱼生长及糖代谢的影响[D].硕士学位论文.青岛:中国海洋大学,2011.
[21] 周华.饲料碳水化合物水平对鱤幼鱼生长、体成分及糖代谢酶活性的影响[D].硕士学位论文.武汉:华中农业大学,2011.
[22] 李会涛,麦康森,艾庆辉,等.大黄鱼对几种饲料蛋白原料消化率的研究[J].水生生物学报,2007,31 (3):370-376.
[23] 张帆.大黄鱼(Pseudosciaena crocea R.)脂类营养生理和饲料替代蛋白源的研究[D].硕士学位论文.青岛:中国海洋大学,2012.
[24] 林淑琴.不同生长阶段大黄鱼的蛋白质和蛋/能比营养研究[D].硕士学位论文.青岛:中国海洋大学,2013.
[25] 何志刚.大黄鱼(Pseudosciaena crocea R.)和鲈鱼(Lateolabrax japonicus)苏氨酸和苯丙氨酸营养生理研究[D].硕士学位论文.青岛:中国海洋大学,2008.
[26] 申屠基康.大黄鱼对21种饲料原料表观消化率及色氨酸营养需要研究[D].硕士学位论文.青岛:中国海洋大学,2010.
[27] 林利民,王秋荣,王志勇,等.不同家系大黄鱼肌肉营养成分的比较[J].中国水产科学,2006,13(2):286-291.
[28] 周飘苹,金敏,吴文俊,等.不同养殖模式,投喂不同饵料及不同品系大黄鱼营养成分比较[J].动物营养学报,2014,26(4):969-980.
[29] MAI K S,WAN J L,AI Q H,et al.Dietary methionine requirement of large yellow croaker,Pseudosciaena crocea R[J].Aquaculture,2006,253(1/2/3/4):564-572.
[30] WILSON R P.Amino acids and proteins[M]//HALVER J E,HARDY R W.Fish nutrition.3rd ed.New York:Academic Press,2002:143-179.
[31] NRC.Nutrient requirements of fish and shrimp[S].Washington,D.C.:National Academies Press,2011.
[32] 谭肖英,罗智,刘永坚.鱼类对饲料中糖的利用研究进展[J].中国饲料,2007(6):19-23.
[33] AL⁃ASGAH N A,ALI A.Feeding of various carbohy⁃ drate sources on the growth performance and nutrient utilization in Oreochromis niloticus[J].Agribiological Research,1994,47(1):1-12.
[34] FERNÁNDEZ F,MIQUEL A G,Córdoba M,et al.Effects of diets with distinct protein⁃to⁃carbohydrate ratios on nutrient digestibility,growth performance,body composition and liver intermediary enzyme ac⁃tivities in gilthead sea bream(Sparus aurata,L.)fin⁃gerlings[J].Journal of Experimental Marine Biology and Ecology,2007,343(1):1-10.
[35] ZHOU Q C,WANG Y L,WANG H L,et al.Dietary threonine requirements of juvenile Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture,2013,392/393/394/395:142-147.
[36] 周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163-165.
[37] 宋理平,韩勃,王爱英,等.碳水化合物水平对厚唇弱棘鯻生长和血液指标的影响[J].大连水产学院学报,2010,25(4):293-297.
[38] 戈贤平,刘波,谢骏,等.饲料中不同碳水化合物水平对翘嘴红鲌生长及血液指标和糖代谢酶的影响[J].南京农业大学学报,2007,30(3):88-93.
[39] MOREIRA I S,PERES H,COUTO A,et al.Tempera⁃ture and dietary carbohydrate levels effects on per⁃formance and metabolic utilisation of diets in Europe⁃an sea bass(Dicentrarchus labrax)juveniles[J].Aq⁃uaculture,2008,274(1):153-160.
[40] HILTON J W,ATKINSON J L.Response of rainbow trout(Salmo gairdneri)to increased levels of availa⁃ble carbohydrate in practical trout diets[J].British Journal of Nutrition,1982,47(3):597-607.
[41] MCCARTHY D H,STEVENSON J P,ROBERTS M S.Some blood parameters of the rainbow trout(Salmo gairdneri Richardson)[J].Journal of Fish Biology,1973,5(1):1-8.
[42] COWEY C B,WALTON M J.Intermediary metabo⁃lism[M]//HALVER E.Fish nutrition.New York:Ac⁃ademic Press,1989:259-329.
[43] COWEY C B,KNOX D,WALTON M J,et al.The regulation of gluconeogenesis by diet and insulin in rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1977,38(3):463-470.
[44] WALTON M J,COWEY C B.Aspects of intermediary metabolism in salmonid fish[J].Comparative Bio⁃chemistry and Physiology Part B:Comparative Bio⁃chemistry,1982,73(1):59-79.
[45] PANSERAT S,MÉDALE F,BLIN C,et al.Hepaticglucokinase is induced by dietary carbohydrates in rainbow trout,gilthead seabream,and common carp [J].American Journal of Physiology:Regulatory,Inte⁃grative and Comparative Physiology,2000,278(5):R1164-R1170.
[46] PANSERAT S,MÉDALE F,BRẼQUE J,et al.Lack of significant long⁃term effect of dietary carbohydrates on hepatic glueose⁃6⁃phosphatase expression in rain⁃bow trout(Oncorhynchus mykiss)[J].The Journal of Nutritional Biochemistry,2000,11(1):22-29.
[47] 蔡春芳.青鱼(Mylopharyngodon pieces)和鲫(Caras⁃sius auratus)对饲料糖的利用及其代谢机制的研究[D].博士学位论文.上海:华东师范大学,2004.
[48] 刘波,谢骏,苏永腾,等.高碳水化合物日粮对翘嘴红鲌生长、GK及GK mRNA表达的影响[J].水生生物学报,2008,32(1):47-53.
[49] PANSERAT S,PLAGNES⁃JUAN E,KAUSHIK S. Gluconeogenic enzyme gene expression is decreased by dietary carbohydrates in common carp(Cyprinus carpio)and gilthead seabream(Sparus aurata)[J].Biochimica et Biophysica Acta:Gene Structure and Expression,2002,1579(1):35-42.
[50] 俞菊华,戈贤平,唐永凯,等.碳水化合物、脂肪对翘嘴红鲌PEPCK基因表达的影响[J].水产学报,2007,31(3):369-373.
[51] 林小植,罗毅平,谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响[J].水生生物学报,2006,30(3):304-310.
[52] DIAS J,RUEDA⁃JASSO R,PANSERAT S,et al.Effect of dietary carbohydrate⁃tolipid ratios on growth,lipid deposition and metabolic hepatic en⁃zymes in juvenile Senegalese sole(Solea senegalen⁃sis,Kaup)[J].Aquaculture Research,2004,35(12):1122-1130.
Effects of Glucose Supplemental Level at Different Protein Levels on Growth Performance,Hepatic Glycolysis and Gluconeogenic Key Enzyme Activities of Large Yellow Croaker
(Larmichthys crocea Richardson)
WANG Mengqiang ZHOU Piaoping HUANG Wenwen ZHOU Qicun
∗
(责任编辑 菅景颖)
(School of Marine Sciences,Ningbo 315211,China)
∗Corresponding author,professor,E⁃mail:zhouqicun@nbu.edu.cn
Abstract:An 8⁃week feeding trial was conducted to evaluate the effects of glucose supplemental level at differ⁃ent protein levels on growth performance,serum indices,hepatic glycolysis and gluconeogenic key enzyme ac⁃tivities,glycogen content and digestive enzyme activities of large yellow croaker(Larmichthys crocea Richard⁃son).Six experimental diets were formulated to contain two protein levels(42%and 48%,respectively)and three glucose supplemental levels(10%,20%and 30%,respectively).Each diet was randomly assigned to 3 replicates,and each replicate had 50 juvenile large yellow croaker with the average body weight of(14.89± 0.11)g.The results showed that weight gain rate(WGR)and specific growth rate(SGR)were significantly affected by the interaction of dietary protein level and glucose supplemental level(P<0.05).When the dietary protein level was 42%,the WGR and SGR showed a increasing trend with the glucose supplemental level in⁃creasing;however,when the dietary protein was 48%,fish fed the diet supplemented with 10%glucose had higher WGR and SGR than fish fed the diet supplemented with 30%glucose(P>0.05).The interaction of di⁃etary protein level and glucose supplemental level had a significant effects on the ativities of glucokinase (GK),phosphofructokinase(PFK),pyruvate kinase(PK),glucose⁃6⁃phosphatase(G6Pase),fructose⁃1,6⁃bisphosphatase(FBPase),phosphoenolpyruvate(PEPCK)in liver(P<0.05).When the dietary protein level was 42%,the activities of GK,PFK,PK,G6Pase,FBPase and PEPCK in liver were significantly af⁃fected by dietary glucose supplemental level(P<0.05),and the GK activity was significantly increased with the glucose supplemental level increasing(P<0.05),while the PEPCK activity had a decreasing trend with the glucose supplemental level increasing.When the dietary protein level was 48%,the activities of GK,G6Pase and FBPase in liver were significantly affected by dietary glucose supplemental level(P<0.05),and the GK activity had a increasing trend with the glucose supplemental level increasing.The interaction of dietary protein level and glucose supplemental level had a significant effect on hepatic glycogen content(P<0.05),and the hepatic glycogen content had a increasing trend with the glucose supplemental level increasing when dietary protein level was 42%or 48%.The interaction of dietary protein level and glucose supplemental level only sig⁃nificantly affected a few serum indices(such as total protein and glucose contents,and alanine aminotrans⁃ferase and aspartate aminotransferase activities in serum)(P<0.05),and did not significantly affected pepsin,intestinal amylase and lipase activities(P>0.05).The results indicated that,when the dietary glucose level is 42%,large yellow croaker has the ability to maintain blood glucose content by adjusting the hepatic glycogen,glycolysis and gluconeogenic key enzymes activities with the glucose supplemental level increasing;while,when the dietary glucose level is 48%,the ability of glucose utilization is decreased with the glucose supple⁃mental level increasing.[Chinese Journal of Animal Nutrition,2015,27(8):2431⁃2442]
Key words:large yellow croaker;protein;glucose;glycolysis key enzymes;gluconeogenic key enzymes
通信作者:∗周歧存,教授,博士生导师,E⁃mail:zhouqicun@nbu.edu.cn
作者简介:王猛强(1991—),男,河南驻马店人,硕士研究生,从事水生动物营养与饲料研究。E⁃mail:625478657@qq.com
基金项目:国家自然科学基金项目(31272670);宁波市农业科技攻关重大项目(2012C10025);浙江省高校重中之重(一级)学科建设项目;宁波市农业攻关重大项目(2012C10025)
收稿日期:2015-03-16
doi:10.3969/j.issn.1006⁃267x.2015.08.015
文章编号:1006⁃267X(2015)08⁃2431⁃12
文献标识码:A
中图分类号:S963

