响应面法优化醇相体系制备高纯甘油磷脂酰肌醇的研究
张康逸 宋范范 张薇薇 何梦影 康志敏
响应面法优化醇相体系制备高纯甘油磷脂酰肌醇的研究
张康逸1宋范范1张薇薇2何梦影1康志敏1
(河南省农科院农副产品加工研究所1,郑州 450003)
(郑州轻工业学院食品与生物工程学院2,郑州 450002)
在醇相体系中研究了甲醇钠催化磷脂酰肌醇(Phosphtidylinositol,PI)制备甘油磷脂酰肌醇(Glycerylphosphoinositol,GPI)的效果。在单因素试验的基础上,采用响应面设计软件对反应条件进行了优化,得到最佳反应条件为:反应温度35℃,反应时间2.59 h,催化剂添加量3.50 mL,料液比1∶2.22(m/V),在此条件下,PI转化率和GPI得率分别为92.16%和84.31%。经过树脂柱色谱和硅胶柱色谱纯化后,GPI的纯度和回收率可达到98.71%和72.10%,为规模化制备GPI提供了数据支撑和技术支持。
大豆粉末磷脂 磷脂酰肌醇 甘油磷脂酰肌醇 甲醇钠
甘油磷脂酰肌醇(Glycerylphosphoinositol,GPI)普遍存在于真核生物中,GPI和有关的糖结合物可对宿主的先天和获得性免疫系统起到调节作用,对血栓、肝硬化及癫痫的发作等起到预防作用[1]。同时,GPI在人体内的生物合成与维持血液凝固和保证神经系统的正常息息相关[2-3]。因此,GPI的研究对于保健和医药等行业具有重要的价值[4-6]。目前,GPI合成方法的报道很少,而关于磷脂衍生物甘油磷脂酰胆碱(Glycerylphosphorylcholine,GPC)和甘油磷脂酰乙醇胺(glycerylphosphorylcholine,GPE)的研究较多,主要方法有化学水解法[7]、非水相酶法[8]、化学合成法[9]等。近年来,一些学者对化学水解制备GPC的方法研究较多。张甜甜等[10]以氢氧化四丁基铵为催化剂,甲醇为溶剂,催化制备GPC,产物收率可达89.20%。孟宗等[11]以甲醇钠为催化剂,对粉末磷脂进行醇解,同时制备含有GPC和GPE的混合物,在最佳条件下,GPC和GPE的得率分别为93.60%和88.69%。化学水解法常以大豆粉末磷脂为原料,要得到较高纯度的产品需对反应物进行后续分离和纯化,工艺步骤复杂。
本研究采用甲醇钠为催化剂,用粗PI作为催化底物,在醇相体系中对粗PI进行醇解制备GPI,并利用响应面软件对反应条件进行优化,确定最佳工艺条件。通过对化学醇解法制备GPI进行研究,不仅可为工业制备GPI提供数据支撑,也可为PI改性技术的进展提供新的研究方向。
1 材料及方法
1.1 材料及试剂
大豆粉末磷脂(纯度≥96%;磷脂酰胆碱30%、磷脂酰乙醇胺25%、磷脂酰肌醇25%、溶血磷脂酰乙醇胺0.5%):天津市博帅工贸有限公司;GPI标准样品:福州美乐莲有限公司;甲醇(色谱纯):美国Honeywell公司;无水乙醇(纯度≥99%)、氨水(NH3含量≥25%)、甲醇(纯度≥99%):国药集团化学试剂有限公司;强酸性阳离子交换树脂001×7(H型):安徽皖树化工销售有限公司;层析硅胶(100~200目):青岛海洋化工厂分厂。
1.2 仪器与设备
Agilent 1260型高效液相色谱仪:安捷伦科技有限公司;Bruker AVANCE AV-500核磁共振仪:瑞士Bruker公司;DF-101S型集热式恒温加热磁力搅拌器:河南予华仪器厂;TDL-5A离心机:上海菲恰尔分析仪器有限公司;玻璃层析柱:上海沪西分析仪器厂;HL-2恒流泵:上海华岩仪器设备有限公司;自动部分收集器:上海青浦沪西仪器厂。
1.3 试验方法
1.3.1 HPLC-ELSD方法
色谱柱:ZORBAXRX-SIL(4.6 mm ×250 mm,5μm),柱温35℃,进样量20μL,漂移管温度30℃;流动相∶溶剂A(甲醇∶水=8∶1,V∶V),溶剂B(甲醇),流量1.0 mL/min;梯度洗脱程序:0 ~10.0 min,60%~40%A;10.0 ~20.0 min,40%A;20.0 ~20.1 min,40%~60%A;20.1 ~25.0 min,60%A。
1.3.213C NMR方法
将纯化后的样品溶于氘代氯仿中,以四甲基硅烷(TMS)做内标,核磁共振仪测定它的碳谱(13C NMR)。13C NMR 化学位移分析如下:13C NMR(100 MHz,CDCl3),δC =73.378(C -2)、68.211(C -1)、64.695(C -2′)、62.065(C -3)、56.568(C -1″,2″,3″)和42.753(C -1′)。样品分析结果与GPI标样的13C NMR一致。
1.3.3 粗PI的制备方法
称取一定量粉末磷脂,加入到40℃,10倍体积的碱性乙醇(无水乙醇∶氨水=100∶3,V∶V)中,搅拌1 h,离心分离上清液,将沉淀与碱性乙醇再混合,重复操作2次。将不溶物在60℃下真空干燥。
1.3.4 单因素试验
称取25.0 g粗PI溶于100 mL甲醇,在室温水浴中均质,加入2.5 mL甲醇钠,反应3 h,取反应液,将反应液用甲醇稀释并过滤后进行检测。固定其他条件,分别考察反应时间、反应温度、料液比、催化剂添加量对反应效果的影响,重复3次。
1.3.5 响应面试验
采用Design Expert 8.0软件进行响应面设计,根据Box-Behnhen的中心组合设计原理,以反应温度、反应时间、催化剂添加量及料液比4个因素为自变量,以GPI得率为考察指标(Y)来进行响应面优化。反应温度、反应时间、催化剂添加量及料液比4个自变量分别以A、B、C、D表示,因素及水平见表1。

表1 响应面试验因素水平表
1.3.6 树脂柱色谱去除Na+
采用湿法装柱,先将树脂浸入水中,然后将树脂装进层析柱中,除去树脂中的Na+。阳离子交换树脂的预处理:先用2倍树脂体积的4%HCl溶液浸泡3 h,用去离子水洗至中性;再用相同体积的4%NaOH溶液浸泡4 h,用去离子水洗至中性;最后用相同体积的4%HCl溶液浸泡3 h,用去离子水洗至中性。
1.3.7 硅胶柱色谱纯化
称15 g硅胶,在120℃烘箱中活化30 min,干燥器中冷却后用湿法装柱。柱色谱条件:甲醇为洗脱剂,上样量20 mg/g硅胶,上样浓度30 mg/mL时,流速2 mL/min。每30 mL洗脱馏分进行收集,用HPLCELSD进行检测,直到没有GPI的响应值为止,将同类型的馏分进行合并。
2 结果与分析
2.1 原料粉末磷脂和粗PI的HPLC-ELSD色谱图
由于PE在碱性乙醇中的溶解度高于乙醇,故利用碱性乙醇萃取的方法可有效降低粉末磷脂中的PC和PE,从而得到较高纯度的粗PI[12]。由图1看出,原料粉末磷脂中PI的含量为25%(图1a),经过碱性乙醇萃取后,粗PI含量可达到62%(图1b)。
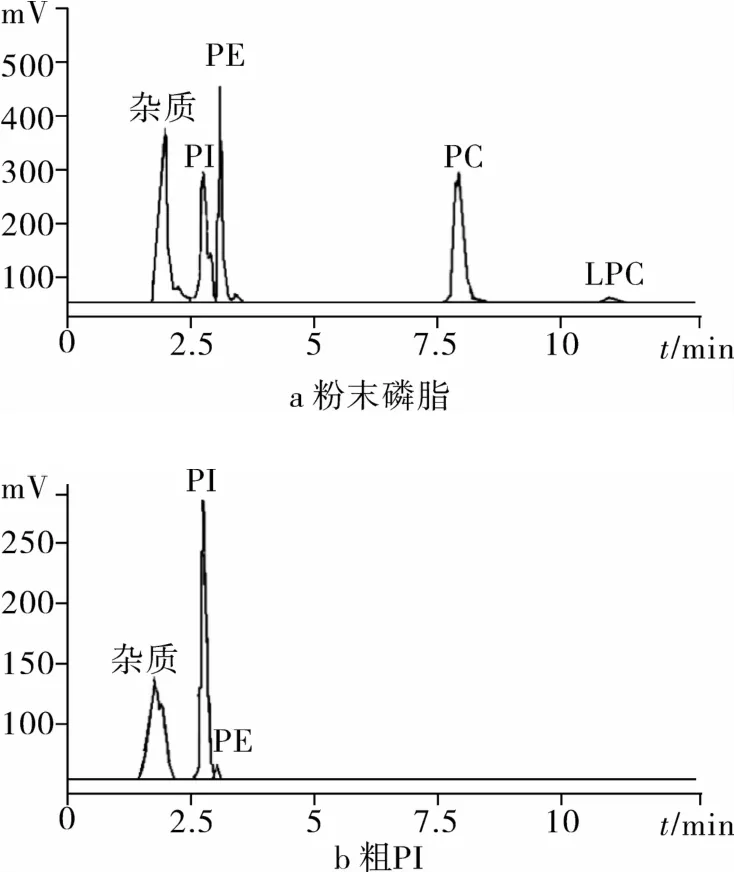
图1 原料和粗PI的色谱图
2.2 单因素试验
2.2.1 反应时间对醇解反应的影响

图2 时间对GPI转化率和得率的影响
由图2可以看出,随着时间的延长,PI的转化率和GPI的得率逐渐提高,当反应时间超过5 h后,二者增加并不明显,而GPI的得率略微下降,这可能是过度反应导致GPI开始分解造成的。故最佳反应时间选择5 h,在该条件下,PI的转化率和GPI的得率分别为90.53%和83.12%。
2.2.2 反应温度对醇解反应的影响
由图3可以看出,反应温度的变化对醇解反应的影响是比较大的。温度不仅可以影响催化效率,而且还会影响反应体系的黏度和底物的溶解度。温度过低,不利于反应体系的传质与扩散,温度升高会造成甲醇挥发,降低反应效率。当反应温度超过35℃时,PI转化率和GPI得率开始明显下降,这一结果与甲醇的挥发有直接关系,因为甲醇的减少会导致反应体系变得黏稠,不利于催化剂和反应原料之间的接触。故选择35℃为最佳反应温度,在该温度下,PI的转化率和GPI的得率分别为82.08%和73.06%。

图3 温度对GPI转化率和得率的影响
2.2.3 料液比对醇解反应的影响
一般来说,料液比对催化效果的影响非常重要,当溶剂量较小时,反应原料和催化剂不能得到充分混匀,且体系有可能结块使催化效果下降,当溶剂量过大时,不但会造成资源浪费,还会使反应原料和催化剂得到稀释。故一个合理的料液比对工业化生产具有重要的意义。
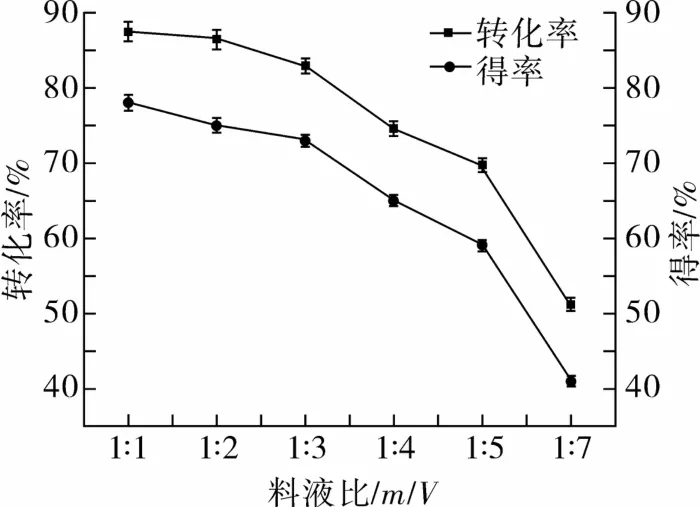
图4 料液比对GPI转化率和得率的影响
由图4看出,随着料液比的增加,PI转化率和GPI得率出现下降趋势,这是因为甲醇量得逐渐增大会对反应原料和催化剂起到稀释作用,使原料和催化剂浓度下降,最终导致反应效率降低。然而,当料液比大于1∶1(m/V)时,体系变得非常黏稠,粗PI结成团状,不能充分扩散到体系中,导致转化率和得率较低。综合考虑,选择最佳料液比为1∶1。
2.2.4 催化剂添加量对醇解反应的影响
甲醇钠因其催化效率高、引发反应温度低及成本低的原因已广泛应用于脂质改性中[13]。由于甲醇钠极易发生水解,故反应体系要严格控制成为无水环境。由图5看出,随着甲醇钠添加量得增加,PI转化率和GPI得率随之增加,当甲醇钠添加量超过2.5 mL时,PI转化率和GPI得率不再增加反而开始下降。可能是过多的甲醇钠促使反应生成的GPI继续分解,造成GPI得率降低。综合考虑,选择甲醇钠添加量为2.5 mL。

图5 催化剂添加量对GPI转化率和得率的影响
2.3 响应面设计及结果分析
2.3.1 响应面设计及结果
响应面试验设计及结果见表2。
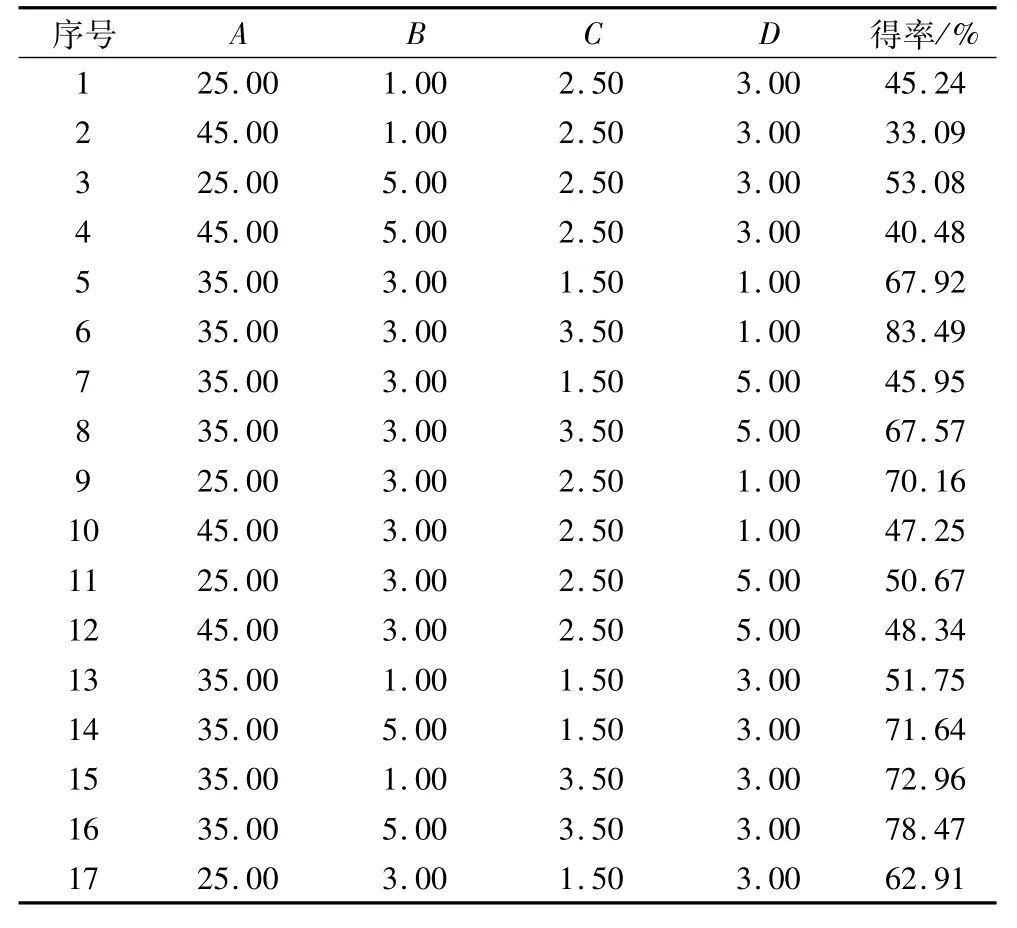
表2 响应面试验设计及结果
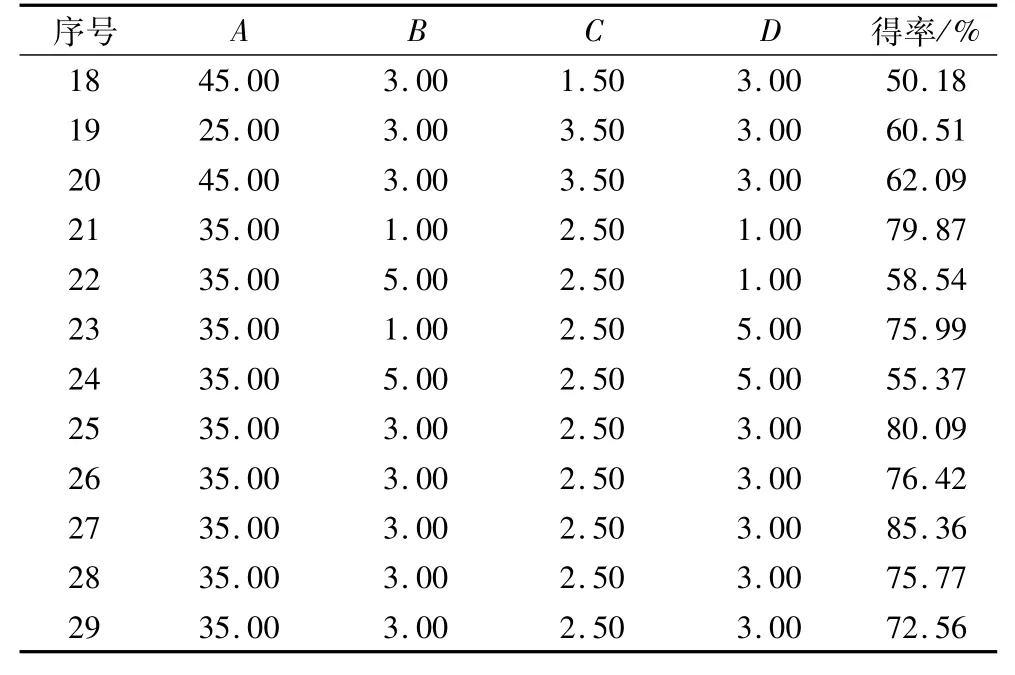
表2 (续)
2.3.2 数学模拟及方差分析
响应面试验数据采用Design Expert 8.0软件进行分析,建立二次多项式回归方程。回归方程如式(1)所示。
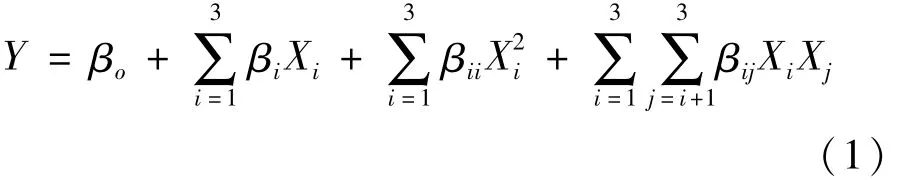
式中:Y 为响应值,Xi和Xj为自变量,βo、βi、βii及βij分别为截距、一次项、二次项及交互项回归项系数。良好的拟合模型应具有较高的判定系数R2,较低的绝对平均偏差和良好的方差分析结果。
对表2中响应面试验结果的相关数据进行多元回归拟合,得到GPI得率对自变量A、B、C、D的二次多项回归方程如式(2)所示。

F值是用来判定回归方程中各变量对响应值影响的显著性,其值越小说明该模型越显著。从表3可知,P<0.05,由此可知此模型显著,失拟项不显著。这说明使用此回归方程拟合的4个因素与GPI得率之间的关系是可行的,并能够对醇解反应制备GPI的实际情况进行预测。各个因素之间的交互作用响应面图如图6所示。由图6a可以看出,在反应温度33.00~37.00℃和时间2.50~3.50 h时,PI的纯度较高。当温度一定时,随着反应时间的延长,PI纯度出现先增加后降低的趋势,这主要与反应溶剂甲醇的沸点有关系,反应时间越长,甲醇挥发的越多,体系黏稠,不利于反应的进行。由图6b看出,温度与催化剂之间的交互作用影响较大。在反应温度30.00~35.00℃和催化剂添加量2.70~3.50 mL时,PI的纯度较高。由图6c看出,温度和料液比之间的交互作用影响也较大,在温度30.00~35.00℃和料液比1.00~2.00时,PI纯度较高。由图6d看出,在时间2.50~3.50 h和料液比1.00~2.00时,PI纯度较高。当反应时间一定时,随着料液比的增加,PI纯度逐渐降低,因为体系中过高的溶剂对体系中催化剂和原料起到稀释作用而不利于反应。数据分析表明:此回归方程中一次项C、二次项A2、B2对EF转化率也有显著的影响。4个因素对GPI得率影响大小的顺序:催化剂添加量>料液比>反应温度>反应时间。
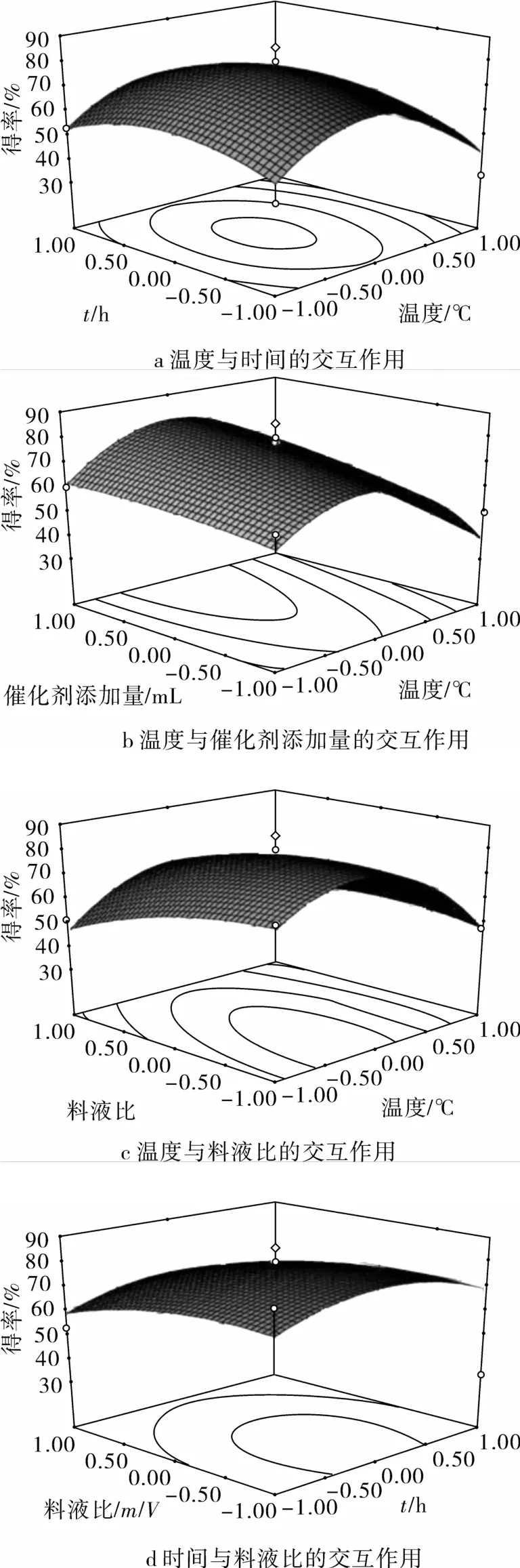
图6 部分交互作用的响应面图
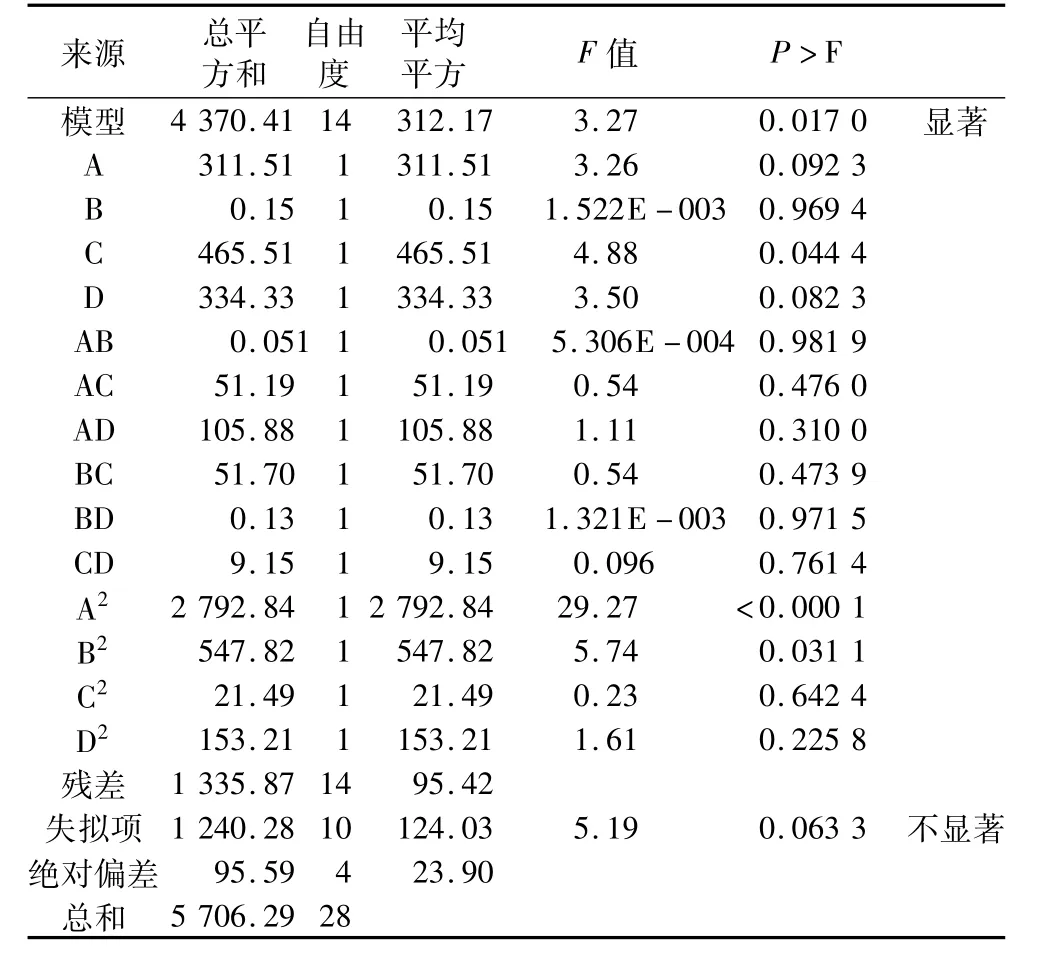
表3 方差分析表
2.3.3 条件优化及模型验证
根据响应面优化的解决方案中选取的最优反应条件为:反应温度35℃,反应时间2.59 h,催化剂添加量3.50 mL,料液比1∶2.22(m/V)。在此工艺条件下得到的验证试验的GPI得率为(84.31±1.1)%(预测值为83.56%),这说明试验结果与模型预测结果具有良好的相关性,因此,该模型可以较成功的预测醇解反应制备GPI的过程。
2.4 柱色谱纯化和13C NMR定性分析
由于反应结束后,溶液中存在一定量的Na+,会影响产品的质量和稳定性,因此有必要用阳离子交换树脂对Na+进行去除。Tronconi等[14]采用离子交换树脂法在粗磷脂的水解产物中成功分离出GPC,所分离的产品纯度较高,并可同时分离出副产品。在前期研究的基础上[15],当Na+初始浓度为876 μg/mL,吸附流速1 mL/min,处理反应液能力28.08 mL/g的条件下,经过处理的洗脱液中的Na+残留为8.2 ppm。为了得到更高纯度的GPI,需通过硅胶柱色谱对浓缩后的样品进行进一步分离纯化,参考之前GPC的分离方法[16],当洗脱流速1.5 mL/min,上样量和上样初始浓度为20 mg/g硅胶和10 mg/mL的条件下,GPI的纯度和回收率可达到98.71%和72.10%。经过柱色谱纯化后的GPI的HPLC-ELSD色谱图和13C NMR如图7和图8所示。样品的13C NMR分析结果与GPI标样的一致。
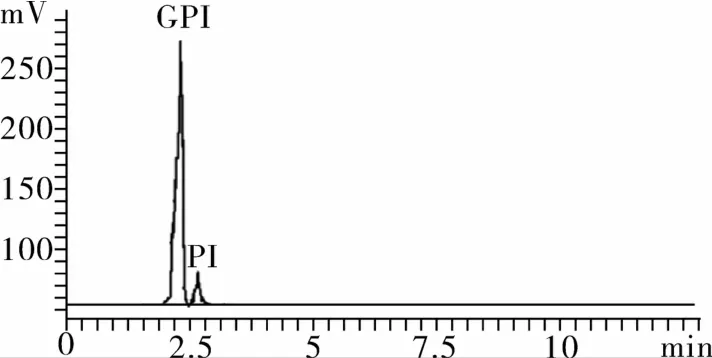
图7 纯化后GPI的HPLC-ELSD图
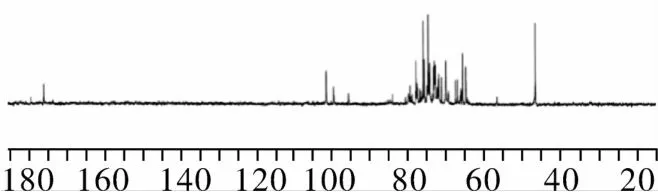
图8 纯化后GPI的核磁碳谱图
3 结论
在醇相体系中研究了甲醇钠催化制备GPI的研究,通过单因素试验及响应面设计,得出醇相体系中合成GPI的最佳反应条件为:反应温度35℃,反应时间2.59 h,催化剂添加量3.50 mL,料液比1∶2.22(m/V),在此最佳工艺条件下,得到PI转化率和GPI得率分别为92.16%和84.31%。经过树脂柱色谱和硅胶柱色谱纯化后,GPI的纯度和回收率可达到98.71%和72.10%。结果表明,甲醇钠醇解制备GPI的方法是可行的,该方法成本较低,操作简单,可为GPI的工业化制备提供技术参考。
[1]曹栋,裘爱泳,王兴国.磷脂及磷脂酰胆碱生物学功能[J].粮食与油脂,2002(11):23-24
Cao D,Qiu A Y,Wang X G.Biological function of phospholipids and phosphatidylcholine[J].Cereals & Oils,2002(11):23-24
[2]Almeida A M,Murakami Y,Layton D M,et al.Hypomorphic promoter mutation in PIGM causes inherited glycosylphosphatidylinositol deficiency [J].Nature Medicine,2006,12(7):846 -851
[3]Orlean P,Menon A K.Thematic review series:lipid posttranslational modifications.GPI anchoring of protein in yeast and mammalian cells,or:how we learned to stop worrying and love glycophospholipids [J].Journal of Lipid Research,2007,48(5):993 -1011
[4]Corda D,Toso R,Bonvento G,et al.Glycerophosphoinositol derivatives as modulators of cytosolic A2phospholipase:US,7625883B1[P].2009-12-01
[5]Holub B J.The nutritional significance,metabolism,and function of myo-inositol and phosphatidylinositol in health and disease [M]. Advances in Nutritional Research.Springer US,1982:107-141
[6]Diringer H,Koch-Kallnbach M E,Friis R R.Quantitative determination of myoinositol,inositol 1 - phosphate,inositol cyclic 1:2-phosphate and glycerylphosphoinositol in normal and rous-sarcoma-virus-transformed quail fibroblasts under different growth conditions [J].European Journal of Biochemistry,1977,81(3):551 -555
[7]陈新,梅以成,梁鹏.一种合成甘油磷脂酰胆碱的方法:中国,CN101544667A[P].2009-09-30
Chen X,Mei Y C,Liang P.A synthetic method of glycerophosphocholine:China,CN101544667A[P].2009-09-30
[8]钱峰,裘爱泳.非水介质中磷脂酶A1催化水解磷脂酰胆碱的研究[J]. 中国油脂,2007,32(11):55-58
Qian F,Qiu A Y.Hydrolysis of phosphatidylcholine by phospholiphase A1in non - aqueous media[J].China Oils and Fats,2007,32(11):55 -58
[9]Brockerhoff H,Yurkows M.Simplified preparation of L-alpha-glycerylphosphorylcholine [J].Canadian Journal of Biochemistry and Physiology,1965,43(10):1777 -1783
[10]张甜甜,张小里,李红亚,等.大豆磷脂制备甘油磷脂酰胆碱均相催化反应研究[J].应用化工,2012,41(4):599-601
Zhang T T,Zhang X L,Li H Y,et al.Homogeneous catalytic reaction for preparation of L-α-glycerophosphocholine from soybean phosphatidylcholine[J].Applied Chemical Industry,2012,41(4):599 -601
[11]孟宗,周丽,李进伟,等.大豆粉末磷脂同时制备甘油磷脂酰胆碱和甘油磷脂酰乙醇钠的研究[J].油脂化学,2013,38(9):32-35
Meng Z,Zhou L,Li J W,et al.Simultaneous preparation of glyceryphosphorycholine and glyceryphosphoryethanolamine from powded soybean phospholipid[J].China Oils and Fats,2013,38(9):32 -35
[12]刘代成,安立国,陶务端,等.高纯度磷脂酰肌醇的制备方法:中国,CN 1560057A[P].2005-01-05.
Liu D C,An L G,Tao W D,et al.Preparation method of high purification phosphtidylinositol:China,CN 1560057A[P].2005-01-05
[13]崔惠玲,宋慧波,张玉军.碱催化大豆油和三乙酸甘油酯酯交换研究[J].中国粮油学报,2013,28(12):63-67
Cui H L,Song H B,Zhang Y J.Low calorie oil production through transesteriftcation using sodium methoxide[J].Journal of the Chinese Cereals and Oils Association,2013,28(12):63 -67
[14]Tronconi Giovanni.Process for Separation the Main Components of A Mixture of Raw Deacylated Phospholipids:Word Intellectual Property Organization Patent,WO9115494(A1)[P],1991-10-17
[15]周丽.甘油磷脂酰胆碱和甘油磷脂酰乙醇胺的制备与纯化[D].无锡:江南大学,2012
Zhou L.Preparation and purification of L-Alpha glycerylphosphorylcholine and L-Alpha glyceryphosphoryethanolamine[D].Wuxi:Jiangnan University,2012
[16]张康逸.水相体系酶法制备甘油磷脂酰胆碱及酰基转移机理研究[D].无锡:江南大学,2012
Zhang K Y.Enzymatic preparation of glycerylphosphorylcholine in aqueous medium and acyl migration mechanism[D].Wuxi:Jiangnan University,2012.
Optimization for Preparation of High Purity Glycerylphosphoinositolin Alcohol Phase System by Response Surface Methodology
Zhang Kangyi1Song Fanfan1Zhang Weiwei2He Mengying1Kang Zhimin1
(Institute of Agricultural Products Processing,Henan Academy of Agricultural Sciences1,Zhengzhou 450003)
(School of Food and Bioengineering,Zhengzhou University of Light Industry2,Zhengzhou 450002)
The effect of preparation of glycerylphosphoinositol(GPI)by phosphtidylinositol (PI)catalyzed by sodium methoxide in methanol phase is investigated.The optimum conditions are obtained by response surface methodology based on single factor experiment as follows:reaction temperature 35℃,reaction time 2.59 h,dosage of catalyst 3.50 mL,solid -liquid ratio 1∶2.22.Under the above condition,the conversion rate of PI and the yield of GPI are 92.16%and 84.31%respectively.After the purification of resin and gel column chromatography,the final product GPI is obtained at 98.71%purity and 72.10%recovery.These results provide fundamental data and theoretical support for the further industrialization of GPI.
soybean lecithin powder,phosphtidylinositol,glycerylphosphoinositol,sodium methoxide
TS229
A
1003-0174(2016)07-0064-06
国家自然科学基金(31301502)
2014-11-12
张康逸,男,1981年出生,博士,脂质科学
宋范范,女,1988年出生,硕士,脂质科学

