膜分离与大孔树脂联用技术纯化茶皂素
程文娟 谢海荣 秦 永 刘 蓉 邓泽元
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
茶皂素是一类以齐墩果烷型五环三萜为母核、旁支带有不同糖苷和官能团的皂苷化合物的总称。它不仅具有抑菌、抗炎、止痛、降低血脂胆固醇等生物活性[1,2],还有乳化、分散、润湿、发泡、稳泡等性能,是一种优良的天然表面活性剂[3],被广泛应用于建材、化工、生物医药及食品等行业,应用前景十分广阔。
由于茶皂素种类繁多,结构复杂且相似,同分异构体多,分离出单一结构的茶皂素纯品异常困难,导致目前中国市场上所销售的茶皂素产品的纯度普遍不高,使其在医药及化妆品等精细化工行业的应用受到一定的限制。因此,高纯度茶皂素的高效分离纯化技术是油茶产业化过程中亟待解决的问题[4]。常见茶皂素的分离纯化方法主要有正丁醇萃取法[5]、沉淀絮凝法[6]、盐析法[7]、硅胶 柱层 析法[8]、大孔树脂纯化法[9]、膜分离法[10]等。但是这些方法都存在一些不足:采用正丁醇萃取法得到的茶皂素杂质较多[11];沉淀絮凝法和盐析法消耗试剂多,对环境造成污染;硅胶柱层析法对茶皂素易造成死吸附,产量低,不适用于工业生产等[12]。而膜分离法具有物质不发生相变、分离效果好、耗能低、工艺简单、操作简便、清洁无污染等优点;树脂纯化法具有稳定性高、选择性好、条件温和、低耗能、易于自动化、有利于环境保护等优点[13]。虽然已有单独使用膜分离法、大孔树脂纯化法分离纯化茶皂素的报道,但单独使用膜分离法得到的产品纯度不高,而单独使用大孔树脂法,存在耗时长等缺点。
本研究拟以茶粕中提取得到的粗茶皂素为原料,依次通过陶瓷膜和纳滤膜进行初步分离,然后经大孔树脂进一步纯化,优化其工艺参数,以期得到纯度较高的茶皂素,为实现茶皂素的工业化生产以及合理开发利用提供技术参考和科学依据。
1 材料与方法
1.1 材料与试剂
茶粕:江西省高正生物科技集团有限公司;
茶皂素标品:阿拉丁试剂公司;
石油醚、乙醇、浓硫酸、香草醛:分析纯,天津市大茂化学试剂厂;
大孔 树 脂:D101、NKA-2、AB-8、HPD450、HPD600、DM130、HPD-722、ADS-F8型,沧州宝恩吸附材料科技有限公司;
大孔树脂:Amberlite XAD7HP型,上海安澜德生物科技有限公司;
大孔树脂:HP20型,日本三菱树脂株式会社。
1.2 仪器与设备
可见分光光度计:722型,上海精密科学仪器有限公司;
膜分离纯化仪器:实验室型,上海朗极膜分离设备工程有限公司;
电热恒温水浴锅:HH-SII型,孔义市英峪华仪器厂;
多功能溢流循环超声波萃取机:SJC-I-2L型,无锡市上佳生物科技有限公司;
电子天平:AR323CN型,奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 茶皂素标准曲线的确定 采用香草醛-浓硫酸法[14]。称取0.0500g茶皂素标准品,用80%(V/V)乙醇水溶液将其溶于50mL容量瓶中,定容,摇匀,得到浓度为1mg/mL的茶皂素溶液。分别取0.0,0.3,0.6,0.9,1.2,1.5mL于25mL具塞磨口试管中,超纯水定容至2.5mL。再分别加入2.5mL 8%的香草醛乙醇溶液,移至冰水浴中,分别加入77%的硫酸水溶液(V/V)定容至25mL,摇匀,移入60℃恒温水浴锅中加热40min,进行显色反应。取出置于冰水浴中冷却15min后,室温放置10min。于550nm波长测定各反应液的吸光度值。
1.3.2 茶皂素的提取制备 将茶粕粉碎,过40目筛,用4倍石油醚加热回流脱脂2h[15],脱溶干燥。称取一定量的脱脂茶粕,配制70%的乙醇溶液,按一定的料液比,用微波辅助超声波法[16]提取得到茶皂素粗品。
1.3.3 试验计算公式 膜分离试验中,膜分离茶皂素的效果通过膜通量、茶皂素透过率和截留率来表示,分别按式(1)~(3)计算:

式中:
J——膜通量,L/(m2·h);
V——取样体积,L;
S——膜有效面积,m2;
t——取样时间,h;
Ts——茶皂素透过率,%;
m1——膜滤液总皂苷含量,g;
m0——原料中总皂苷含量,g。
Ti——茶皂素截留率,%。
大孔树脂的吸附和解吸效果通过吸附率和解吸率来表示,分别按式(4)~(7)计算:

式中:
Q——比吸附量,mg/g;
θ——吸附率,%;
P——比解吸量,mg/g;
γ——解吸率,%;
C0、C1——吸附前后样品液中茶皂素的浓度,mg/mL;
C2——解吸附液中茶皂素的浓度,mg/mL;
V0——样品体积,mL;
V1——解吸附液体积,mL;
M——树脂浓度,g;
a——树脂含水量,%。
1.3.4 膜分离纯化茶皂素
(1)茶皂素浓度的选择:称取一定量茶皂素粗品溶于一定体积的70%乙醇水溶液中,配制成质量分数分别为1%,2%,3%,4%的茶皂素溶液,选取陶瓷膜采用全回流循环方式进行试验,收集透过液,分别测定陶瓷膜膜通量、茶皂素透过率,以考察不同茶皂素浓度对膜分离效果的影响[17]。
(2)膜元件的选择:称取一定量茶皂素粗品溶于一定体积的70%乙醇水溶液中,配制成1%的茶皂素溶液,选取陶瓷膜、微滤膜(10.0,5.0,3.5kDa)、纳滤膜(360Da)进行试验,收集透过液,分别测定茶皂素透过率[18]。
1.3.5 大孔树脂的选择 所选择的10种大孔树脂的物理性质:XAD7HP、HPD600、NKA-2、ADS-F8为极性大孔树脂;DM130、HPD450为中极性大孔树脂;HPD-722、AB-8为弱极性大孔树脂;HP20、D101为非极性大孔树脂。其平均孔径以XAD7HP大孔树脂最大,为45,ADS-F8为无孔树脂,其他为80~100。比表面以 NKA-2为最大,达到1 200m2/g,其于大孔树脂比表面为350~600m2/g。
(1)静态吸附茶皂素用大孔树脂的筛选:① 静态吸附试验:根据大孔树脂的物理性质,选取10种大孔树脂进行静态吸附筛选试验。分别称取5g已预处理的大孔树脂[19],置于带塞锥形瓶中,加入6g/L的茶皂素水溶液50mL,置于25℃恒温培养箱中,调节转速为1 200r/min,静态吸附6h,每隔一定时间取一定体积的样液,测定其茶皂素含量,计算茶皂素的吸附率,比吸附量,并绘制茶皂素静态吸附动力学曲线。②静态解吸试验:将上述吸附完全的大孔树脂用蒸馏水洗净,置于带塞锥形瓶中,加入70%的乙醇50mL进行大孔树脂解吸,将其置于25℃恒温培养箱中,调节转速为1 200r/min,静态解吸6h,测定其上清液中茶皂素的含量,计算茶皂素的解吸率,比解吸量[13]。
(2)动态吸附茶皂素用大孔树脂的筛选:① 动态吸附试验:分别称取20g已处理好的大孔树脂,湿法装柱,加入30mg/mL的茶皂素溶液50mL,静置2h,用蒸馏水冲洗树脂柱,直至流出液呈无色透明,收集流出液,并测定总流出液中的茶皂素浓度。计算树脂的吸附率、比吸附量。② 动态解吸试验:将上述充分吸附后的树脂分别用70%乙醇溶液以相同的流速进行洗脱,收集滤液,测定洗脱液中茶皂素的浓度,计算解吸率和比解吸量。
1.3.6 大孔树脂纯化茶皂素的条件优化 根据大孔树脂静态和动态吸附试验的筛选结果,选择效果最好的大孔树脂用于茶皂素纯化。通过考察不同的上样浓度和上样流速对茶皂素吸附率的影响,不同的洗脱剂(乙醇)浓度、洗脱剂流速和洗脱剂体积对茶皂素解吸率的影响,来优化大孔树脂纯化茶皂素的条件。
1.3.7 大孔树脂对茶皂素的纯化 称取100g已预处理好的大孔树脂,湿法装柱,用95%乙醇冲柱,然后用蒸馏水冲洗至无醇味。将上述经过膜分离初步纯化得到的茶皂素,配成浓度为30mg/mL的水溶液,以0.5mL/min流速上样250mL,待上样结束后静置2h,使其吸附完全。用蒸馏水洗至流出液呈无色,然后用已优化的大孔树脂纯化茶皂素的条件,进行茶皂素的纯化,计算茶皂素的得率和纯度。
1.4 数据处理
所有试验重复3次,采用SPSS 18.0软件进行统计学分析,试验数据均以珚x±s表示,使用ANOVA方差分析进行多组间差异显著性检验,使用t检验法进行组间比较,当P<0.05,认为具有统计学意义。
2 结果与分析
2.1 茶皂素标准曲线
以吸光度为纵坐标,茶皂素的浓度为横坐标绘制茶皂素标准曲线(图1),回归方程为:y=0.481 8x-0.005 9,R2=0.999 6。
2.2 膜分离纯化茶皂素

图1 茶皂素标准曲线Figure 1 Standard curves of tea saponin
2.2.1 茶皂素浓度的选择 由图2可知,随着茶皂素浓度的增大,茶皂素的透过率和膜通量均降低,当茶皂素浓度从1%增加到2%时,透过率从72.67%急剧下降至33.69%;茶皂素浓度继续增加,下降趋势变平缓。在膜分离过程中,溶质被膜截留,在滤膜表面积累,导致溶质在滤膜表面的浓度逐渐高于溶液主体中的浓度,在浓度梯度的作用下,溶质由膜表面向本体溶液扩散,从而形成边界差,使流体阻力与局部渗透压增大,导致膜通量降低。当溶剂向膜面流动时,溶质向膜面流动的速度与浓度梯度使溶质向本体溶液扩散的速度达到平衡时,在膜面形成浓差极化边界层,该现象称为浓差极化。高浓度时,容易形成多层吸附,同时也会导致浓差极化的加剧,会增加透过阻力,增加系统的运行压力,严重时会导致结晶析出,阻塞流道,从而导致膜通量降低和系统运行恶化,影响膜分离的效果[19]。此外,由于三萜类皂苷具有表面活性剂的性质,在溶剂中会缔合形成胶束[20],当溶液超过某一浓度时,胶束形成,粒径变大,从而影响膜分离的效果。因此在进行膜分离纯化时,宜选择较低浓度的茶皂素进行粗分离。

图2 陶瓷膜对不同浓度茶皂素的分离效果Figure 2 The purification effect of tea saponin under different concentration
2.2.2 膜元件的选择 按分离过程,膜分离可分为微滤、超滤、纳滤、反渗透、渗析、电渗析、气体分离、渗透蒸发、液膜等不同的类型,其中微滤、超滤和纳滤为常见的依靠压力差为推动力的分离方式,操作简单,耗能低,易于工业化应用。茶皂素的平均分子量为1.2kDa左右,根据其特性及其粒径大小,选 择 微 滤(陶 瓷 膜)、超 滤 (10.0,5.0,3.5kDa)、纳 滤(360Da)3种类型的膜元件来分离茶皂素,以获得最优的膜分离效果。将浓度为1%的茶皂素溶液分别通过不同类型和孔径的膜,其茶皂素透过率和截留率的结果见图3。试验结果表明,72.67%的茶皂素能够透过陶瓷膜;使用超滤膜时,茶皂素的透过率很低,并且随着膜孔径的减小,透过率降低,截留率升高;使用纳滤膜时,茶皂素的透过率为零。该试验结果与赵敬娟等[17]的一致,即孔径越小,对粒子或溶质的截留率越高。根据膜分离原理,陶瓷膜可以截留大部分的蛋白质等大分子杂质,通过收集透过液即可达到纯化目的,而360Da的纳滤膜可以透过水、无机盐等小分子物质,通过收集纳滤的截留液可以达到浓缩的目的,因此选取陶瓷膜和纳滤膜相结合的方式纯化茶皂素。取经陶瓷膜分离的茶皂素透过液2 600mL,经360Da纳滤浓缩得到浓缩液750mL,浓缩倍数为3.5倍,浓缩试验历时22min。膜纯化后浓缩液经喷雾干燥得到淡黄色粉末状的茶皂素,其得率为62.1%,纯度为79%。

图3 不同的膜对茶皂素的纯化效果Figure 3 The purification effet of tea saponin by different membrane
2.3 大孔树脂的选择
2.3.1 静态吸附茶皂素用大孔树脂筛选 不同的大孔树脂因材质、极性强弱、孔径大小、比表面积等物理性质不同,其对同种物质的吸附纯化效果也不同。试验中所选取的10种大孔树脂,涵盖范围较广,能够初步考察不同极性、孔径、比表面积的大孔树脂对茶皂素纯化效果的影响,结果见图4。由图4可知,XAD7HP、HPD-600、AB-8、HP-20 4种大孔树脂对茶皂素的吸附和解吸作用良好,吸附率和解吸率均达到85%以上,其中以XAD7HP大孔树脂最高,吸附率和解吸率分别高达92%和94%,即经纯化后的茶皂素的得率(吸附率×解吸率)最高,为86.48%。

图4 不同大孔树脂对茶皂素的纯化效果Figure 4 The purification effet of tea saponin by different membrane
选取效果较好的4种大孔树脂绘制静态吸附动力学曲线,见图5。由图5可知,4种大孔树脂在0.5h内吸附速度最快,随着时间的推移,吸附速度逐渐变缓,最后趋于平衡,为典型的langmuir吸附等温线,属于单分子层吸附[8,21]。

图5 静态吸附动力学曲线Figure 5 The curve of static adsorption kinetics
2.3.2 动态吸附茶皂素用大孔树脂的筛选 由于大孔树脂对物质的动态吸附和静态吸附存在一定差异,并且在实际的试验和生产过程中,都是采用动态吸附洗脱方式,所以采用动态吸附法进一步筛选大孔树脂。以静态吸附试验筛选出的效果较好的4种大孔树脂,进行动态吸附筛选试验,结果见图6。

图6 大孔树脂动态吸附筛选试验Figure 6 The screening experiment of macroporous resin dynamic adsorption
由图6可知,XAD7HP大孔树脂吸附率和解吸率分别高达70.81%和90.62%,均高于其他3种大孔树脂,茶皂素的得率最高,为64.17%。结合静态吸附筛选试验可知,XAD7HP型大孔树脂用于茶皂素的纯化,效果最佳。
大孔树脂的吸附作用是依靠树脂和被吸附的分子之间的范德华引力,通过树脂巨大的比表面进行物理吸附,根据有机物吸附力和分子量大小经一定溶剂洗脱而达到分离纯化、除杂的目的。茶皂素的平均分子量为1 200Da左右,极性强,易溶于热水、甲醇水溶液、乙醇水溶液中。根据相似相容原理以及大孔树脂吸附原理,适宜选用极性大,孔径大,比表面大的大孔树脂。XAD7HP属于极性大孔树脂,比表面积大,平均孔径较大,适宜分离纯化茶皂素。
2.4 大孔树脂纯化茶皂素的条件优化
2.4.1 上样液浓度对吸附效果的影响 由图7可知,随上样液浓度的增加,吸附率先增加后减小,浓度为30mg/mL时吸附率最大。当上样液浓度过低时,茶皂素与大孔树脂之间的吸附不充分,造成吸附率低;而上样液浓度过高时,溶液中杂质浓度升高,与茶皂素在树脂上竞争吸附,同时浓度过高时,溶液易产生沉淀,影响其吸附率[22]。因此茶皂素浓度为30mg/mL时吸附效果最佳。
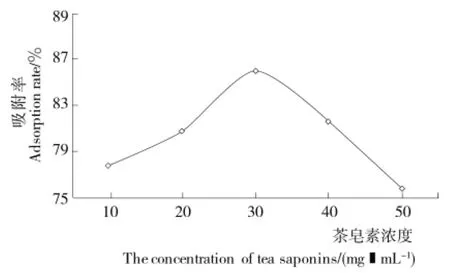
图7 茶皂素浓度对吸附效果的影响Figure 7 The adsorption effect of the tea saponin concentration
2.4.2 上样流速对吸附效果的影响 由图8可知,流速为0.5mL/min时,茶皂素与大孔树脂的吸附时间充足,吸附率最高;随着流速增加,茶皂素与大孔树脂的接触时间减少,吸附率逐渐降低,吸附效果变差。因此选用0.5mL/min的流速进行上样。

图8 上样流速对吸附效果的影响Figure 8 The adsorption effect of the sample flow rate
2.4.3 洗脱剂浓度对解吸效果的影响 由图9可知,随着乙醇浓度增大,解吸率增加,当乙醇浓度为70%,80%,90%时,解吸率几乎不变,均为92%左右,对茶皂素洗脱效果较好,结合成本考虑,选用70%乙醇进行洗脱。乙醇浓度为10%时,茶皂素的洗脱率低,色素等水溶性较好的杂质首先被洗脱去除;乙醇浓度达到40%时,洗脱率增加至43.96%,部分茶皂素被洗脱;乙醇浓度为70%时,茶皂素基本洗脱完全。综合考虑,选取10%,40%,70%的乙醇进行梯度洗脱,可以去除大部分杂质,得到较高纯度的茶皂素。

图9 洗脱液乙醇浓度对解吸效果的影响Figure 9 The desorption effect of ethanol concentration
2.4.4 洗脱剂洗脱流速对解吸效果的影响 由图10可知,随着洗脱剂流速的增加,洗脱率呈现先增加后降低的趋势。洗脱流速为1mL/min时,洗脱率最大,洗脱效果较为理想。洗脱流速增大,乙醇与大孔树脂吸附的茶皂素之间的作用时间减少,影响其解吸效果,但流速过慢,增加洗脱时间,将影响茶皂素解吸效率。
2.4.5 洗脱液体积对解吸效果的影响 大孔树脂洗脱时,洗脱剂的体积越大洗脱效果越好,但成本也相应增加。由图11可知,洗脱剂用量为3BV时,茶皂素洗脱率已高达93%,洗脱剂用量继续增加,洗脱率增加幅度很小,所以3BV的洗脱剂量最为适宜。

图10 洗脱液流速对解吸效果的影响Figure 10 The desorption effect of eluent flow rate

图11 洗脱液体积对解吸效果的影响Figure 11 The desorption effect of eluent volume
2.5 大孔树脂对茶皂素的纯化
采用优选出的XAD7HP大孔树脂以流速0.5mL/min、茶皂素浓度30mg/mL上样,以10%,40%,70%的乙醇各3BV,在流速1mL/min下进行梯度洗脱,收集40%和70%乙醇的洗脱液,浓缩、干燥后得到白色粉末状茶皂素,其得率为55.3%,纯度为95%。
3 结论
本试验采用膜分离和XAD7HP大孔树脂联用技术来纯化茶皂素,其得率和纯度均高于张新福[17]通过膜分离和AB-8大孔树脂纯化茶皂素的研究结果。同时结果表明,膜分离法与树脂联用技术纯化茶皂素时,无需添加其他化学试剂,无污染,生产过程简单,成本低,效率高,易于连续化生产,是一种可工业化推广的方法。
1 侯如燕.茶皂素提取纯化及其抗菌活性研究[D].合肥:安徽农业大学,2002.
2 Sparg S G,Light M E,Van Staden J.Biological activities and distribution of plant saponins[J].Journal of Ethnopharmacology,2004,94(2):219~243.
3 Jin Feng,Chen Ying,Liu Xin,et al.Efficient improvement of surface activity of tea saponin through Gemini-like modification by straightforward esterification[J].Food Chemistry,2015,171:272~279.
4 刘蓉,张利蕾,范亚苇,等.茶渣中粗茶皂素的纯化及其抗氧化和抑菌活性[J].南昌大学学报(工科版),2013,35(1):17~21.
5 李祥,曹江绒,种亚莉.正丁醇萃取茶皂素的研究[J].陕西科技大学学报(自然科学版),2014,32(1):87~90.
6 赵娟,黄健花,蔡春明,等.沉淀法纯化茶皂素的工艺研究[J].中国油脂,2010,35(11):58~61.
7 Chen Junghui,Wu Hsingyu,Liau Bingchung,et al.Identification and evaluation of antioxidants defattedCamellia oleiferaseeds by isopropanol salting-out pretreatment[J].Food Chemistry,2010,121(4):1 246~1 254.
8 涂云飞,杜先锋,张雪波.干柱层析法制备油茶总皂苷对照品初探[J].中国农学通报,2006,22(10):343~345.
9 Yang Peng-jie,Zhou Ming-da,Zhou Cheng-yun,et al.Separation and purification of both tea seed polysaccharide and saponin from camellia cake extract using macroporous resin[J].Journal of Separation Science,2015,38(4):656~662.
10 程轶群,赵敬娟,夏涛,等.茶皂素的陶瓷膜纯化工艺优化及脱色研究[J].农产品加工(学刊),2011(11):11~15.
11 韩晓彤,库海福,李霞,等.大孔树脂HPD400分离茶皂素的研究[J].粮油食品科技,2014,22(6):39~43.
12 曹江绒.茶皂素的提取、纯化及在洗发液中的应用研究[D].西安:陕西科技大学,2014.
13 吴丽,黄福平.茶籽中茶皂素的分离纯化及脱色工艺研究进展[J].南方林业科学,2015(1):32~35.
14 胡婕伦,聂少平,龚毅,等.响应曲面法优化茶皂素提取工艺的研究[J].食品科学,2009,30(18):106~109.
15 张海龙.冷榨茶籽饼中茶皂素的提取纯化及鉴定[D].武汉:武汉工业学院,2012.
16 郭辉力,邓泽元,彭游,等.微波/光波辅助提取茶皂素的研究[J].食品工业科技,2008,29(11):168~170.
17 张新富.油茶皂苷分离纯化及生物活性研究[D].合肥:安徽农业大学,2013.
18 赵敬娟.油茶皂苷的提取及膜分离纯化的研究[D].合肥:安徽农业大学,2009.
19 贾存勤,李阳春,屠鹏飞,等.HPD系列大孔吸附树脂预处理方法研究[J].中国中药杂志,2006,30(18):1 425~1 427.
20 Rigano L,Lionetti N,Otero R.Quillaja triterpenic saponinsthe natural foamers[J].SOFW-Journal,2009,135(4):1~9.
21 Buran T J,Sandhu A K,Li Zheng,et al.Adsorption/desorption characteristics and separation of anthocyanins and polyphenols from blueberries using macroporous adsorbent resins[J].Journal of Food Engineering,2014,128(1):167~173.
22 孟维,李湘洲,吴志平,等.AB-8型大孔吸附树脂分离纯化茶皂素工艺[J].食品科技,2013,38(9):213~217.

