胃静脉曲张的预防和治疗对策
王 虹,顾而立
上海市静安区中心医院(复旦大学附属华山医院静安分院)消化内科,上海200040
胃静脉曲张(gastric varices,GV)在门脉高压患者中达18% ~70%,占急性静脉曲张出血原因的10% ~36%。GV 在存在门脉高压但无食管静脉曲张患者中发生率为5% ~12%。GV 的出血发生率虽低于食管静脉曲张,但出血量大凶险且不易控制,死亡率高达10% ~30%,GV 在出血自动停止后的再出血率非常高,达35% ~90%[1-2]。虽然对于食管静脉出血在国际上已有提出的预防和治疗规范,但由于缺少足够的临床证据,很少有关对GV 预防和治疗的各种手段的比较和推荐。本文对近年GV 预防和治疗的进展作一概述。
1 GV 的分类
按照GV 在胃内的分布,可以分为胃食管静脉曲张(gastroesophageal varices,GOV)和孤立性胃静脉曲张(isolated gastric varices,IGV)。GOV 可以分为GOV1 和GOV2,前者为食管静脉曲张延伸至食管胃交界处以下沿胃小弯分布;后者为食管静脉曲张在胃食管交界处上方延伸到胃底。IGV 包括IGV1 和IGV2,前者位于胃底,又称胃底孤立性静脉曲张,后者为位于胃和十二指肠第一段任何部位的异位静脉曲张。胃底静脉曲张(GOV2 和IGV1)尽管较GOV1 少见,但出血的发生率和出血量远高于后者。GOV1 为食管静脉曲张的延伸,拥有同样的血管解剖和对治疗的应答,因此不在本章讨论。
2 初级预防
很少有研究比较GV 出血的初级预防。在一项包括肝硬化合并胃底静脉曲张117 例患者(IGV 69%,GOV2 31%)的前瞻性研究中[3],随访1、3、5 年的出血发生率分别为16%、36%和44%。Child A 级伴小曲张静脉无红色疹的年出血发生率为4%,而Child C 级伴大曲张静脉伴红色疹的年出血发生率达65%,由于GV 出血较食管静脉曲张出血更为严重和有更高的死亡率,因此,及时确定“高危”的GV 患者和及早干预以防止大直径的GV 出血很有必要。一项比较氰基丙烯酸盐粘合剂(Cyanoacrylate,CA)(n =30)和β 受体阻滞剂(n=29)对尚未治疗的直径>20 mm 的GV 患者预防的研究[4],平均随访26 个月显示在粘合剂治疗组、β 受体阻滞剂组和不治疗组因GV 出血的发生率分别为13%、28%和45%,曲张静脉的直径大小、红色疹和用终末期肝功能模式评估的肝功能为出血高风险的危险因子,而肝功能的评分为出血的高度危险因素[3]。在该研究中,GV 主要是GOV2,伴部分IGV1,在比较CA 预防出血和生存率上和不治疗或用普萘洛尔预防出血上更具有优势。CA 在预防出血和生存率上显著优于未治疗的对照组,但和普洛萘尔比较时,仅在预防出血上显示出优越性,因此,在正式将CA 作为一级预防的推荐治疗前还需要大量的研究来证实。β-受体阻滞剂在预防GV 初次出血的有效性尚未证实。GV 在接受β-受体阻滞剂治疗后,总体的出血率和死亡率为38%和17%。在GV 患者接受β-受体阻滞剂后肝静脉压力梯度(HVPG)降低2 mmHg 的应答率达34%,类似于食管静脉曲张的治疗疗效,但尽管减少了HVPG,并没有减少GV 的首次出血率和死亡率,可能是由于造成GV 出血的因素除了HVPG 外还有GV 的直径大小、大曲张静脉内的高血流和肝病的严重程度。
3 急性GV 出血处理
一般的意见对胃底曲张静脉的初步处理和食管静脉曲张类似。IGV1 常发生于大分支的自发性脾肾静脉分流后,可能在门静脉压力梯度低于食管静脉曲张出血所需的压力时发生出血,因此可以推测需要更有力的血管收缩剂,使其作用不仅限于减少门脉压力还需明显减少门静脉和侧支循环血流才得以控制贲门胃底静脉曲张出血。单用血管活性药物的IGV1 患者中40%还需要急症介入治疗,主要是经颈静脉肝内门体静脉分流术(transjugular intrahepatic portosystemic shunt,TIPS)以获得5 d 内的出血控制[4]。因此,对于IGV1 不推荐单独应用血管活性药物而是同时应用内镜或TIPS 治疗。但至今高质量的内镜治疗急性GV出血的研究依然缺乏。大多数发布的RCT 研究中只有一半患者有贲门-胃底曲张静脉。尽管存在这些缺陷,大多数非对照的研究报告显示,应用组织粘合剂如CA 具有高比例的出血控制率(>90%)[5]。此外,小样本的RCT 比较组织粘合剂和内镜下圈套结扎(endoscopic band ligation,EBL)或内镜下硬化剂注射(endoscopic injection sclerotherapy,EIS)显示组织粘合剂在获得初次出血的止血效果上等同或优于硬化剂。对GOV1 曲张静脉的治疗应遵循食管静脉曲张出血的治疗,尽管也有推荐应用组织粘合剂治疗GOV1 曲张静脉,但以应用EBL 较适宜。目前多数专家的意见为内镜下应用CA 是治疗GV(尤其是IGV1 和IGV2)导致急性出血的首选。如果组织粘合剂无法获得,圈套结扎可能对小GOV2 曲张静脉有益。
联合应用药物和内镜治疗是急性食管静脉曲张出血的标准治疗,然而,由于数据缺乏,并不能明确这种治疗是否也适用于GOV2 或IVG1 曲张静脉出血。由于大多数病例在内镜诊断前已经开始应用药物治疗,因此,联合应用药物和内镜治疗(倾向于组织粘合剂)是治疗GV 的合理手段。对于血液动力学不稳定的大出血,三腔管是作为过渡桥梁的临时措施(最多不超过24 h),使用直到确定有效的治疗得以实施。TIPS被认为是控制初次出血失败或联合治疗后再出血的GOV2 或IGV1 患者的合适选择。和食管静脉曲张出血的推荐不同,GV 的出血治疗失败不推荐再次内镜治疗。两项回顾性研究分析CA 和TIPS 在急性曲张静脉出血的疗效,其中包含患有贲门-胃底曲张静脉出血的病例[6],这些小样本的研究中没有得出肯定的结论。然而,通过TIPS 治疗达到目标门静脉压力梯度是否能防止胃底静脉曲张出血的证据尚未得到。但是有报道认为即使门静脉压力梯度略低于12 mmHg 仍可能出现胃底静脉曲张出血[7-8]。但如果TIPS 术后使门静脉压力梯度低于12 mmHg 时,就没有充分的理由再去实施栓塞术。
尚无RCT 评价应用TIPS 能否作为IGV1 出血的一线治疗获得止血的疗效。TIPS 不推荐作为曲张静脉出血的一线治疗的原因在于TIPS 对治疗后的生存率没有改善,同时肝性脑病的发生率增加。但已有随机对照研究显示对于“高危”的肝硬化患者(Child-Pugh C 级或Child-Pugh B 级在静脉输注血管活性药物情况下仍存在内镜下的急性出血)早期接受聚四氟乙烯包被支架的TIPS 治疗和药物/内镜治疗相比较,控制出血失败率、再出血率和死亡率更低[9]。同时,应用包被TIPS 没有显著增加肝性脑病的发生率。近期,有比较用包被支架和无包被支架TIPS 治疗曲张静脉出血的临床研究显示,应用包被支架的TIPS 治疗后的死亡率、肝性脑病发生率均低于无包被支架治疗组。因此,可能是包被支架技术上的改进提高了TIPS 治疗的临床效果,从而可将这一方法前移到急性曲张静脉出血的早期治疗[10]。
4 二线预防
预防GV 再出血的选择包括应用非选择性β-受体阻滞剂、反复内镜下注射组织粘合剂、放射介入治疗(TIPS 和BROT)、外科干预和肝移植。
4.1 β-受体阻滞剂和组织粘合剂 在急性GV 出血应用组织粘合剂(主要是CA)后再出血的发生率为7% ~65%,大多系列的报道<15%[11]。这样,在初次应用组织粘合剂止血后,须每隔2 ~4 周重复注射直到内镜下显示血管闭塞。许多病例报道和对照研究评估组织粘合剂(主要是CA)预防GV 再出血的长期疗效,在大多数的研究,每次用1 ~2 ml 经2 ~4 次注射可以获得曲张静脉消除的效果[11]。CA 对预防再次出血的效果和初次止血类似,优于硬化剂和圈套结扎。但是在和非选择性β 受体阻滞剂比较时出现矛盾的结果。在一项小规模的随机研究中,41 例食管(n=31)或GV(GV1 和GV2,n =10)初次治疗用CA 治疗的出血患者,随机接受重复CA 注射(n =21)或口服普萘洛尔(80 ~160 mg)(n=20)[12],结果在曲张静脉再出血和死亡率上差异无统计学意义,但CA 组的并发症发生率高于对照组(47% vs 10%)。这项研究的主要缺陷是GV 患者的例数太少。另一项RCT 研究,64 例GV出血患者(54 例GOV2 和10 例IGV1)随机分为接受CA(n =33)或普萘洛尔(n =34)预防再次出血,结果CA 组再出血的发生率显著低于β 受体阻滞剂组(15% vs 55%),经26 个月随访,死亡率也低于β 受体阻滞剂组(3% vs 25%,P =0.026),CA 组的并发症发生率为3%[13]。
有研究对95 例患有GV(GOV2,n =77;IGV1,n =18)的出血患者分别接受β-受体阻滞剂联合反复CA(每隔3 ~4 周一次直到曲张静脉闭塞)或单独反复CA注射。随访19 个月总体再出血率(22% vs 26%,P=0.336)和生存率(22% vs 20%,P=0.936)在两组之间差异无统计学意义。1 年无再出血事件和生存率在两组间也无明显差异(77% vs 76.5%)。这一研究的结果提示,和食管静脉曲张出血不同,在反复CA 注射基础上加用β-受体阻滞剂在预防GV 的再出血和死亡上没有获益。尽管存在这一发现,非选择性β-受体阻滞剂在同时合并食管静脉曲张时有效,在更大规模和更长随访的研究结果出现前,我们仍推荐使用非选择性β-受体阻滞剂作为预防GV 再出血的辅助治疗[14]。
4.2 超声内镜 超声内镜(endoscopic ultrasound,EUS)能够显示食管胃曲张静脉和门脉高压患者其他静脉侧枝。Boustière 等[15]认为GV 大小和胃壁异常可行内镜下图像分级。研究者比较内镜和超声内镜,认为前者对食管静脉曲张,而后者对GV 的分级和门脉高压性胃病的出血征象具有更好的评价能力。EUS在评价GV 出血风险的作用目前是日益引起广泛关注的领域。EUS 探针能够用于测量曲张静脉的大小(直径)、曲张静脉壁的厚度,后者被认为是比曲张静脉直径更好的出血预测指标。曲张静脉腔内压力测定可能是预测出血风险的最好指标,但由于高风险而在实践中受限,通过测定EUS 引导下的食管静脉压力来预测出血的风险被证明和HVPG 相关。EUS 引导下硬化剂注射治疗对GV 和EV 有效,能获得较高的曲张静脉闭塞率和长期的随访下较低的再出血发生率。研究报道,应用超声内镜引导下纤维线圈置入加用CA 注射治疗胃底GV(IGV1 和IGV2)可能改善这一技术的有效性[16]。在EUS 引导下注射CA 前将纤维线圈置于曲张静脉可使栓塞剂精准输入到曲张静脉腔内,在多普勒超声下证实血管腔的闭塞,线圈作为支架可预防CA 移位到大静脉导致的远端栓塞事件发生。在这一研究中,30 例IGV1 和GOV2 患者成功经食管EUS 引导下注射CA 治疗获得止血。平均GV 获得注射CA治疗的次数为每个患者1.3 次。平均每个GV 静脉球获得的注射量为1.4 ml。大多数患者(96%)经过单次的注射获得闭塞。1 例患者出现再出血,经再次注射成功治疗。没有发生和操作相关的并发症。虽然这项研究规模较小,但EUS 引导的治疗在选择的患者中是成熟的方法,然而在把这项技术作为常规的治疗GV 的手段仍需更多的数据支持。Romero-Castro 等[17]对EUS 引导下的线圈置入(EUS-Coling)和EUS 引导下的CA 注射(EUS-CA)治疗30 例GV 患者的多中心研究结果显示,单次线圈置入导致CA 完全静脉闭塞率达81.8%(9/11),而EUS-CA 组为52.6%(10/19),EUS-Coling 组有1 例(9.1%)食管静脉曲张出血的并发症发生,EUS-CA 组的并发症发生率为57.9%,有1例发生发热和胸痛(但CT 证实该例没有肺栓塞的发生),但9 例(47. 4%)发生CT 证实的无症状的肺栓塞。
4.3 其他内镜治疗 其他内镜治疗也已经用于预防GV 再出血。硬化剂治疗由于有过高的再出血率(50% ~90%)已经禁止使用。静脉曲张的圈套结扎可以用于GOV2 或IGV1。可分离的圈套结扎(detachable loop snares)联合β-受体阻滞剂对>2 cm 的GV已显示出再出血率低的结果,但是,该治疗的临床应用数据较少,且没有和其他GV 治疗的比较研究,因此不能作为常规推荐。凝血酶将纤维蛋白原转化为纤维凝块,在GV 内形成凝块从而阻塞血流的流动。牛凝血酶由于存在可能潜在的脘病毒传播的风险而被禁用。已有的数据显示,凝血酶是安全有效的,在治疗急性GV 上止血率为7% ~50%。罕有对GV 的随访和曲张静脉清除率的报道。在初次止血成功后,每隔2 ~3周再次注射凝血酶直到静脉曲张消退。由于大多数的数据来自病例报道,常规应用凝血酶并不能作为常规推荐[18]。我国大多数医院使用的凝血酶冻干粉为牛血或猪血中提取的凝血酶原经激活而得以凝血酶的冻干粉,尚无应用凝血酶在血管内注射的使用指证。
4.4 TIPS 已有3 项小型研究对TIPS 和CA 预防GV 出血的作用进行了评估,其中2 项是回顾性观察研究,1 项是前瞻性的。很明显,3 项研究中大多数患者包括GOV1,部分GOV2 和1 例IGV1。所选用的支架无包膜,这种支架在TIPS 治疗的效果和获得的生存率上都不如应用有包膜的支架[19]。但这2 项研究显示CA 组与TIPS 组相比有更高的再出血率(40% vs 15%),两组并发症的发生率相似,但TIPS 治疗患者有更多的肝性脑病的发生,长期因病需要住院率高于CA组。两组在患者生存率上无显著性差异[20]。Mahadeva 等[21]分析了43 例GV 出血患者的两种治疗方案的价格,发现CA 注射较TIPS 更具有效益价值比。总体上说,TIPS 对预防GV 再出血是一种有效的治疗选择。但是,由于上述所提到的不足,还需更多的研究来证明TIPS 对于GV 出血二级预防的作用,从而决定是作为普遍应用还是作为更为保守的治疗后的挽救治疗的选择。荟萃分析显示,应用带有包膜的TIPS 可能更适用于急性曲张静脉出血的肝硬化患者,但是尚无有包膜的TIPS 和CA 的比较研究[22]。
4.5 外科 近年来,外科治疗已经退出了作为门脉高压出血的治疗选择,这是由于内镜和放射介入等更小创伤技术的应用。在选择的患者中,GV 和由于孤立性脾静脉栓塞造成的节段性/左侧门脉高压患者可能是脾切除或脾栓塞的选择,但是相关数据仍然较少。
4.6 经球囊导管阻塞下逆行闭塞静脉曲张术(balloon-occluded retrograde transvenous obliteration,BRTO) BRTO 已经作为直接闭塞GV 的一种治疗方法。自从Kanagawa 等[23]介绍以来,BRTO 由于其轻微创伤和对GV 的高疗效,已经广泛被日本和美国的一些医院所接受。BRTO 最常见的并发症是上腹部和后背疼痛(76%)、发热(26%)和短暂血尿(53%)[24-25]。在一项研究中,8%的患者发生细菌性腹膜炎,经过保守治疗均康复。少数患者发生门静脉血栓和肾静脉血栓,且多为临床隐匿发生。肺栓塞、肺水肿、线圈移位、对乙醇油酸盐过敏也有报道[26]。
BRTO 技术成功的标志是硬化剂完全闭塞胃静脉,成功率可达77% ~100%。在某些研究中,这种高比例的成功需要反复BRTO 操作才能获得,在成功的BRTO 术后GV 的再出血率为0 ~15%[25]。研究提示BRTO 在预防GV 出血方面可能较TIPS 或CA 更为有效[27]。然而,对高危GV 患者一级预防的治疗只有小样本的研究,比较不同治疗(抑或TIPS 或组织胶治疗)的研究较期望的少以致不能做出确定的结论。目前只有一项小规模的研究比较TIPS(n =7)和BRTO(n=8)在再出血率、肝性脑病或生存率上无显著性差异。BRTO 在增加门静脉血流和改善肝功能上有潜在的优势。因此可能作为不能耐受TIPS 患者治疗的替代选择。已有报道,在BRTO 后食管静脉曲张的直径和食管静脉曲张出血的风险增加(1 年7. 3% 和27%)。其他和门脉压力增高相关的并发症包括门脉高压性胃病(5% ~13%)、腹水(0 ~44%)、胸腔积液(0 ~72%)。由于门脉高压加重的后果,某些病例在BRTO 后不得不实施TIPS 手术[28]。
因此,虽然BRTO 看来是一项能够成功控制和防止GV 出血的技术,但是还缺乏足够信服的数据把BRTO 作为GV 处理的常规推荐。大多数研究者的观点是,BRTO 可以为GV 出血和大的门肾分流而TIPS有反指证(如患者有顽固性肝性脑病或老年人)患者考虑[5]。最近,美国放射学介入放射适宜技术标准委员会认识到BROT 是TIPS 在一定的解剖学和临床情况下的可行的替代手段。随着BROT 在美国的实践增多,部分观点认为BROT 适用于患者不能使用TIPS 情况下的选择,另一部分观点认为,究竟是选用BROT 还是TIPS 的决定权应该留给手术者根据其习惯而选择。有研究已经联合应用TIPS 和BROT 实施对GV 的治疗。BROT 和TIPS 在血液动力学的后果是截然不同的,BROT 栓塞的结果常和自发性门体静脉分流相关,后者常导致门脉高压增加而TIPS 产生门体静脉分流减少门脉血流而降低门脉压力。联合应用TIPS 和BRTO 在临床结局上较单独治疗更有优势。联合治疗的优势在于,BRTO 的自发性门体分流造成门脉高压的缺陷被TIPS 的栓塞弥补,结局是胸腹水的发生率在单独BRTO 1 年后为57%,而联合治疗为0;减少曲张静脉再出血的发生率,单用TIPS 术后1 年的发生率为11.9%,而联合治疗为0[29-30]。
由于在GV 处理上还缺乏足够的RCT 研究,因此还没有建立最佳的处理策略。CA 和BRTO 都是特殊治疗手段,并非在所有医疗单位都可以实施。推荐处理GV 的流程如图1 所示。对于使用CA 或β 受体阻滞剂应用于GA 出血的初级预防的数据还非常少,尚不能形成对GA 出血初级预防的推荐手段,然而,患者如果合并食管静脉曲张应该接受β 受体阻滞剂。在经过补液和给予血管收缩剂及抗生素后,如果条件许可,应用内镜下注射CA 应该是一线治疗方法。在急性出血阶段过后,患者应该接受β 受体阻滞剂单独使用或有条件的话,联合反复多次的CA 注射。TIPS 在控制活动性GV 出血上非常有效,也可以作为二级预防手段。然而,也带来了肝性脑病的风险。TIPS 还是内镜治疗失败患者最好的治疗策略。
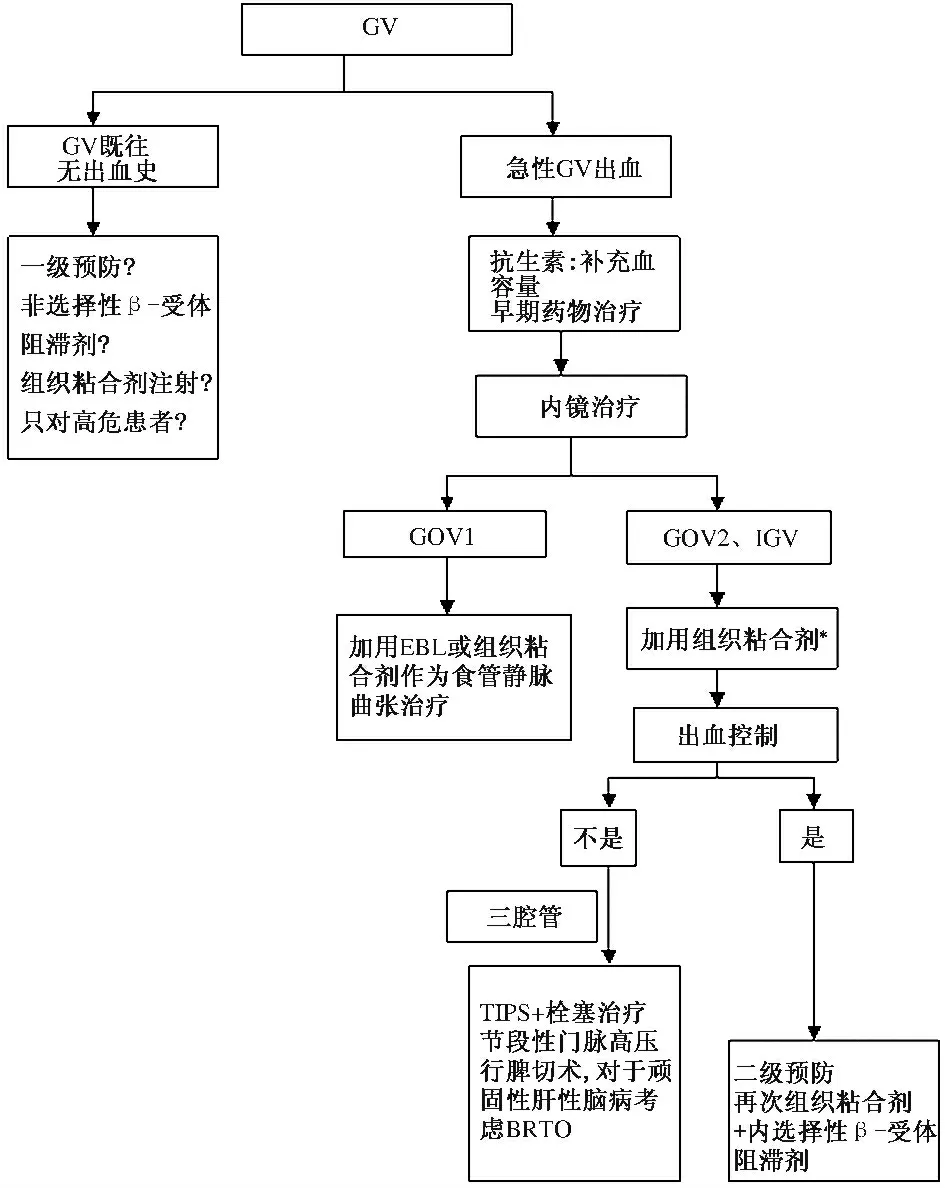
图1 GV 处理流程Fig 1 The process of GV treatment
[1] Crisan D,Tantau M,Tantau A. Endoscopic management of bleeding gastric varices-an updated overview [J]. Curr Gastroenterol Rep,2014,16(10):413.
[2] de Franchis R,Baveno V Faculty. Revising consensus in portal hypertension:report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension[J]. J Hepatol,2010,53(4):762-768.
[3] Mishra SR,Sharma BC,Kumar A,et al. Primary prophylaxis of gastric variceal bleeding comparing cyanoacrylate injection and beta-blockers:a randomized controlled trial [J]. J Hepatol,2011,54(6):1161-1167.
[4] Escorsell A,Abraldes JG,Pipa-Muñiz M,et al. Prognosis of acute bleeding from isolated fundal varices in patients with cirrhosis:a European cohort[J]. Hepatology,2012,56 (Suppl):748A.
[5] Garcia-Pagán JC,Barrufet M,Cardenas A,et al. Managementg of gastric varices[J]. Clin Gastroenteol Hepatol,2004,12(6):919-928.e1;quiz e51-52.
[6] Xiao T,Chen L,Chen W,et al. Comparison of transjugular intrahepatic portosystemic shunt (TIPS)alone versus TIPS combined with embolotherapy in advanced cirrhosis:a retrospective study[J]. J Clin Gastroenterol,2011,45(7):643-650.
[7] Gaba RC,Bui JT,Cotler SJ,et al. Rebleeding rates following TIPS for variceal hemorrhage in the Viatorr era:TIPS alone versus TIPS with variceal embolization[J]. Hepatol Int,2010,4(4):749-756.
[8] Xiao T,Chen L,Chen W,et al. Comparison of transjugular intrahepatic portosystemic shunt (TIPS)alone versus TIPS combined with embolotherapy in advanced cirrhosis:a retrospective study[J]. J Clin Gastroenterol,2011,45(7):643-650.
[9] García-Pagán JC,Di Pascoli M,Caca K,et al. Use of early-TIPS for high-risk variceal bleeding:results of a post-RCT surveillance study[J].J Hepatol,2013,58(1):45-50.
[10] Siramolpiwat S. Transjugular intrahepatic portosystemic shunts and portal hypertension-related complications [J]. World J Gastroenterol,2014,20(45):16996-17010.
[11] Rajoriya N,Forrest EH,Gray J,et al. Long-term follow-up of endoscopic Histoacryl glue injection for the management of gastric variceal bleeding[J]. QJM,2011,104(1):41-47.
[12] Evrard S,Dumonceau JM,Delhaye M,et al. Endoscopic histoacryl obliteration vs propranolol in the prevention of esophagogastric variceal rebleeding:a randomized trial[J]. Endoscopy,2003,35(9):729-735.
[13] Mishra SR,Chander Sharma B,Kumar A,et al. Endoscopic cyanoacrylate injection versus beta-blocker for secondary prophylaxis of gastric variceal bleed:a randomised controlled trial[J]. Gut,2010,59(6):729-735.
[14] Hung HH,Chang CJ,Hou MC,et al. Efficacy of non-selective βblockers as adjunct to endoscopic prophylactic treatment for gastric variceal bleeding:a randomized controlled trial [J]. J Hepatol,2012,56(5):1025-1032.
[15] Boustière C,Dumas O,Jouffre C,et al. Endoscopic ultrasonography classification of gastric varices in patients with cirrhosis. Comparison with endoscopic findings[J]. J Hepatol,1993,19(2):268-72.
[16] Binmoeller KF,Weilert F,Shah JN,et al. EUS-guided transesophageal treatment of gastric fundal varices with combined coiling and cyanoacrylate glue injection (with videos)[J]. Gastrointest Endosc,2011,74(5):1019-1025.
[17] Romero-Castro R,Ellrichmann M,Ortiz-Moyano C,et al. EUSguided coil versus cyanoacrylate therapy for the treatment of gastric varices:a multicenter study (with videos)[J]. Gastrointest Endosc,2013,78(5):711-721.
[18] McAvoy NC,Plevris JN,Hayes PC. Human thrombin for the treatment of gastric and ectopic varices [J]. World J Gastroenterol,2012,18(41):5912-5917.
[19] Yang Z,Han G,Wu Q,et al. Patency and clinical outcomes of transjugular intrahepatic portosystemic shunt with polytetrafluoroethylenecovered stents versus bare stents:a meta-analysis[J]. J Gastroenterol Hepatol,2010,25(11):1718-1725.
[20] Lo GH,Liang HL,Chen WC,et al. A prospective,randomized controlled trial of transjugular intrahepatic portosystemic shunt versus cyanoacrylate injection in the prevention of gastric variceal rebleeding[J].Endoscopy,2007,39(8):679-685.
[21] Mahadeva S,Bellamy MC,Kessel D,et al. Cost-effectiveness of Nbutyl-2-cyanoacrylate (histoacryl)glue injections versus transjugular intrahepatic portosystemic shunt in the management of acute gastric variceal bleeding [J]. Am J Gastroenterol,2003,98 (12):2688-2693.
[22] Qi X,Jia J,Bai M,et al. Transjugular intrahepatic portosystemic shunt for acute variceal bleeding:a meta-analysis[J]. J Clin Gastroenterol,2015,49(6):495-505.
[23] Kanagawa H,Mima S,Kouyama H,et al. Treatment of gastric fundal varices by balloon-occluded retrograde transvenous obliteration[J]. J Gastroenterol Hepatol,1996,11(1):51-58.
[24] Hiraga N,Aikata H,Takaki S,et al. The long-term outcome of patients with bleeding gastric varices after balloon-occluded retrograde transvenous obliteration [J]. J Gastroenterol,2007,42 (8):663-672.
[25] Akahoshi T,Tomikawa M,Kamori M,et al. Impact of balloon-occluded retrograde transvenous obliteration on management of isolated fundal gastric variceal bleeding[J]. Hepatol Res,2012,42(4):385-393.
[26] Sabri SS,Swee W,Turba UC,et al. Bleeding gastric varices obliteration with balloon-occluded retrograde transvenous obliteration using sodium tetradecyl sulfate foam[J]. J Vasc Interv Radiol,2011,22(3):309-316,quiz 316.
[27] Ninoi T,Nakamura K,Kaminou T,et al. TIPS versus transcatheter sclerotherapy for gastric varices[J]. AJR Am J Roentgenol,2004,183(2):369-376.
[28] Saad WE,Al-Osaimi AM,Caldwell SH. Pre-and post-balloon-occluded retrograde transvenous obliteration clinical evaluation,management,and imaging:indications,management protocols,and followup[J]. Tech Vasc Interv Radiol,2012,15(3):165-202.
[29] Saad WE,Wagner CC,Lippert A,et al . Protective value of TIPS against the development of hydrothorax/ascites and upper gastrointestinal bleeding after balloon-occluded retrograde transvenous obliteration(BRTO)[J]. Am J Gastroenterol,2013,108(10):1612-1619.
[30] Qi X,Liu L,Bai M,et al. Transjugular intrahepatic portosystemic shunt in combination with or without variceal embolization for the prevention of variceal rebleeding:a meta-analysis[J]. J Gastroenterol Hepatol,2014,29(4):688-696.

