小干扰RNA 沉默IKK/NF-κB 信号通路对HSC-T6 细胞增殖的影响
张彦亮,吴会玲,宋 爽,岳巧艳,申玉英,陶 臻
南京医科大学附属南京医院感染科,江苏 南京210006
肝纤维化是各种慢性肝病所共有的病理特征过程,虽病因不同,但其共同途径均是肝星状细胞(hepatic stellate cell,HSC)的激活和增殖[1],如能抑制肝纤维化效应细胞HSC 的增殖,则可阻滞肝脏的纤维化进程,甚至实现其病理过程的逆转。多个研究显示核因子κB(nucler factor-kappaB,NF-κB)在激活的HSC中活性明显增强[2-3],本研究采用siRNA 干扰技术,沉默肝星状细胞株HSC-T6 IKK/NF-κB 信号通路,研究其对HSC 活化增殖的影响,为实现肝纤维化逆转治疗提供理论和实验依据。
1 材料与方法
1.1 细胞 大鼠肝星状细胞株HSC-T6 购自南京凯基生物科技发展有限公司。
1.2 主要试剂及器材 脂质体Lipofectamine 2000、TRIzol 购自美国Invitrogen 公司;RPMI-164 购自美国Gibco 公司;DMSO(溶解Formazan 结晶)购自中国上海久亿化学试剂有限公司、cDNA 第一链合成试剂盒及Taq DNA Polymerase 均购自美国Thermo Fisher 公司;Penicillin/streptomycin solution、0.25% Tripsin-EDTA、PBS 均购自南京凯基生物科技发展有限公司。
1.3 方法
1.3.1 细胞培养:将液氮中的冻存管取出缓慢溶解,接着进行细胞复苏和细胞传代,使细胞密度达1×106~1 ×107个/ml;按每管1 ~1.5 ml 的量分装于冻存管内,拧紧管盖,在冻存管上做好标记,包括细胞代号及冻存日期,进行逐步降温将细胞冻存。
1.3.2 设计、构建、合成siRNA:通过NCBI 的Gen-Bank 数据库搜索IKKβ 的cDNA 序列,按照siRNA 设计原则设计IKKβ siRNA,RT-PCR 检测siRNA 表达对IKKβ 的基因表达(RNA 由上海吉玛制药技术有限公司合成,引物由南京金斯瑞科技有限公司合成)。siRNA-1014:S 5'-CCCUCGAUGACAUCUUGAAUU-3';AS 3'-UUGGGAGCUACUGUAGAACUU-5'。
1.3.3 转染siRNA:转染接种适当数量的细胞至细胞培养板中,每孔加入不含抗生素的培养基,使转染时的细胞密度能够达到50% ~60%;用250 μl 不含血清培养基Opti-MEM 稀释20 μmol/L 的贮存液轻轻混匀,室温孵育5 min;用250 μl 不含血清培养基Opti-MEM 稀释5 μl lipo2000,轻轻混匀并室温孵育5 min;将两者轻轻混匀,室温孵育20 min;将siRNA-lipo2000 混合液加入含有细胞的500 μl 培养基的培养孔中,轻轻混匀培养4 ~6 h 后,将孔中含siRNA-lipo2000 混合液的培养基移去,更换新鲜培养基置于37 ℃的CO2培养箱中培养。
1.3.4 MTT 法检测细胞增殖:将细胞消化、计数,配制成浓度为5 ×104个/ml 的细胞悬液,96 孔细胞培养板中每孔加入100 μl 细胞悬液,空白对照组、阴性对照组及实验组均设6 个复孔,siRNA 转染,将培养板置于37 ℃,5% CO2培养箱中分别培养24、48、72 h 后,进行MTT 染色,λ =490 nm,测定OD 值,计算各组抑制率:抑制率(%)= (对照组- 实验组)/对照组×100%。
1.3.5 流式细胞仪检测细胞周期:将对数生长期的细胞消化接种到6 孔板中,次日待细胞贴壁后,根据组别设置加入相应的含药培养基,同时设立阴性对照组。siRNA 转染作用24、48、72 h 后,用0.25%的胰酶(不含EDTA)消化并洗涤离心后收集5 ×105个细胞;再将制备好的单细胞悬液用体积分数为70%乙醇固定2 h,4 ℃保存,染色前用PBS 洗去固定液加100 μl RNase A 37 ℃水浴30 min,再加入400 μl PI 染色混匀,4 ℃避光30 min 后上BD 流式细胞仪测试,记录激发波长488 nm 处红色荧光。
1.4 统计学处理 采用SPSS 19.0 软件进行统计分析。计量资料用±s 表示,多组间比较采用单因素方差分析,两组间比较采用t 检验。P <0.05为差异有统计学意义。
2 结果
2.1 细胞形态学改变 倒置显微镜观察细胞形态,空白对照组和阴性对照组HSC-T6 细胞呈梭形,生长良好,IKKβ siRNA 作用48 h 后实验组细胞增殖受到抑制,细胞生长缓慢,单位视野细胞数较空白对照组、阴性对照组减少,细胞形态呈球形、椭圆形改变,胞核有浓聚表现。
2.2 MTT 检测细胞增殖 三组在24 h 时细胞增殖情况比较,差异无统计学意义(F =0.95,P >0.05);而在48 h 时实验组HSC-T6 细胞增殖受到明显抑制,抑制率达24%,较空白对照及阴性对照组明显降低(F =8.95,P <0. 05);72 h 时实验组细胞增殖抑制率达44%,抑制效应更为明显(F=18.75,P <0.01,见表1)。

表1 MTT 检测细胞增殖Tab 1 Cell proliferation detected by MTT
2.3 流式细胞仪检测HSC-T6 细胞周期 IKKβ siRNA 干预24、48、72 h 后实验组G0/G1期的细胞百分比显著升高,与空白对照组和阴性对照组比较,差异均有统计学意义(F=9.45,P <0.05);实验组72 h 组G0/G1期的细胞百分比显著高于48 h 和24 h 组,差异有统计学意义(F=12.76,P <0.05,见图1、表2)。
3 讨论
肝纤维化是各种慢性肝病向肝硬化发展的必经阶段,研究表明不同病因肝纤维化发生最终共同途径是HSC 的激活[4]。激活的HSC 大量增殖合成过多的胶原和细胞外基质(extracellular matrix,ECM),导致肝内ECM 过量积聚,胶原沉积,最终导致肝纤维化和肝硬化形成。HSC 不仅是肝脏炎症过程的靶细胞,更是炎症的效应细胞,因此针对HSC 来防治肝纤维化已成为肝病领域新的研究热点。
NF-κB 是转录因子家族的重要成员,参与多种炎症性细胞因子、趋化因子和促纤维形成细胞因子的合成、细胞增殖、细胞外间质交联、细胞凋亡及成纤维细胞的分化过程[5]。而在肝病领域的研究显示NF-κB在激活的HSC 中活性明显增强,与HSC 的激活增殖密切相关。NF-κB 作为炎症反应最为重要的转录因子,能够调控枯否细胞分泌多种细胞因子及促炎介质,放大肝脏炎症损伤反应,从而促进HSC 的激活增殖[6]。
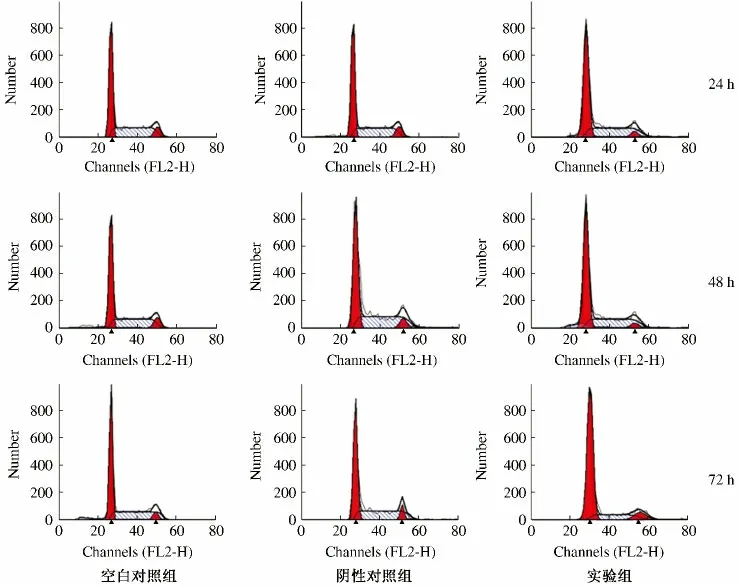
图1 PI 单染法检测细胞周期Fig 1 Cell cycle performed by PI single staining method
表2 流式细胞仪检测细胞周期(±s,%)Tab 2 Cell cycle performed by flow cytometry (±s,%)

表2 流式细胞仪检测细胞周期(±s,%)Tab 2 Cell cycle performed by flow cytometry (±s,%)
注:G0 =静止期细胞的百分数;G1 =DNA 合成前期细胞的百分数;G0/G1 =停留于G0/G1 期(无增殖活动期)细胞的百分数;S=DNA 合成期细胞的百分数;M =DNA 分裂细胞的百分数;G2 =DNA 合成后期细胞的百分数。与实验组相比,* P <0.05;与72 h 组相比,#P <0.05。
分组 G0/G1 S G 2空白对照组24 h 49.10 ±0.265* 43.27 ±0.127 7.70 ±0.078 48 h 50.45 ±0.075* 41.65 ±0.095 7.76 ±0.132 72 h 51.06 ±0.074* 43.40 ±0.080 5.43 ±0.046阴性对照组24 h 50.33 ±0.043* 41.35 ±0.049 8.28 ±0.035 48 h 51.44 ±0.053* 43.10 ±0.046 5.45 ±0.035 72 h 52.04 ±0.067* 41.80 ±0.125 6.17 ±0.092实验组24 h 54.72 ±0.112# 40.49 ±0.046 4.69 ±0.045 48 h 59.59 ±0.122# 36.72 ±0.051 3.73 ±0.045 72 h 72.46 ±0.080 23.52 ±0.035 4.04 ±0.127
在经典的IKK/NF-κB 信号通路中,蛋白激酶IKK复合体(IκB 激酶)是NF-κB 信号通路的主要调节物[7]。它由三个亚基组成:催化亚基IKKα、IKKβ 和调节亚基IKKγ,其中IKKβ 在经典的NF-κB 信号通路活化过程中发挥尤为重要的作用。将鼠的IKKβ 基因敲除后,胚胎时期就会死亡,并会由于肝细胞发生凋亡而表现出肝脏退化病变,这与p65 基因敲除鼠的表型很相近,而且在外界因子(如TNF)的刺激下,IKKβ 基因敲除鼠的NF-κB 活化受到严重抑制,可见IKKβ 是NF-κB 活化所必需的亚基。
本研究通过设计构建合成siRNA 抑制HSC-T6 细胞中IKKβ 基因表达,使得与NF-κB 紧密结合的抑制蛋白IκB 无法磷酸化,从而沉默IKK/NF-κB 信号通路,观察HSC-T6 细胞增殖情况,结果显示实验组细胞培养48、72 h 后,细胞增殖明显受到抑制,细胞形态呈球形及椭圆形改变、胞核浓聚等表现。MTT 法显示与空白对照组和阴性对照组相比,实验组细胞增殖明显受到抑制,且随着IKKβ siRNA 作用时间的延长,增殖抑制效应更为明显,结果进一步证实了IKK/NF-κB 信号通路参与了HSC 激活增殖的过程,是肝纤维化发生至关重要的信号通路之一,通过干扰沉默此信号通路能显著抑制HSC 的活化和增殖。
同时我们还研究了HSC-T6 细胞周期的变化,结果显示沉默IKK/NF-κB 信号通路后,G0/G1期细胞数量的百分比显著升高,与空白对照组和阴性对照组比较,差异均有统计学意义,同时IKKβ siRNA 作用72 h组,G0/G1期的细胞百分比最高,与24 h 和48 h 组相比,也存在显著性差异。以往的研究[8]显示细胞周期有2 个突发性的转折点:G1-S 及G2-M,当G0/G1期细胞数量增多,S 期与G2/M 期细胞数量减少意味着细胞增殖周期受到阻滞,细胞有丝分裂水平降低。因此我们认为siRNA 沉默IKK/NF-κB 信号通路对于细胞周期的G1-S 重要转折点具有调控作用是其抑制HSC细胞活化增殖的关键所在。
总之,肝纤维化的发生、发展是一个极其复杂的过程,HSC 在肝纤维化的病理过程中扮演着最为重要的角色,是肝纤维化形成的细胞学基础。本研究结果表明,利用siRNA 沉默IKK/NF-κB 信号通路对HSC 增殖具有明显的抑制作用,为今后临床肝纤维化基因治疗提供了新的方法。
[1] Puche JE,Saiman Y,Friedman SL. Hepatic stellate cells and liver fibrosis[J]. Compr Physiol,2013,3(4):1473-1492.
[2] Robinson SM,Mann DA. Role of nuclear factor kappaB in liver health and disease[J]. Clin Sci (Lond),2010,118(12):691-705.
[3] Luedde T,Schwabe RF. NF-kB in the liver--linking injury,fibrosis and hepatocellular carcinoma [J]. Nat Rev Gastroenterol Hepatol,2011,8(2):108-118.
[4] Povero D,Busletta C,Novo E,et al. Liver fibrosis:a dynamic and potentially reversible process[J]. Histol Histopathol,2010,25(8):1075-1091.
[5] Gilmore TD. Introduction to NF-kappaB:players,pathways,perspectives[J]. Oncogene,2006,25(51):6680-6684.
[6] Elsharkawy AM,Wright MC,Hay RT,et al. Persistent activation of nuclear factor-kappaB in cultured rat hepatic stellate cells involves the induction of potentially novel Rel-like factors and prolonged changes in the expression of IkappaB family proteins[J]. Hepatology,1999,30(3):761-769.
[7] Schmid JA,Birbach A. IkappaB kinase beta (IKKbeta/IKK2/IKBKB)--a key molecule in signaling to the transcription factor NF-kappaB[J]. Cytokine Growth Factor Rev,2008,19(2):157-165.
[8] Morgan DO. The cell cycle:principles of control[M]. Li CJ,Pan FY,Dai G,et al. Beijing:Science Press Ltd,2010:17-18.D.O.摩尔根.细胞周期调控原理[M]. 李朝军,潘飞燕,戴谷,等译.北京:科学出版社,2010:17-18.

