聚氰基丙烯酸正丁酯荧光纳米微球的制备及其在小鼠体内分布情况研究
李春梅,张 林,侯艳红,李 楠
1.解放军第309 医院消化科,北京100091;2.河北北方学院
α-氰基丙烯酸正丁酯(butylcyanoacrylate,BCA)早期主要用做医用胶、组织粘合剂、医用材料等,具有组织、血液、免疫等生物兼容性。随着研究的深入,发现利用聚合反应制备的聚氰基丙烯酸正丁酯纳米粒子(polybutylcyanoacrylate nanoparticles,PBCA-NPs)可吸附、包裹药物,不但对药物有靶向传输功能,还能起到缓释作用,从而提高药物的疗效并减少对机体的毒副作用,因此在生物医学领域中具有更为广泛的应用前景。前期国内已有学者对PBCA-NPs 在生物体内的分布情况进行了研究,发现静脉用药后主要分布于肝、肺、脾等组织[1-2]。大多学者[3-4]通过检测药物在各组织中的浓度来确定载药纳米粒子的组织分布情况,最近,部分研究者[5-7]通过活体成像的方法观察纳米粒子在体内代谢。而不同粒径PBCA-NPs 对器官组织分布情况的影响及在组织中代谢速度的研究相对匮乏。以上情况均提示本研究的必要性和可行性。
吲哚菁绿(indocyanine green,ICG)是目前被美国食品药品管理局(FDA)批准的用于医疗临床使用的花青染料,广泛应用于光动力治疗[8]、生物医学成像[9]、肿瘤检测[10]及脑血管毒性评价[11]等方面。本研究中利用ICG 在近红外光谱范围内的较强吸收和荧光特性将其包埋于PBCA-NPs,从而实现纳米粒子生物体内的显像示踪,并成功制备出不同纳米粒径的ICG-PBCA-NPs,就PBCA-NPs 纳米粒径对于其生物体内组织中的分布及代谢影响进行研究。从而为纳米粒子靶向运输的临床应用提供有效支持。
1 材料与方法
1.1 材料 α-氰基丙烯酸正丁酯(BCA,北京瞬康医用胶有限公司);吲哚菁绿(ICG,上海晶纯生化科技股份有限公司);Dextran70(德国BASF 公司);ICG-PBCA-NPs(自制,含量:0.5 mg/ml);抗荧光淬灭封片液(P0126,碧云天生物技术研究所);其他试剂为国产分析纯。实验仪器包括85-2 恒温加热磁力搅拌器(上海志威电器有限公司);微孔滤膜(欣惠泽奥有限公司),IX71 荧光显微镜(日本Olympus 公司);RF-5301PC 荧光分光光度计(日本岛津公司)。健康雄性昆明小鼠体质量(28 ±3)g,由中国人民解放军309 医院结核研究所动物实验室提供。
1.2 实验方法
1.2.1 ICG-PBCA-NPs 的制备:通过控制乳化聚合过程中的温度、pH 值、搅拌速度、稳定剂及原料的用量等条件制备粒径为20、50、100、150、200 nm 左右的ICGPBCA-NPs。取BCA 适量溶解于丙酮中作为有机相(溶液Ⅱ);将Dextran70 及ICG 用蒸馏水溶解后作为水相(溶液Ⅰ),并用0.1 mol/L 的HCl 调pH 值。室温条件下一定转速磁力搅拌,按一定比例将有机相缓缓加入水相中,继续磁力搅拌3 h 至有机溶剂挥尽,用0.1 mol/L NaOH 水溶液调节体系的pH=7.0,继续搅拌0.5 h,利用微孔滤膜过滤溶液后低温静置,即可得到乳白色ICG-PBCA-NPs 微球胶体溶液。
1.2.2 ICG 于各组织中浓度测量:ICG 2 mg 溶于0.1 mol/L PBS 2 ml 中配成1 000 μg/ml ICG 标准原液,以PBS为溶剂配制ICG 梯度稀释液,选择805 nm 波长进行荧光定量实验,以ICG 浓度为横坐标,A 值为纵坐标,绘制ICG 溶液的标准曲线。取昆明种小鼠随机分为6组:(25.0 ±7. 6)nm ICG-PBCA-NPs 组(第1 组);(49.0 ±8.6)nm ICG-PBCA-NPs 组(第2 组);(88.0 ±20.5)nm ICG-PBCA-NPs 组(第3 组);(145.0 ±13.5)nm ICG-PBCA-NPs 组(第4 组);(205. 0 ± 8. 4)nm ICG-PBCA-NPs 组(第5 组);空白对照组(第6 组)。1 ~5 组每只小鼠分别注射ICG-PBCA-NPs 溶液(10 mg/kg),空白组注射等量生理盐水,均经尾静脉注射。分别于注射0.5、1、5、12 h 后行颈椎脱臼各处死3 只小鼠,取心、肝、脾、肾、胰等脏器,于组织匀浆器制成组织匀浆,4 ℃过夜,离心(8 000 r/min,10 min,离心半径10 cm),应用荧光分光光度计测定ICG 的A 值,根据ICG 溶液的标准曲线计算出各脏器中含ICG 的量。将每组3 只平行动物所对应的ICG 的量取均值。1.2.3 荧光纳米粒子于小鼠体内的荧光显像:将以上每组分别于注射0.5、1、5、12 h 后分离得到的心、肝、脾、肾、胰用生理盐水洗净后用滤纸吸干多余水分,各组织切成1 cm×1 cm×0.3 cm 大小的组织块,迅速放入液氮中冷冻保存。将冰冻组织装于切片机固定器上夹紧进行切片,将组织切片贴于载玻片用P0126 封片,置于倒置荧光显微镜下观察组织荧光微球分布情况,并拍照记录。
2 结果
2.1 乳化聚合法合成荧光纳米粒子 通过乳化聚合法在去离子水中制备ICG-PBCA-NPs。调控制作过程中pH 值、搅拌速度、Dextran70 质量浓度、α-氰基丙烯酸正丁酯质量浓度,成功制得(25.0 ±7.6)nm、(49.0 ±8.6)nm、(88.0±20.5)nm、(145.0±13.5)nm、(205.0±8.4)nm 5 种粒径ICG-PBCA-NPs。避光室温条件下保存2 ~3个月,用蒸馏水溶解后可见纳米粒子具有较好的分散性,其形态、大小基本没有变化。
2.2 荧光纳米粒子在小鼠体内的分布及代谢
2.2.1 ICG 于各组织中浓度测量:ICG 溶液的标准曲线如图1 所示。对应的标准曲线方程为:y =1.0365x +0.7219,R2= 0.9957(x 代表ICG 浓度,y 代表吸光度,R 为精确度)。根据各组织中ICG 的A 值计算出组织中ICG 的量。第6 组于波长805 nm 下测量的各脏器荧光强度结果均非常弱,因此暂将其对ICG 的荧光结果造成的干扰忽略。(25.0 ±7.6)nm ICG-PBCA-NPs组于小鼠各组织器官中均未见明显分布。肝、脾是ICG-PBCA-NPs 的主要聚集脏器,肝脏、脾脏于纳米粒径为(145.0 ±13.5)nm 时荧光强度最强,但随着ICGPBCA-NPs 纳米粒径的减小,其于肝、脾中的荧光强度减弱。随着纳米粒子粒径的减少,在肾脏荧光强度略有增强,但变化不明显。心脏于各纳米粒径各时间点ICG-PBCA-NPs 分布均较少或无。胰腺组织中荧光浓度随着纳米粒子粒径的减小逐渐增强,于(49. 0 ±8.6)nm 组注射1 h 出现最高浓度,并且各时段胰腺组织荧光强度于(49.0 ±8.6)nm 粒子组明显强于(88.0±20.5)nm、(145.0 ±13.5)nm、(205.0 ±8.4)nm 组。心、肝、脾、肾、胰腺于各组出现的最强荧光浓度绘制成折线图,如图2 所示。

图1 ICG 浓度与A 值的标准曲线Fig 1 The standard curve of ICG concentration and A value
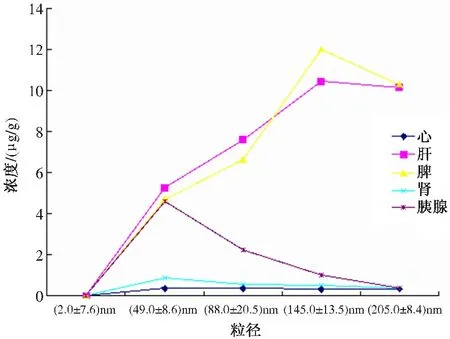
图2 小鼠各脏器在不同粒径下的最强浓度曲线Fig 2 The strongest fluorescence distribution of different diameter nanoparticles in mice
2.2.2 荧光纳米粒子于小鼠体内的荧光显像:分别于0.5、1、5、12 h 将各组小鼠解剖,采集心、肝、脾、肾、胰等器官组织制作冰冻切片,在荧光显微镜下观察并采集图像。其结果与ICG 于各组织中浓度测量结果基本吻合。荧光显微镜下获得的心、肝、脾、肾、胰所对应的最强荧光如图3 所示。

图3 荧光显微镜下心、肝、脾、肾、胰最强荧光图(400 ×) A:心脏最强荧光图;B:肝脏最强荧光图;C:脾脏最强荧光图;D:肾脏最强荧光图;E:胰腺最强荧光图Fig 3 The strongest fluorescences of heart,liver,spleen,kidney and pancreas under the fluorescencemicroscope (400 ×) A:the strongest fluorescence in heart;B:the strongest fluorescence in liver;C:the strongest fluorescence in spleen;D:the strongestfluorescence in kidney;E:the strongest fluorescence in pancreas
3 讨论
聚氰基丙烯酸正丁酯是一种无毒、分子量小、生物相容性较好、可生物降解的高分子纳米材料。本实验采用氰基丙烯酸正丁酯为聚合单体,通过乳化聚合法制备可生物降解的PBCA-NPs,并将ICG 包载其中达到成功荧光显像作用。鉴于水中OH-可引发BCA 单体之间发生亲核反应而聚合,因此,通过调节pH 值可以调控氰基丙烯酸酯的聚合,另外制作过程中搅拌速度、相关原料比例的改变均会影响聚氰基丙烯酸正丁酯纳米粒子的外观形态、粒径大小、分散性等。我们在制作过程中通过调控pH 值、搅拌速度、相关原料比例、稳定剂类型成功制备出不同粒径ICG-PBCA-NPs,其中粒径最小的纳米粒子是(25.0 ±7.6)nm。最终将不同粒径的纳米粒子按照分组通过尾静脉注射于小鼠体内,在不同时间点处死小鼠,解剖小鼠取其心、肝、脾、肾、胰腺组织各脏器于组织匀浆器中制成组织匀浆,离心后利用分光光度计测定各组织中荧光强度;同时于对应时间点将各脏器制作冰冻切片并获得荧光图片,观察不同粒径ICG-PBCA-NPs 于不同时间点在小鼠体内各重要脏器代谢过程。将直观观察和荧光强度量化结合起来综合评估不同粒径PBCA-NPs 在各组织中的分布情况。
实验结果显示不同粒径纳米粒子在不同组织分布明显不同,大粒径主要于肝、脾组织聚集,随着粒径减小,纳米粒子体内重新分布,在肝、脾分布减少,而胰腺、肾脏的分布略增多,心脏分布增加不明显。肝脏、脾脏最具靶向性的纳米粒径为(145.0 ±13.5)nm,因其较其他各组在肝脏组织的荧光强度均强。这与粒径为100 ~200 nm 时易被网状内皮系统(RES)的巨噬细胞内吞转运至Kupffer 细胞,从而在肝、脾等部位明显聚集的研究结果相吻合[1]。而胰腺中(49.0 ±8.6)nm组其荧光强度明显强于其他粒径在胰腺中的分布,说明(49.0 ±8.6)nm 可能是胰腺最适粒径大小。这可能与<100 nm 的粒子可逃脱RES 的识别,在体内实现重新分布,且粒径<50 nm 时纳米粒可以穿过肝脏,从而使得PBCA-NPs 于其他器官组织中分布增多有关[12]。(25.0 ±7.6)nm 组在各组织中的荧光强度均较弱或几乎没有,这可能是因为纳米粒子粒径越小网状内皮吞噬系统越难识别,同时由于粒径太小易透过肾小球基膜而使药物过快地清除,而有相关报道认为<(48. 0 ±9. 2)nm 组的微粒可进入骨髓,且粒径越小越容易进入骨髓[13],还需我们进一步实验加以验证。纳米粒径的大小不但影响ICGPBCA-NPs 在小鼠体内的分布,还影响其代谢时间。肝脏、脾脏于(49.0 ±8.6)nm 组最强荧光发生的时间(1 h)明显早于(88.0 ±20.5)nm、(145.0 ±13.5)nm 组、(205.0 ±8.4)nm 组(5 h),说明随着纳米粒子减小,其在小鼠体内停留时间相对缩短。以上研究结果与我国学者申方良等[2]的研究结果基本吻合。他们就阿霉素聚氰基丙烯酸正丁酯纳米粒粒径与肝靶向性的关系进行研究,应用高效液相色谱法测定纳米粒子粒径大小对小鼠体内肝、脾、心、肺、肾组织、血浆内阿霉素浓度的影响。结果发现不同粒径在以上组织均有分布。我们的实验结果不但呼应于以上研究,还检测了该粒子是否能分布于胰腺组织。对于纳米粒子用于胰腺癌的药物治疗有重要意义。
然而本研究尚有明显不足,如在样本量选择上相对较少,增加样本量后实验结果会更具说服力。另外,时间点的选取、粒径分布的细化、组织类型的增加均有利于实验的完善,以上均是我们接下来的研究工作中需要解决的问题。Patra 等[14]将表皮生长因子受体(epidermal growth factor receptor,EGFR)标记于载药纳米粒子表面,通过体内、体外实验验证其靶向治疗胰腺癌作用。Valetti 等[15]将CKAAKN 肽与载吉西他滨纳米粒子相结合,利用CKAAKN 肽胰腺癌高识别性,从而对胰腺癌起到靶向治疗作用。在以上研究基础上,结合本实验得出的胰腺组织的最适纳米粒径为(49.0 ±8.6)nm,设想将具有胰腺癌靶向标志物标记于最适粒径PBCA-NPs 纳米粒子表面,利用其对胰腺癌的特异性识别作用增强其与胰腺组织特异性识别,在此双重作用下实现胰腺相关疾病特异无毒高效治疗作用,将是一个有前途的研究方向。
综上所述,利用不同粒径PBCA-NPs 的组织分布及代谢特征,结合其可生物降解性及生物相容性高等特点,将其应用于临床研究治疗将对未来医学领域的进步产生巨大影响。
[1] Shen LF,Zhang YD,Shen HJ,et al. Liver targeting and the delayed drug release of the nanoparticles of adriamycin polybutylcyanoacrylate in mice[J]. Chin Med J (Engl),2006,119(15):1287-1293.
[2] Shen LF,Wang X,Wang C,et al. Effect of diameter of adriamycin polybutylcyanoacrylate nanoparticles on liver targeting[J]. J Cent South Univ (Med Sci),2006,31(5):732-736,741.申良方,王欣,王骋,等. 阿霉素聚氰基丙烯酸正丁酯纳米粒粒径对肝靶向性的影响[J]. 中南大学学报(医学版),2006,31(5):732-736,741.
[3] Ambruosi A,Khalansky AS,Yamamoto H,et al. Biodistribution of polysorbate 80-coated doxorubicin-loaded[14C]-poly(butyl cyanoacrylate)nanoparticles after intravenous administration to glioblastomabearing rats[J]. J Drug Target,2006,14(2):97-105.
[4] Xu N,Gu J,Zhu Y,et al. Efficacy of intravenous amphotericin B-polybutylcyanoacrylate nanoparticles against cryptococcal meningitis in mice[J]. Int J Nanomedicine,2011,6:905-913.
[5] Pu K,Shuhendler AJ,Jokerst JV,et al. Semiconducting polymer nanoparticles as photoacoustic molecular imaging probes in living mice[J].Nat Nanotechnol,2014,9(3):233-239.
[6] Karmani L,Labar D,Valembois V,et al. Antibody-functionalized nanoparticles for imaging cancer:influence of conjugation to gold nanoparticles on the biodistribution of 89Zr-labeled cetuximab in mice[J].Contrast Media Mol Imaging,2013,8(5):402-408.
[7] Navarro FP,Mittler F,Berger M,et al. Cell tolerability and biodistribution in mice of indocyanine green-loaded lipid nanoparticles[J]. J Biomed Nanotechnol,2012,8(4):594-604.
[8] Tsujimoto H,Morimoto Y,Takahata R,et al. Photodynamic therapy using nanoparticle loaded with indocyanine green for experimental peritoneal dissemination of gastric cancer [J]. Cancer Sci,2014,105(12):1626-1630.
[9] Wang H,Liu C,Gong X,et al. In vivo photoacoustic molecular imaging of breast carcinoma with folate receptor-targeted indocyanine green nanoprobes[J]. Nanoscale,2014,6(23):14270-14279.
[10] Yamamoto S,Maeda N,Yoshimura K,et al. Intraoperative detection of sentinel lymph nodes in breast cancer patients using ultrasonography-guided direct indocyanine green dye-marking by real-time virtual sonography constructed with three-dimensional computed tomographylymphography[J]. Breast,2013,22(5):933-937.
[11] Keller E,Ishihara H,Nadler A,et al. Evaluation of brain toxicity following near infrared light exposure after indocyanine green dye injection[J]. J NeurosciMethods,2002,117(1):23-31.
[12] Foster KA,Yazdanian M,Audus KL. Microparticulate uptake mechanisms of in-vitro cell culture models of the respiratory epithelium[J].J Pharm Pharmacol,2001,53(1):57-66
[13] Wang W,Tetley L,Uchegbu IF. The level of Hydrophobic substitution and the molecular weight of amphiphilic Poly-L-lysine-based polymers strongly affects their assembly into polymeric bilayer vesicles[J]. J Colloid Interface Sci,2001,237(2):200-207
[14] Patra CR,Bhattacharya R,Wang E,et al. Targeted delivery of gemcitabine to pancreatic adenocarcinoma using cetuximab as a targeting agent[J]. Cancer Res,2008,68(6):1970-1978
[15] Valetti S,Maione F,Mura S,et al. Peptide-functionalized nanoparticles for selective targeting of pancreatic tumor [J]. J Control Release,2014,192(1):29-39

