肝癌射频消融术后MRI表现及疗效
MRI Features and Efficacy Analysis After Radiofrequency Ablation of Hepatic Carcinoma
邓满红 DENG Manhong姚德惠 YAO Dehui李 婧 LI Jing黄丽玲 HUANG Liling邹光辉 ZOU Guanghui
肝癌射频消融术后MRI表现及疗效
MRI Features and Efficacy Analysis After Radiofrequency Ablation of Hepatic Carcinoma
邓满红 DENG Manhong
姚德惠 YAO Dehui
李 婧 LI Jing
黄丽玲 HUANG Liling
邹光辉 ZOU Guanghui
作者单位福建医科大学附属三明第一医院CT室 福建三明 365000
目的经皮穿刺射频消融(RFA)广泛应用于肝癌的治疗,本研究分析肝癌RFA术后的MRI表现及疗效,以提高肿瘤的完全消融率。资料与方法回顾性分析79例(共114个病灶)肝癌患者经皮RFA术后的MRI表现,包括RFA术后1个月、4个月及7个月的病灶大小、信号变化及强化情况;分析术后消融灶两种不同MRI T1WI高信号环表现及肿瘤局部复发率。结果肝癌RFA术后1个月病灶周边在T1WI呈高信号,T2WI呈稍低信号,病灶范围较前稍增大,增强扫描病灶周围呈薄层均匀环形强化,中心区无强化;术后4个月病灶大小相对稳定,病灶周围强化减弱;术后7个月病灶范围较术前缩小,病灶未见明显强化。肝癌复发者,消融灶T1WI高信号环不完整,不完整区增强扫描动脉期呈结节状强化,延时期大部分呈稍低信号,呈“快进快出”的强化特点。T1WI高信号环完整组与不完整组术后7个月复发率分别为6.12%、43.75%,差异有统计学意义(P<0.05)。T1WI高信号环完整组总生存率及无瘤生存率均较T1WI高信号环不完整组高,差异有统计学意义(P<0.05)。结论肝癌经皮穿刺RFA术后的MRI检查具有特征性的表现,通过T1WI高信号环的完整性及动态增强扫描的表现能早期提示肝癌RFA术后的疗效,指导临床尽早选择治疗方案。
肝肿瘤;导管消融术;磁共振成像;治疗结果
原发性肝癌是最常见的恶性肿瘤之一,其在世界范围内居恶性肿瘤的第5位[1],全球每年约60万人死于肝癌[2]。早期首选治疗方法为手术切除,晚期治疗方法主要有碘油栓塞、化疗、生物治疗和物理治疗。目前,在超声、CT或MRI引导下经皮穿刺射频消融(radiofrequency ablation,RFA)是治疗肝癌的最新方法之一[3]。RFA是一种物理消融方法,其利用高频电流(>10 kHz)使活体中组织离子随电流变化的方向振动、摩擦产生热量,从而引起组织凝固性坏死,具有微创、安全性高、副作用少、可重复操作等优点,为部分不能手术或不愿意手术的患者提供了有效的替代治疗方法,是目前治疗原发性肝癌的有效方法[4]。在影像评估中,MRI具有很好的组织分辨力及敏感度,能较准确地显示肝癌RFA术后的病理变化,广泛应用于RFA术后的随访及疗效评估,以提高肝癌的治愈率。
1 资料与方法
1.1 研究对象 回顾性纳入2009年6月—2012年6月福建医科大学附属三明第一医院经影像学和实验室检查确诊为原发性肝癌、RFA术后复查的79例原发性肝癌患者(共114个病灶),其中男53例,女26例;年龄43~79岁,平均(58.4±9.8)岁;发病部位:单发54例,多发25例;术前病灶最大直径为(2.6±0.7)cm。
1.2 仪器与方法 采用Siemens 1.5T超导型MRI扫描仪行平扫和动态增强扫描,体部表面线圈。患者检查前常规禁食、禁水6 h以上。扫描前进行严格呼吸训练,扫描时嘱患者屏气。平扫序列为横断位T1WI和T2WI,扩散加权成像(DWI)。扫描参数:T1WI采用SE序列,TR 109 ms,TE 4.76 ms,矩阵 384×512,视野(FOV)263 mm×350 mm;T2WI采用快速自旋回波序列,TR 1500 ms,TE 100 ms,矩阵480×640,FOV 263 mm×350 mm;T2WI轴位脂肪抑制序列,TR 1500 ms,TE 100 ms,矩阵 480×640,FOV 263 mm×350 mm。必要时行冠状位扫描。增强扫描采用高压注射器经肘静脉以2 ml/s团注对比剂钆喷酸葡胺注射液,剂量为0.15 mmol/kg;采用三维容积内插快速扰相GRE T1WI (VIBE)行三期动态扫描,分别在注射对比剂后22~23 s、50~60 s、3~4 min行动脉期、门静脉期和平衡期动态扫描[5];层厚3~5 mm,无间隔。
1.3 图像分析 由1名副主任医师和1名主治医师分析图像,并将一致意见作为评价结果。根据治疗后1个月、4个月及7个月将肝癌RFA术后的图像分成3组,观察病灶的大小变化、T1WI高信号环的完整性及病灶的强化情况。根据肝癌RFA术后1个月T1WI高信号环的完整性将图像分成T1WI高信号环完整组和T1WI高信号环不完整组,比较两组无瘤生存率及总生存率。病灶复发标准:AFP值升高、病灶局部结节状增大并呈“快进快出”的强化方式、MRI DWI呈高信号。
1.4 统计学方法 采用SPSS 13.0软件,无疾病进展及总生存采用KM法进行分析,用Graphpad PRISM 6.0绘制曲线。T1WI高信号环完整组和T1WI高信号环不完整组复发情况比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 MRI表现 术后扫描RFA区可见完整环形T1WI高信号改变(图1),术后1个月复查绝大部分病灶较术前增大;而在术后7个月,病灶大部分缩小,在114个病灶中,仅16个病灶增大(图2)。肝癌RFA术后1个月、4个月、7个月病灶大小变化情况见表1。病灶复发者表现为稍长T1、长T2改变,DWI呈高信号,增强扫描可见结节样强化。
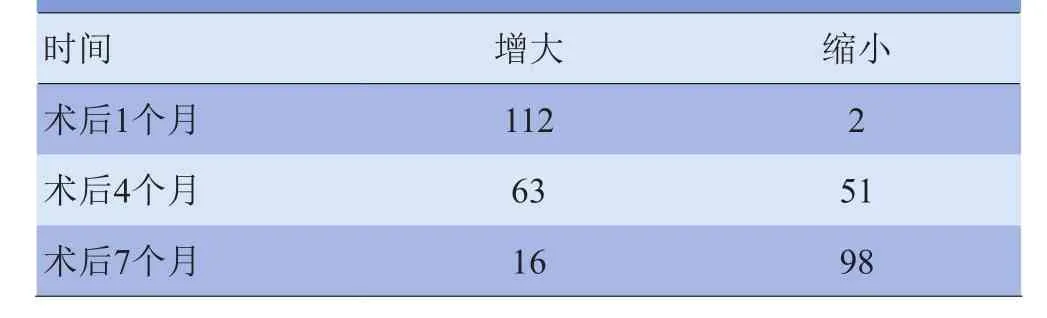
表1 79例患者114个病灶RFA治疗后不同时间病灶大小变化(个)
2.2 术后7个月后复发情况 术后1个月T1WI高信号环完整组有98个病灶,术后7个月有6个病灶复发,复发率为6.12%;T1WI高信号环不完整组有16个病灶(图3),其中7个病灶在术后7个月复发,复发率为43.75%。两者差异有统计学意义(χ2=19.275,P<0.05),见表2。
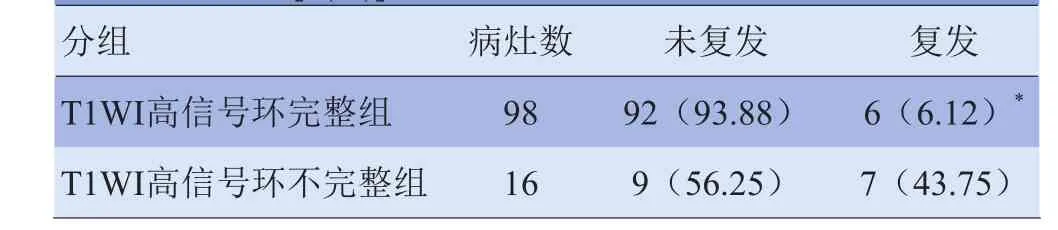
表2 79例患者术后1个月T1WI高信号环完整情况及术后7个月复发情况[n(%)]
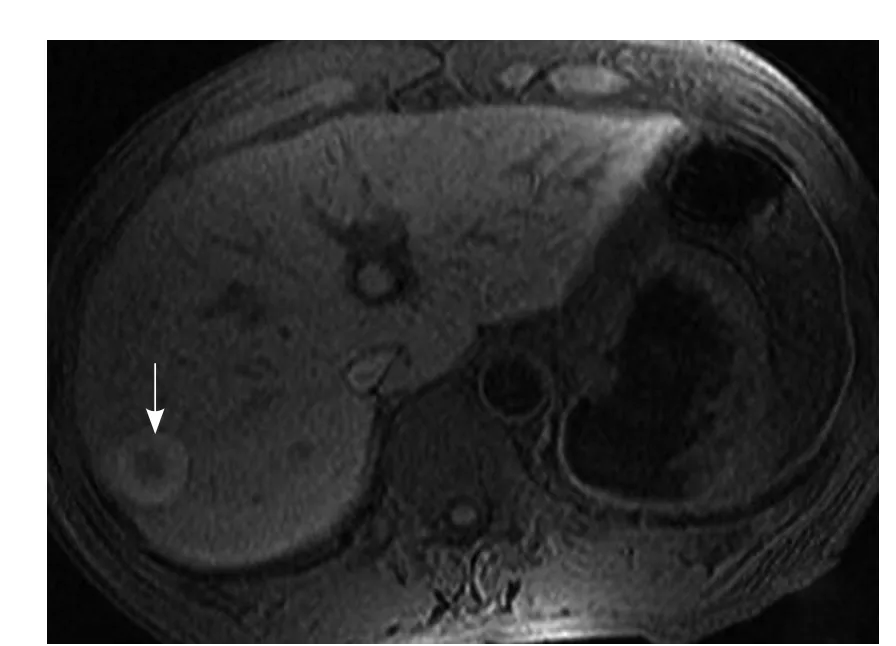
图1 男,62岁,原发性肝癌。肝右叶病灶RFA治疗后,表现为环形T1WI高信号环完整(箭)
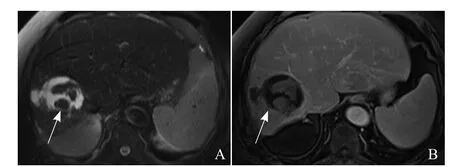
图2 男,77岁,原发性肝癌。肝右叶病灶RFA后病灶扩大,胆脂瘤形成,T2WI示病灶大部分为高信号(箭,A);T1WI增强扫描,病灶未见明显强化(箭,B)
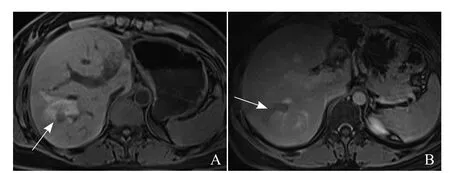
图3 女,42岁,原发性肝癌,肝右叶病灶RFA治疗后7个月病灶复发。术后1个月T1WI高信号环不完整,后缘出现缺口(箭,A);术后7个月缺口处复发,呈明显强化(箭,B)
2.3 T1WI高信号环完整组与不完整组无疾病进展与总生存比较 70例患者完成随访,平均中位随访时间27.6个月。T1WI高信号环完整组中位无疾病进展为12个月相对危险:0.37(95% CI:0.177~0.770),而T1WI高信号环不完整患者无疾病进展为6个月相对危险:2.71(95% CI:1.298~5.650),差异有统计学意义(P<0.05)。T1WI高信号环完整组中位总生存为17个月相对危险:0.43(95% CI:0.194~0.944),而T1WI高信号环不完整组无疾病进展为9个月相对危险:2.34 (95% CI:1.060~5.145),差异有统计学意义(P<0.05)。见图4。
3 讨论
RFA作为一种微创治疗手段,目前已广泛应用于小肝癌的非手术治疗,长期随访表明,RFA可以延长患者的存活期[6-7]。由于MRI显示病灶较为直观,而且组织分辨力及敏感度高达89%,在RFA治疗后的疗效评估及随访中被广泛应用[8]。
本研究在术后1、4、7个月对患者进行间隔复查,在RFA术后1个月显示112个病灶增大,主要原因是消融区范围大于病灶本身,标准的消融范围应该超出病灶周边0.5 cm。MRI表现为病灶周边呈环形T1WI高信号改变,病理基础为高温损伤导致细胞脱水,发生凝固性坏死[9],而病灶区的信号较为混杂,因其内可以为液化坏死、凝固性坏死、胆汁淤积、出血以及少许气泡等[10],此时增强扫描病灶区无强化,DWI无高信号改变。而术后7个月复查时,98个病灶缩小,凝固坏死组织吸收,出血和气泡完全吸收,增强扫描部分病灶可见环形薄层强化,强化原因为病灶周边血管炎症反应及肉芽组织增生[11-12],强化环的厚度<1 mm。16个病灶术后7个月增大,除肿瘤复发增大外,部分病灶为并发胆脂瘤形成或并发脓肿。
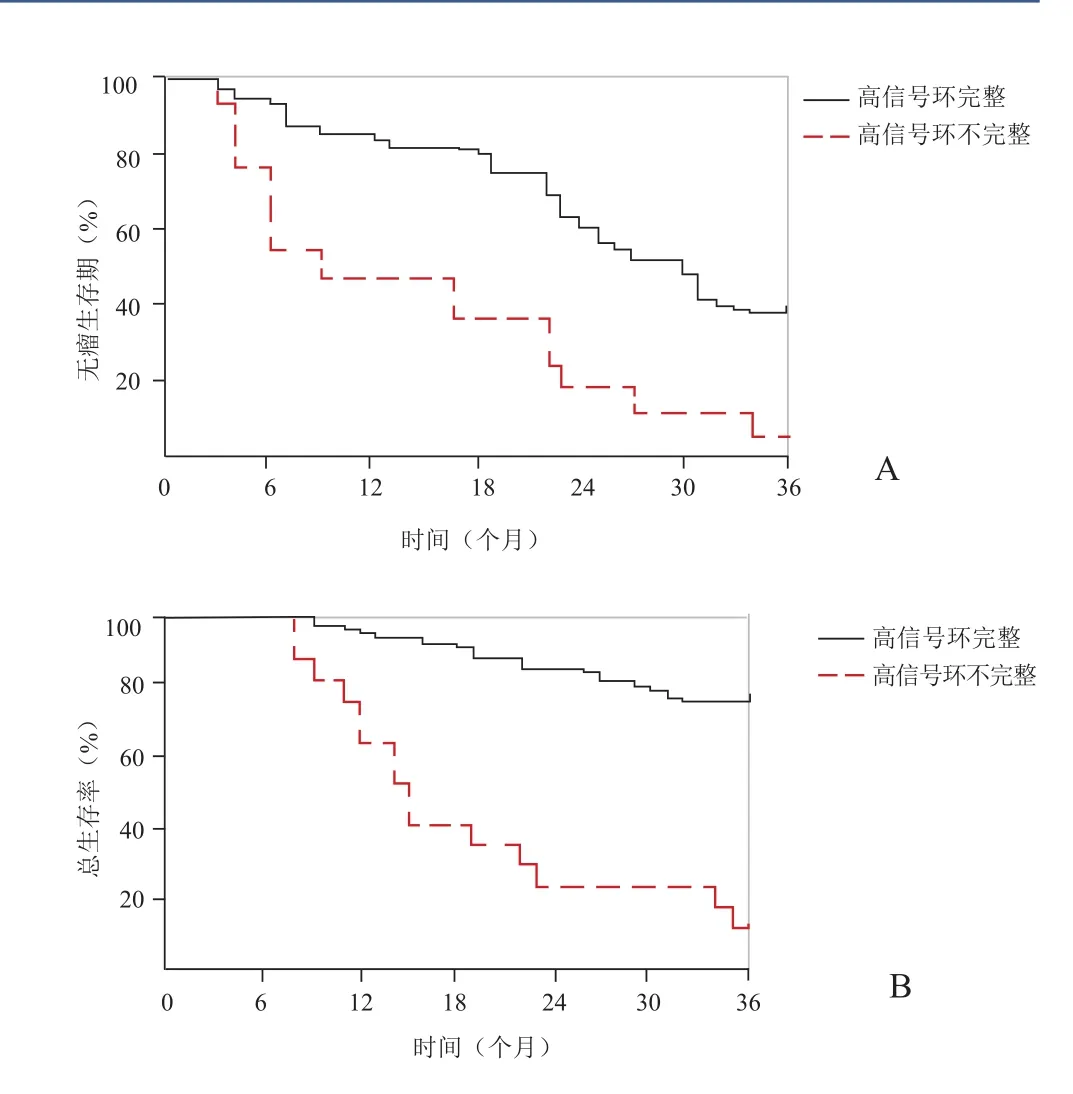
图4 T1WI高信号环完整组与不完整组无瘤生存率(A)及总生存率(B)比较
本研究发现,在RFA治疗后的随访中,肿瘤的复发与T1WI高信号环的完整性密切相关。在T1WI高信号环不完整的7个复发病灶中,复发部分均发生在T1WI高信号环的缺口处,说明该处肿瘤组织灭活不彻底或肿瘤残留,MRI表现为RFA区边缘呈不规则的结节影,呈稍长T1、长T2信号改变,DWI呈高信号,MRI增强扫描显示大部分为“快进快出”的典型表现。而T1WI高信号环完整的病灶复发率则较低,其中部分复发者不排除为原病灶外的新增病灶,即原病灶已完全消融,而在周围组织再发生恶变结节并累及消融区,造成复发的假象。通过两种不同MRI T1WI高信号环表现无瘤生存率及总生存率比较,T1WI高信号环完整组与T1WI高信号环不完整组差异有统计学意义。
曲蕾等[13]认为部分复发病灶表现为“快进慢出”,即在门静脉期和延迟期仍明显强化,与典型原发性肝癌表现不同,可能与静脉受损导致回流受阻有关。本研究2个复发病灶增强扫描亦表现为持续强化,与该机制有关。“热沉降”效应是造成RFA术后复发的主要原因之一[14-15],病灶位于较大血管区时,由于血流带走部分温度,导致该区域病灶的消融针温度降低,以至于肿瘤病灶坏死不彻底。本研究中有3个复发病灶位于较大肝血管分支区域,复发机制应与“热沉降”效应有关。另一个复发的原因是病灶消融不完全,主要原因为消融区未覆盖整个病灶,导致部分病灶残留。
本研究的主要对象为小肝癌,虽然通过RFA治疗小肝癌能取得很好的疗效,但临床上仍有部分直径>5 cm的肝癌应用RFA治疗。目前RFA治疗的最大有效直径为7 cm,对于无法手术的大肝癌是一种很好的治疗手段。今后亟需研究大肝癌RFA治疗后的MRI表现及疗效,部分大肝癌需要多次RFA治疗,研究大肝癌RFA术后的MRI表现可以很好地引导临床进行有效治疗,提高大肝癌的治愈率。
总之,MRI对评价RFA治疗后效果有重要的作用,MRI随访不仅可以观察病灶大小的变化,还能发现术后是否并发胆脂瘤和感染情况。通过T1WI高信号环的完整性及动态增强扫描,能及时评估肿瘤是否复发,并及早发现肿瘤复发情况,在复发早期再行RFA治疗,可以明显提高肿瘤的治愈率。
[1]Lencioni R,Crocetti L. Image-guided thermal ablation of hepatocellular carcinoma. Crit Rev Oncol Hematol,2008,66(3): 200-207.
[2]Oliveri RS,Wetterslev J,Gluud C. Transarterial (chemo) embolisation for unresectable hepatocellulat carcinoma. Cochrane Database Syst Rev,2011,16(3): CD004787.
[3]许乙凯,全显跃. 肝胆胰脾影像诊断学. 北京: 人民卫生出版社,2006: 254.
[4]Lencioni R,Crocetti L,Pina MC,et al. Percutaneous imageguided radiofrequency ablation of liver tumors. Abdom Imaging,2009,34(5): 547-556.
[5]杨正汉,冯逢,王霄英. 磁共振成像技术指南. 北京: 人民军医出版社,2007: 667-668.
[6]Garrean S,Hering J,Saied A,et al. Radiofrequency ablation of primary and metastatic liver tumors: a critical review of the literature. Am J Surg,2008,195(4): 508-520.
[7]Ng KK,Poon RT,Lo CM,et al. Analysis of recurrence pattern and its influence on survival outcome after radiofrequency ablation of hepatocellular carcinoma. J Gastrointest Surg,2008,12(1): 183-191.
[8]Eisele RM,Schumacher G,Lopez-Hänninen E,et al. Role of B-mode ultrasound screening in detection of local tumor recurrence in the first year after radiofrequency ablation in the liver. Cancer Detect Prev,2007,31(4): 316-322.
[9]Dromain C,De Baere T,Elias D,et al. Hepatic tumors treated with percutaneous radio-frequency ablation: CT and MR imaging follow-up. Radiology,2002,223(1): 255-262.
[10]饶圣祥,曾蒙苏,陈财忠,等. 原发性肝细胞癌射频消融治疗后MR 动态随访研究. 中华放射学杂志,2010,44(12): 1244-1247.
[11]Assumpcao L,Choti M,Pawlik TM,et al. Functional MR imaging as a new paradigm for image guidance. Abdom Imaging,2009,34(6): 675-685.
[12]Schraml C,Clasen S,Schwenzer NF,et al. Diagnostic performance of contrast-enhanced computed tomography in the immediate assessment of radiofrequency ablation success in colorectal liver metastases. Abdom Imaging,2008,33(6): 643-651.
[13]曲蕾,陈晓飞,王淑艳,等. 小肝癌射频消融治疗后早期MR表现. 医学影像学杂志,2014,24(8): 1327-1329.
[14]De Jong G,Hendriks T,Franssen G,et al. Adjuvant radioimmunotherapy after radiofrequency ablation of colorectal liver metastases in an experimental model. Eur J Surg Oncol,2011,37(3): 258-264.
[15]Orlacchio A,Bolacchi F,Salimbeni C,et al. Heat sink during radiofrequency ablation of a hepatocellular carcinoma abutting a large hepatic cystic lesion. J Vasc Interv Radiol,2011,22(4): 572-575.
(本文编辑 冯 婕)
PurposeWith the extensive use of percutaneous radiofrequency ablation (RFA) for the treatment of hepatic carcinoma (HC),the study of MRI findings and its clinical significance after RFA of HC have important value and can improve the complete ablation rate.Materials and MethodsA retrospective analysis of post-procedure MRI findings of 79 patients (114 lesions) with HC were performed,the size of the lesion,the signal changes and enhancement condition were observed at the first,fourth and seventh month after RFA; the two different findings of high signal ring on MRI T1WI and local recurrence rate were analyzed.ResultsOne month after RFA,peripheral region of RFA lesion showed high signal on T1WI,and slightly lower signal on T2WI,the size of lesions was slightly larger than pre-procedure,enhancement scan showed the thin homogeneous ring enhanced around the non-enhanced lesions; 4 months later,the size of lesions were relative stable and the periphery enhancement was weaken; 7 months later,the size of lesions were reduced and showed no enhancement. For recurrence lesions,the high signal ring was incomplete on TIWI,the incomplete area showed nodular enhancement on the arterial phase,and most of nodule showed slightly lower signal on the delay phase demonstrated a feature of "quick wash-in and wash-out"; 7 months after RFA,recurrence rate was 6.12% in patients with complete high signal ring and 43.75% in patients with incomplete high signal ring,the difference was statistically significant (P<0.05). The total survival rate and accumulated survival rate of the patients with complete high signal ring on T1WI were higher than the patients with incomplete ring,the difference was statistically significant (P<0.05).ConclusionThere are characteristic findings of MRI examination of liver cancer after percutaneous RFA,observation of the integrity of high signal ring on T1WI image and finding of dynamic enhancement scan can early evaluate efficacy of RFA guide the selection of treatment plan.
Liver neoplasms; Catheter ablation; Magnetic resonance imaging; Treatment outcome
10.3969/j.issn.1005-5185.2015.12.019
姚德惠
Department of CT Room,Affiliated Sanming First Hospital of Fujian Medical University,Sanming 365000,China
Address Correspondence to: YAO Dehui E-mail: win_008188@sina.com
R445.2;R735.7
2015-08-18
修回日期:2015-10-16
中国医学影像学杂志2015年第23卷12期:951-954
Chinese Journal of Medical Imaging 2015 Volume 23(12): 951-954

