老年人糖耐量受损相关痛性周围神经病的临床特征及危险因素
老年人糖耐量受损相关痛性周围神经病的临床特征及危险因素
叶励超蔡若蔚黄银辉1林若庭陈雅芳
(福建医科大学附属第二医院神经内科,福建泉州362000)
摘要〔〕目的分析老年人糖耐量受损(IGF)相关痛性周围神经病的临床特征与危险因素,以利于早期诊断和治疗。方法选取年龄>60岁,Leeds神经病理性疼痛评分>12分,IGT相关痛性周围神经病患者60例(IGT组),2型糖尿病痛性周围神经病患者70例(DM组),正常对照组60例,分别比较三组的临床特征与相关危险因素。结果IGT相关痛性周围神经病多数表现为烧灼样、针刺样、电击样或麻木样疼痛,部分为自发性痛或触摸痛;疼痛部位以双侧对称性肢体远端常见,其次为单神经分布区。与正常对照组比较,IGT组患者双侧跟腱反射消失、大足趾振动觉减退、腓肠神经传导异常、皮肤交感反应异常的比例较高(P<0.05),在其他方面差异无统计学意义(P>0.05);与DM组比较,IGT组的患者双侧跟腱反射消失、大足趾振动觉减退、腓肠神经传导异常的比例较低(P<0.05),在其他方面差异无统计学意义(P>0.05)。经Logistic多因素回归分析,结果显示肥胖、血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇水平升高是IGT相关痛性周围神经病的危险因素。结论老年人IGT相关痛性周围神经病的重要特点是符合周围神经分布的异常疼痛,以远端对称性感觉或运动性多神经病变常见,其次是单神经病变,常有跟腱反射消失与大足趾振动觉减退等神经系统体征,腓肠神经传导速度减慢、皮肤交感反应异常是早期电生理指标。肥胖、血清甘油三酯、总胆固醇与低密度脂蛋白胆固醇水平升高是影响IGT相关痛性周围神经病的危险因素。
关键词〔〕糖耐量受损;糖尿病;痛性周围神经病
中图分类号〔〕R587;R745〔文献标识码〕A〔
1晋江市医院神经内科
第一作者:叶励超(1973-),男,硕士,副主任医师,主要从事周围神经病和脑血管病的相关研究。
痛性周围神经病(PPN)是以神经病理性疼痛为突出表现的周围神经病变,糖代谢异常是重要的病因之一。几乎所有的非胰岛素依赖型糖尿病在发病前都要经过糖耐量受损(IGT)阶段,糖耐量异常能够导致周围神经病变,包括PPN〔1〕。由于医务人员的忽视和认识不足,许多IGT相关PPN的老年患者未得到正确的诊断和治疗。疼痛不仅严重影响老年人的生活质量,也大大增加社会的负担。本文分析老年IGT患者并发PPN的临床特征和危险因素。
1资料与方法
1.1纳入标准选取2012年1月至2014年11月于本院神经内科确诊为PPN的IGT或2型糖尿病患者,年龄>60岁,Leeds神经病理性疼痛评分>12分。IGT诊断标准:空腹血糖<6.1 mmol/L,75 g葡萄糖口服负荷试验(OGTT)后2 h血糖≥7.8 mmol/L,但<11.1 mmol/L;PPN诊断符合2012年中华医学会神经病学分会修订的痛性周围神经病的诊断和治疗共识〔2〕。糖尿病周围神经病与糖尿病前期周围神经病诊断参照2010年美国糖尿病学会推荐糖尿病周围神经病定义与诊断标准〔3〕。本研究获得医院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2排除标准慢性炎性脱髓鞘性多发性神经根周围神经病、营养缺乏、中毒、异常球蛋白血症、肝功能不全、肾功能不全、甲状腺功能减退、恶性肿瘤、结缔组织病、感染性疾病以及遗传病等。
1.3研究对象共募集IGT相关PPN患者60例(IGT组),年龄(68.47±2.78)岁,男30例,女30例;2型糖尿病PPN患者70例(DM组),年龄(68.83±3.06)岁,男32例,女38例;正常对照组60例,年龄(67.57±3.73)岁,男28例,女32例。三组在年龄和性别差异无统计学意义。
1.4方法所有对象检测空腹血糖、75 g葡萄糖口服负荷试验后2 h血糖、糖化血红蛋白(HbA1c)、肝功能、肾功能、血脂全套、肌电图(神经传导速度测定、皮肤交感反应)以及Leeds神经病理性疼痛评价表。
1.5统计学方法应用SPSS17.0软件进行t和χ2检验,多因素分析采用多元Logistic回归分析。
2结果
2.1IGT与2型糖尿病相关PPN疼痛特点比较IGT组与DM患者大多表现为烧灼样、针刺样、电击样、麻木或钻凿样疼痛,部分表现为自发性疼痛或触摸痛。
2.2IGT与2型糖尿病相关PPN疼痛部位分布IGT与DM组PPN疼痛部位包括双侧对称性肢体远端疼痛和不对称性单神经疼痛,皆以双侧对称性远端病变为主,见表1。
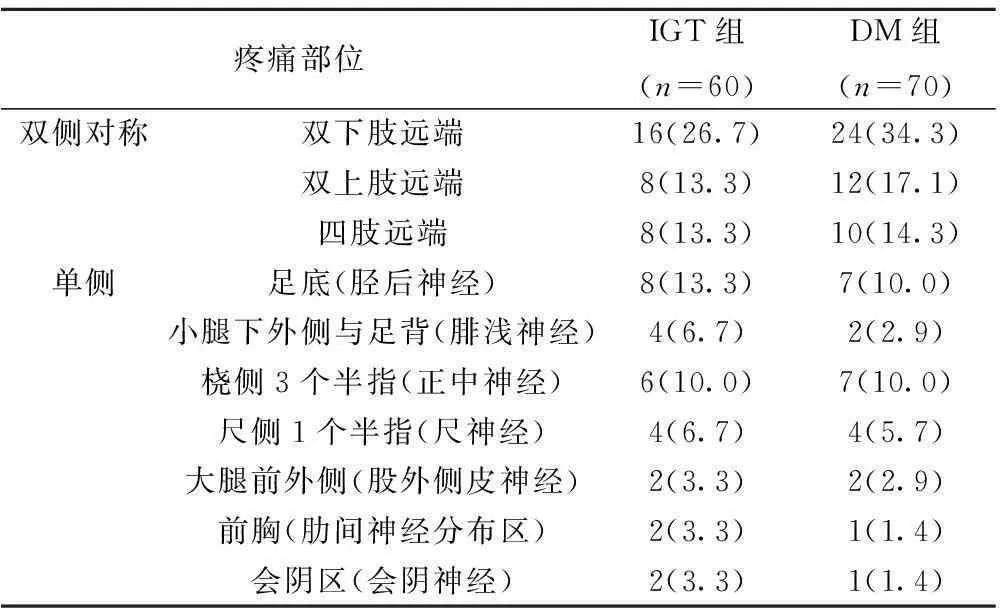
表1 IGT与2型糖尿病相关PPN部位分布〔 n(%)〕
2.3各组临床体征与肌电图比较与正常对照组比较,IGT组患者双侧跟腱反射消失、大足趾振动觉减退、腓肠神经传导异常、皮肤交感反应异常的比例较高,在其他方面差异无统计学意义;与DM组比较,IGT组患者双侧跟腱反射消失、大足趾振动觉减退、腓肠神经传导异常的比例较低,在其他方面差异无统计学意义,见表2。

表2 各组临床体征与肌电图比较〔 n(%)〕
与IGT组比较:1)P<0.05,下表同
2.4各组危险因素比较与正常对照组比较,IGT组患者肥胖的比例高,血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、HbA1c、尿酸水平较高,高密度脂蛋白胆固醇(HDL-C)水平较低,在其他方面差异无统计学意义;DM组与IGT组比较,DM组的患者HbA1c水平较高,在其他方面差异无统计学意义,见表3。
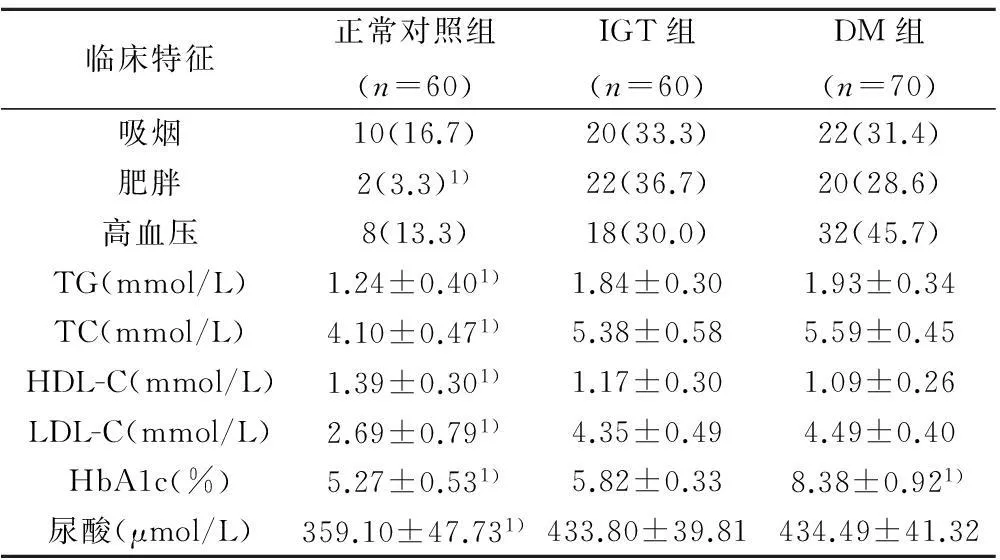
表3 各组危险因素比较
2.5IGT相关PPN的危险因素以表3中观测的指标为自变量,IGT与正常对照组为因变量,做多因素Logistic模型,剔除无意义的自变量,筛选出IGT相关PPN的危险因素。经Logistic多因素回归分析,结果显示肥胖、血清TG、TC与LDL-C水平升高是IGT相关PPN的危险因素,见表4。

表4 IGT相关PPN病危险因素的Logistic回归分析
3讨论
PPN是糖尿病周围神经病变之一,以疼痛为主要表现,属于神经病理性疼痛的一种,与无痛性神经病变相比,其更加影响患者的身心健康和生活质量。流行病学研究显示2型糖尿病并发周围神经病变的风险开始于IGT、空腹血糖受损等糖尿病早期阶段,但是老年人常常没有意识到〔4,5〕。周围神经病的发生率在IGT人群为13%,介于糖尿病组(28%)和正常对照组(7.4%)之间,IGT人群中PPN的发生率8.7%,正常对照组仅为1.2%〔6〕。IGT患者空腹血糖正常,仅餐后血糖水平异常升高,但未达到糖尿病诊断标准,很容易被漏诊。由于缺乏对IGT继发PPN的认识,以及老年人基础疾病多、糖尿病前期症状隐匿、不易察觉,因此,许多患者早期得不到正确的诊断和治疗。
PPN指痛性感觉周围神经病以及伴有疼痛症状的感觉运动周围神经病,病变主要累及小或无髓神经纤维(C类纤维),可伴有或不伴有大纤维的病变。疼痛包括自发性疼痛与诱发性疼痛,前者指持续或间歇出现的刺痛、跳痛、酸痛、触痛、电击痛、痉挛样疼痛、烧灼样痛、撕裂样痛等;后者指感觉过敏、感觉倒错、感觉过度、感觉异常等〔7〕。本组IGT患者描述疼痛常用以下几个形容词,如烧灼感、针刺感、电击样、麻木、钻凿或肿胀感,由此患者产生恶心、恐惧感或残酷的被折磨感,与2型糖尿病基本一致,可能因为二者疼痛的病理生理机制基本相同。
在疼痛部位分布上,本组IGT患者大多表现为双侧对称性肢体远端疼痛,属于感觉性多神经病。而典型的痛性糖尿病周围神经病以对称性感觉运动性多神经病常见,下肢重于上肢,远端重于近端,属于长度依赖性多神经病。部分IGT患者表现为单神经痛,如正中神经损害所致腕管综合征、胫后神经损害所致跖管综合征、尺神经损害所致肘管综合征以及腓浅神经、股外侧皮神经分布区疼痛,提示由于代谢异常、微循环障碍和嵌压等因素影响,IGT与糖尿病患者同样容易出现局部神经嵌压损害〔8,9〕。此外,IGT患者还可能出现腰骶神经痛(会阴神经痛)、胸神经痛(肋间神经痛)等多种单神经痛。总之,IGT相关PPN的重要特点是符合周围神经分布的异常疼痛,这也是临床诊断的重要线索之一。
典型糖尿病感觉运动性多神经病以对称性肢体远端麻木,感觉异常或疼痛为主要特征,体检显示手套/袜套样感觉缺失,足趾震动觉和本体觉受损,跟腱反射减弱或消失,下肢力弱或肌肉萎缩,此时诊断不困难。尽管糖尿病前期患者没有上述典型临床表现,但是本研究发现,IGT并发PPN患者双侧跟腱反射消失、大足趾振动觉减退的比例明显升高,糖尿病阶段上述现象更加明显。这提示即使在糖尿病前期IGT阶段,下肢神经有髓大纤维也可能受损,符合长度依赖性周围神经病。跟腱反射消失、大足趾振动觉减退是糖尿病前期周围神经病的一个良好标志。因此,临床上怀疑IGT相关PPN的患者,不能忽视跟腱反射和下肢深感觉的检查,这也是美国糖尿病学会推荐筛查糖尿病周围神经病的重要体检内容〔10〕。
典型的糖尿病感觉运动性多神经病累及大小神经纤维,如果电生理检查证实存在神经传导异常,那么可以明显提高诊断准确性。但是常规运动或感觉神经传导速度测定主要反映大的有髓神经纤维变化,并非诊断PPN的特异手段。学者证实2型糖尿病前期或者早期相关周围神经病主要累及感觉小纤维〔11〕。小纤维神经病是PPN的一个亚型,累及直径较小的有髓或无髓纤维,导致疼痛,因为这些患者大神经纤维一般不受累,常规神经电生理检查无法发现异常,需皮肤活检或感觉神经定量检查明确。但是本研究发现部分IGT相关PPN患者存在正中神经、尺神经或腓肠神经等有髓大纤维损害,提示下肢腓肠神经传导速度减慢是IGT继发神经损害的早期电生理指标。IGT患者也可能并发自主神经损害,增加心血管病风险〔12〕。皮肤交感反应是人体接受刺激后诱发汗腺同步活动出现的皮肤反射性电位,是交感神经传出纤维的冲动所致,主要检测小纤维特别是C类无髓纤维的电生理特点,是客观评价自主神经系统功能的检测方法之一。本研究结果提示IGT期存在自主神经损害,皮肤交感反应异常是一个重要的电生理指标。对于C类无髓神经纤维检测,感觉定量检查比神经传导速度检查更敏感,但是缺乏定位功能。皮肤活检也是小纤维神经病的一项敏感和可靠诊断方法,其采用免疫染色对皮肤内C类无髓神经纤维进行定量检测(皮肤内神经纤维密度),纵向研究显示在2型糖尿病前期或者早期,在大的有髓神经纤维异常出现之前就可见C类纤维的异常〔13,14〕。因为多种因素限制,有条件开展皮肤活检的机构并不多。
痛性糖尿病周围神经病、糖尿病前期周围神经病的发生机制复杂,涉及高血糖诱导氧化应激增加、内皮功能失调、蛋白激酶C与多元醇途径活化,导致神经元代谢异常和DNA损害,炎症和葡萄糖代谢终末产物对于疼痛的发生也很关键〔15,16〕。研究显示不仅代谢综合征,而且代谢综合征的组成部分,如高血压,肥胖,HDL-C水平下降以及高TG血症等也与糖尿病神经病变相关〔17,18〕。本研究显示仅肥胖、TG、TC与LDL-C水平升高是IGT相关PPN的危险因素。控制代谢综合征和相关危险因素是糖尿病与糖尿病前期周围神经病变的治疗策略之一〔19〕。
4参考文献
1Papanas N,Ziegler D.Prediabetic neuropathy:does it exist〔J〕?Curr Diabet Rep,2012;12(4):376-83.
2中华医学会神经病学分会肌电图与临床神经电生理学组,中华医学会神经病学分会神经肌肉病学组.痛性周围神经病的诊断和治疗共识〔J〕.中华神经科杂志,2012;45(11):824-7.
3Tesfaye S,Boulton AJ,Dyck PJ,etal.Diabetic neuropathies:update on definitions,diagnostic criteria,estimation of severity and treatments〔J〕.Diabetes Care,2010;33(10):2285-93.
4Bongaerts BW,Rathmann W,Heier M,etal.Older subjects with diabetes and prediabetes are frequently unaware of having distal sensorimotor polyneuropathy:the KORA F4 study〔J〕.Diabet Care,2013;36(5):1141-6.
5Papanas N,Vinik AI,Ziegler D.Neuropathy in prediabetes:does the clock start ticking early〔J〕?Nat Rev Endocrinol,2011;7(11):682-90.
6Ziegler D,Rathmann W,Dickhaus T,etal.Neuropathic pain in diabetes,prediabetes and normal glucose tolerance:the MONICA/KORA augsburg surveys S2 and S3〔J〕.Pain Med,2009;10(2):393-400.
7Treede RD,Jensen TS,Campbell JN,etal.Neuropathic pain:redefinition and a grading system for clinical and research purposes〔J〕.Neurology,2008;70(18):1630-5.
8Plastino M,Fava A,Carmela C,etal.Insulin resistance increases risk of carpal tunnel syndrome:a case-control study〔J〕.J Peripher Nerv Syst,2011;16(3):186-90.
9Bahrmann A,Zieschang T,Neumann T,etal.Carpal tunnel syndrome in diabetes mellitus〔J〕.Med Klin(Munich),2010;105(3):150-4.
10American Diabetes Association.Standards of medical care in diabetes-2013〔J〕.Diabetes Care,2013;36(1):S11-66.
11Divisova S,Vlckova E,Hnojcikova M,etal.Prediabetes/early diabetes-associated neuropathy predominantly involves sensory small fibres〔J〕.J Peripher Nerv Syst,2012;17(3):341-50.
12Putz Z,Tabák AG,Tóth N,etal.Noninvasive evaluation of neural impairment in subjects with impaired glucose tolerance〔J〕.Diabet Care,2009;32(1):181-3.
13Myers MI,Peltier AC,Li J.Evaluating dermal myelinated nerve fibers in skin biopsy〔J〕.Muscle Nerve,2013;47(1):1-11.
14Smith AG,Ramachandran P,Tripp S,etal.Epidermal nerve innervation in impaired glucose tolerance and diabetes-associated neuropathy〔J〕.Neurology,2001;57(9):1701-4.
15Lupachyk S,Watcho P,Obrosov AA,etal.Endoplasmic reticulum stress contributes to prediabetic peripheral neuropathy〔J〕.Exp Neurol,2013;247(3):342-8.
16Sugimoto K,Yasujima M,Yagihashi S.Role of advanced glycation end products in diabetic neuropathy〔J〕.Curr Pharm Des,2008;14(10):953-61.
17Ismail-Beigi F,Craven T,Banerji MA,etal.Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes:an analysis of the ACCORD randomised trial〔J〕.Lancet,2010;376(9739):419-30.
18Van Acker K,Bouhassira D,De Bacquer D,etal.Prevalence and impact on quality of life of peripheral neuropathy with or without neuropathic pain in type 1 and type 2 diabetic patients attending hospital outpatients clinics〔J〕.Diabetes Metab,2009;35(3):206-13.
19Callaghan B,Feldman E.The metabolic syndrome and neuropathy:therapeutic challenges and opportunities〔J〕.Ann Neurol,2013;74(3):397-403.
〔2015-05-06修回〕
(编辑苑云杰/曹梦园)

