AMPK信号通路在高糖诱导肾小管上皮细胞间质转化中的作用
AMPK信号通路在高糖诱导肾小管上皮细胞间质转化中的作用
梁新华李英1张蕾
(新疆医科大学第五附属医院肾内科,新疆乌鲁木齐830011)
摘要〔〕目的探讨AMP激活的蛋白激酶(AMPK)及其下游信号通路分子雷帕霉素靶蛋白(mTOR)与高糖诱导的肾小管上皮细胞间质转化(TEMT)间的关系。方法采用HG-DMEM培养基(含D-葡萄糖的DMEM培养基)、AMPKα亚基特异激活剂AICAR和AMPK特异siRNAs处理肾小管上皮细胞(HK)-2细胞。采用Western印迹检测HK-2细胞中AMPK及其下游信号通路分子mTOR的磷酸化活化水平。采用激光共聚焦实验检测HK-2细胞中与EMT相关的生物标志物α-SMA和E-钙黏蛋白的变化情况。结果同0 mmol/L的D-葡萄糖处理组相比,10、20和30 mmol/L的D-葡萄糖均可显著抑制HK-2细胞中AMPK的磷酸化活化水平,并上调HK-2细胞中mTOR的磷酸化活化水平,且这种作用具有计量依赖性。同时D-葡萄糖可促进HK-2细胞中EMT相关的生物标志物α-SMA的表达,抑制E-钙黏蛋白的表达。 AMPKα亚基特异激活剂处理HK-2细胞可部分抵消促D-葡萄糖处理所致的EMT作用,AMPK特异siRNAs敲低HK-2细胞中AMPK表达后,可抵消AMPKα亚基特异激活剂抑制D-葡萄糖诱导HK-2细胞EMT的作用。结论D-葡萄糖通过抑制AMPK通路,上调AMPK下游mTOR通路,从而促进HK-2细胞EMT作用。
关键词〔〕D-葡萄糖;肾小管上皮细胞;间质转化;腺苷活化蛋白激酶;雷帕霉素靶蛋白
中图分类号〔〕R587.2〔文献标识码〕A〔
1新疆医科大学第五附属医院内分泌科
第一作者:梁新华(1972-),女,副主任医师,主要从事各种原发、继发性肾小球疾病、慢性肾脏病的治疗及腹膜透析研究。
糖尿病肾病(DN)最终可导致终末期肾脏疾病〔1〕。高血糖是引起DN的一个主要因素,诱导的肾小管上皮细胞间质转化(TEMT)加速肾脏纤维化是DN发病的潜在机制之一〔2〕。据报道, AMP激活的蛋白激酶(AMPK)可参与多种细胞功能的调节,包括内皮型一氧化氮合酶活性、血管生成、抑制血管炎症等〔3〕。文献报道,AMPK还具有抑制心脏和肝纤维化的功能〔4〕。哺乳动物雷帕霉素靶蛋白(mTOR)是一种丝/苏氨酸蛋白质激酶,被认为是AMPK下游分子,AMPK通过调控mTOR磷酸化水平进而调控细胞功能。然而,关于AMPK/mTOR通路在高糖诱导的TEMT中的作用还很少有文献报道。本研究主要针对AMPK/mTOR通路在D-葡萄糖诱导肾小管上皮细胞(HK-2)细胞TEMT中所起的作用进行探讨。
1材料与方法
1.1HK-2细胞培养及处理HK-2细胞购自北京协和医学院基础学院细胞中心。细胞培养于含10%胎牛血清(FBS)的DMEM培养基内,37℃、5%CO2及饱和湿度条件下培养。细胞传代至对数生长期开始实验。活化实验中采用含0、10、20和30 mmol/L D-葡萄糖的DMEM培养基及含30 mmol/L D-葡萄糖的DMEM培养基处理HK-2细胞0、6、12 h和24 h。
1.2主要试剂DMEM培养基及FBS购自Gibco公司;CytoBuster 蛋白提取试剂购自Novagen公司;蛋白酶磷酸酶抑制剂购自Thermo公司;AMPK特异siRNAs购自Qiagen公司;p-AMPK、p-mTOR、α-SMA、E-钙黏蛋白和Actin抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的二抗购自北京中杉金桥生物技术有限公司;转染试剂购自Lonza公司。
1.3细胞总蛋白提取实验用细胞以预冷磷酸盐缓冲液(PBS)洗涤2次,400 r/min离心,8 min;弃去PBS,加入1 μl蛋白酶磷酸酶抑制剂和10 μL CytoBuster 蛋白提取试剂,混匀后室温放置15 min;4°C,12 000 r/min 离心15 min;吸取上清部分即细胞总蛋白。
1.4Western印迹上述蛋白经10%十二烷硫酸钠-聚丙烯酰胺(SDS-PAGE)分离胶和5%浓缩胶分离后,采用湿转法转印至聚氟偏乙稀羊滑肌肌动蛋白(PVDF)膜上,PVDF膜以含5%Tris盐酸缓冲液(BSA)的TBST室温封闭2 h,加入p-AMPK、p-mTOR、平滑肌肌劝蛋白(α-SMA)、E-钙黏蛋白和Actin抗体,4℃过夜孵育。第2天以0.1% TBST 洗膜3 次,5 min/次,加入HRP标记山羊抗鼠二抗,室温旋转孵育1 h。以0.1% TBST 洗膜3 次,5 min/次,PVDF膜以Supersignal West Femto HRP敏感化学发光底物对条带进行显色。
1.5免疫荧光实验培养与载破片上的细胞以4%多聚甲醛固定15 min,随后用0.2%Triton X-100进行穿透,用含2%BSA的PBS室温阻断1 h。加入α-SMA、E-钙黏蛋白抗体4℃过夜孵育。第2天洗片后加入异硫氰酸荧光素(FITC)标记的二抗,室温孵育1 h。洗片后采用4,6-联腺-2苯基吲哚(DAPI)复染核。
1.6统计学方法应用SPSS15.0软件进行t检验。
2结果
2.1D-葡萄糖对HK-2细胞中AMPK、mTOR蛋白磷酸化水平的作用随着D-葡萄糖浓度的升高和处理时间的延长,HK-2细胞中AMPK蛋白磷酸化水平逐渐降低。mTOR蛋白磷酸化水平逐渐升高,见图1,图2。
2.2D-葡萄糖对HK-2细胞中α-SMA和E-钙黏蛋白表达的影响D-葡萄糖可促进HK-2细胞中EMT相关的生物标志物α-SMA的表达,并抑制E-钙黏蛋白的表达见图3。

图1 D-葡萄糖对HK-2细胞中AMPK蛋白磷酸化水平的影响

图2 D-葡萄糖对HK-2细胞中mTOR蛋白磷酸化水平的影响
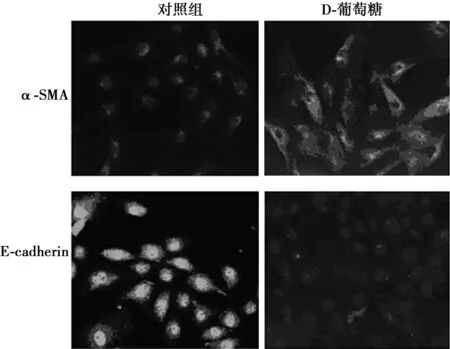
图3 D-葡萄糖对HK-2细胞中α-SMA和 E-钙黏蛋白表达的影响(×400)
2.3AMPKα亚基特异激活剂5-氨基-4甲酰胺咪唑核糖核苷酸(AICAR)和AMPK特异siRNAs对D-葡萄糖诱导HK-2细胞EMT的影响AMPKα亚基特异激活剂处理HK-2细胞后,可部分抵消促D-葡萄糖处理所致的EMT作用,AMPK特异siRNAs敲低HK-2细胞中AMPK表达后,可抵消AMPKα亚基特异激活剂抑制D-葡萄糖诱导HK-2细胞EMT的作用。见图4。
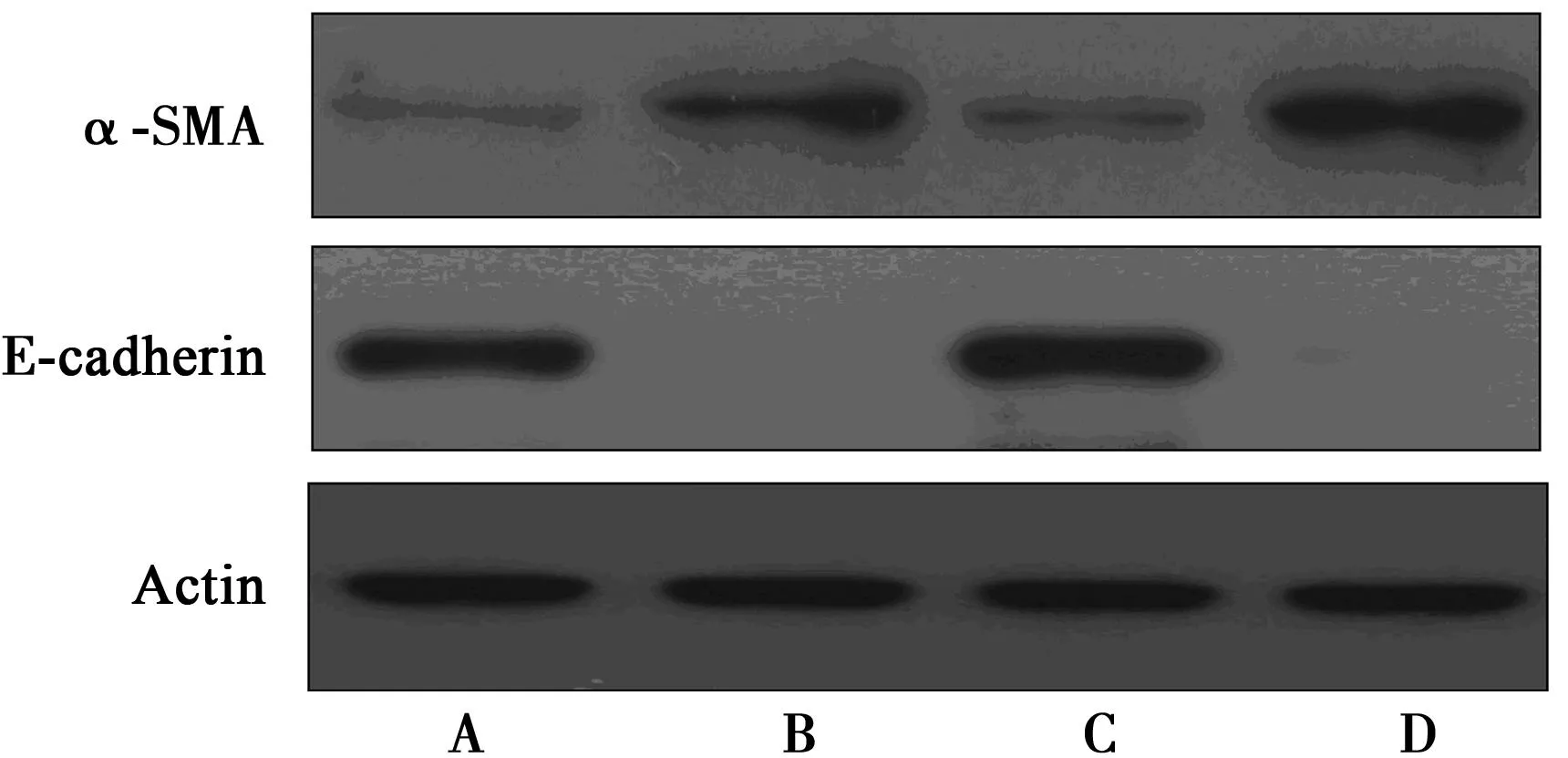
A:对照;B:D-葡萄糖;C:D-葡萄糖+AICAR;D:D-葡萄糖+AICAR+siRNA 图4 AMPKα亚基激活剂AICAR和AMPK特异siRNAs对 HK-2细胞中α-SMA和E-钙黏蛋白表达影响
3讨论
药物通过控制血糖水平,对肾脏发挥保护作用,从而延缓肾衰的进展,但无法完全阻止DN的发展〔5〕。DN发病机制是一个十分复杂的过程,至今尚未完全研究清楚。已知高血糖可通过TEMT加速肾脏纤维化,这一过程是DN发病的潜在机制之一〔2〕。然而高血糖是如何调控TEMT发生的目前还有待进一步的深入研究。
AMPK是一种保守的异源三聚体蛋白质激酶,在接受外源信号刺激被激活后,即可向下游传递信号,激活下游通路,进而促进细胞内转录调节,影响细胞的生物学行为〔6〕。文献报道,AMPK具有抑制心脏和肝纤维化的功能〔4〕。mTOR是一种丝/苏氨酸蛋白质激酶,其信号接收并整合细胞内外的各种刺激,进而对细胞的生长、增殖、存活、凋亡等生理过程发挥调节作用〔7〕。研究提示mTOR是AMPK下游的信号通路分子,AMPK通过调控mTOR的活化水平对细胞的凋亡发挥调节作用。
本研究结果提示D-葡萄糖可能通过调控AMPK信号通路的活化情况,进而促进HK-2细胞EMT的发生。进一步实验结果发现HK-2细胞中α-SMA和E-钙黏蛋白的表达与单独的D-葡萄糖处理组相似。总之,D-葡萄糖可通过调节HK-21细胞中的AMPK/mTOR通路的活化情况,从而促进TEMT的发生。
4参考文献
1Alberti KG,Zimmet PZ.Diabetes:a look to the future〔J〕.Lancet Diabetes Endocrinol,2014;2(1):e1-2.
2Simonson MS.Phenotypic transitions and fibrosis in diabetic nephropathy〔J〕.Kidney Int,2007;71(9):846-54.
3Davis BJ,Xie Z,Viollet B,etal.Activation of the AMP-activated kinase by antidiabetes drug metformin stimulates nitric oxide synthesis in vivo by promoting the association of heat shock protein 90 and endothelial nitric oxide synthase〔J〕.Diabetes,2006;55(2):496-505.
4Xiao H,Ma X,Feng W,etal.Metformin attenuates cardiac fibrosis by inhibiting the TGFbeta1-Smad3 signalling pathway〔J〕.Cardiovasc Res,2010;87(3):504-13.
5Gubitosi-Klug RA.DCCT/EDIC Research Group.The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years:summary and future directions〔J〕.Diabetes Care,2014;37(1):44-9.
6Kemp BE,Stapleton D,Campbell DJ,etal.AMP-activated protein kinase,super metabolic regulator〔J〕.Biochem Soc Trans,2003;31(Pt 1):162-8.
7Dazert E,Hall MN.mTOR signaling in disease〔J〕.Curr Opin Cell Biol,2011;23(6):744-55.
〔2015-03-28修回〕
(编辑袁左鸣)

