辛伐他汀对急性血栓性肺栓塞兔血清肝细胞生长因子的影响
辛伐他汀对急性血栓性肺栓塞兔血清肝细胞生长因子的影响
杨永张艳敏1梁明亭骆峰武蕾李义波
(聊城市人民医院心内科,山东聊城252000)
摘要〔〕目的初步探讨辛伐他汀对急性血栓性肺栓塞兔血清肝细胞生长因子(HGF)浓度变化的影响。方法采用兔自体血栓回输法建立急性肺栓塞模型。选用30只健康新西兰白兔,随机分为对照组、模型组、辛伐他汀组,每组10只。采用酶联免疫吸附试验检测血清中HGF、肿瘤坏死因子(TNF)-α及白细胞介素(IL)-1β浓度。实验结束后取兔肺组织观察其病理变化。结果模型组肺栓塞后1 h HGF水平开始升高;于12 h达到高峰,与同期对照组相比有显著差别(P<0.000 1);模型组与同期辛伐他汀组相比,栓塞后1 h及6 h差异显著(P=0.011 6,P=0.001)。实验中观察到,血清TNF-α、IL-1β于栓塞后1 h明显升高,于栓塞后3 h达高峰;与同期辛伐他汀组、对照组比较差异显著(P<0.01)。肺组织病理变化显示,模型组和辛伐他汀组可见肺动脉内均见多处血栓,肺泡萎陷、水肿,肺泡腔内可见炎性细胞浸润和少量红细胞渗出液,而辛伐他汀组炎性反应较模型组减轻。结论急性血栓性肺栓塞后,血清HGF及促炎细胞因子浓度升高;辛伐他汀可能通过抑制促炎细胞因子的释放从而降低HGF的水平;HGF有望成为早期提示肺栓塞的生物学指标之一。
关键词〔〕肺栓塞;动物模型;细胞因子;辛伐他汀;肝细胞生长因子(HGF)
中图分类号〔〕R332;R563.5〔文献标识码〕A〔
通讯作者:张艳敏(1981-),女,主治医师,硕士,主要从事急诊心肺血管各种急危重症及急性中毒患者的抢救研究。
1聊城市人民医院急诊科
第一作者:杨永(1977-),男,硕士,主治医师,主要从事心血管急症危重病的综合抢救及心律失常的介入治疗研究。
肺栓塞症是一种严重威胁人类健康的常见的、多发的外周血管病之一〔1〕,由于其临床表现各异,早期迅速作出诊断较困难。常规实验室检查没有特异的生化指标,常规胸片、血气分析和心电图有助于该病的诊断,但在确诊肺栓塞时常常不可靠。肺动脉造影是诊断肺栓塞的金标准,但要求昂贵的设备及有经验的放射科医师,且有其患者对造影剂过敏,限制了其广泛应用。肝细胞生长因子(HGF)是一种多功能性的间质细胞源性细胞因子。目前,关于肺栓塞与HGF、促炎细胞因子与HGF的关系以及辛伐他汀对它们影响的研究较少。本文探讨辛伐他汀对急性血栓性肺栓塞兔血清HGF的影响。
1资料与方法
1.1动物分组健康新西兰白兔30只(山东大学实验动物中心提供,许可证号:SCXK20040013),雌雄不限,体重(3.2±0.3)kg,月龄4~6个月,随机分为对照组、模型组、辛伐他汀组,每组10只。制模前治疗组饲喂辛伐他汀(舒降之)10 mg·kg-1·d-1持续4 w〔2〕,模型复制成功后,继续饲喂至实验结束。
1.2动物模型的制备〔3〕称取兔体重,用苯巴比妥钠150 mg/kg腹腔注射麻醉后置于固定架上,在腹股沟区剪毛,用碘伏局部消毒,触摸到股动脉波动,沿股动脉走向穿刺股静脉成功后,将5F鞘管扩张鞘经股静脉插至右心房。将预先制备好的栓子注入,每次注入栓子0.5 ml,并用2 ml生理盐水冲注,防止栓子嵌留在鞘管中,每隔5 min重复注入,栓子总量1 ml/mg。对照组以相同方式注入等量生理盐水。通过导管注入造影剂及病理切片证实肺栓塞模型复制成功。
1.3实验方法每组于栓塞前1 h、栓塞后1、3、6、12、24、48、72 h取血1 ml,用4℃低温离心机以3 000 r/min,10 min离心,收集上清液。样本储存在-80℃条件下待测。采用酶联免疫吸附试验测定血清中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β及HGF的浓度,操作按试剂盒说明书进行。
1.4形态学观察实验结束时杀死家兔,开胸取肺组织, 观察肺血管中栓子的形态及分布。于栓塞区取肺组织,10%甲醛固定,石蜡包埋,切片HE染色,光镜下观察肺组织病理变化。
2结果
2.1各组HGF浓度变化模型组肺栓塞后1、3、6、12、24、48 h HGF浓度开始明显升高,于12 h达到高峰,分别与同期对照组相比有显著差别(P<0.000 1)。模型组与同期辛伐他汀组相比,在栓塞后1、3、6 h差异均有统计学意义(P=0.011 6,P=0.018 2,P=0.001)。栓塞后12 h HGF浓度达高峰,但此时模型组与辛伐他汀组相比没有统计学意义(P>0.05)。见表1。
2.2各组TNF-α、IL-1β变化结果模型组与辛伐他汀组TNF-α、IL-1β浓度在肺栓塞1 h已经升高,3 h浓度达到高峰,6 h基本恢复到正常水平。栓塞后1 h,模型组分别与同期对照组和辛伐他汀组相比差别有统计学意义(P<0.01,P<0.05)。栓塞后3 h达高峰,与同期辛伐他汀组和对照组比较差异有统计学意义(P<0.01,P<0.01)。见表2,表3。
2.3肺组织病理变化结果见图1。模型组和辛伐他汀组可见到肺表面凹凸状,肺膨胀不全,有肺萎陷、散在暗红色灶性出血现象。肺动脉内均见多处血栓,栓子结构致密。肺泡萎陷,呈肺不张现象,部分肺泡水肿,肺泡腔内可见大量炎性细胞浸润和少量红细胞渗出液。部分镜检可见肺静脉淤血现象。辛伐他汀组虽有上述病理变化,但炎性反应减轻。对照组兔肺未见上述病理变化。

表1 各组兔血清HGF的浓度变化
与同期对照组比较:1)P<0.01;与同期辛伐他汀组比较:2)P<0.05, 3)P<0.01
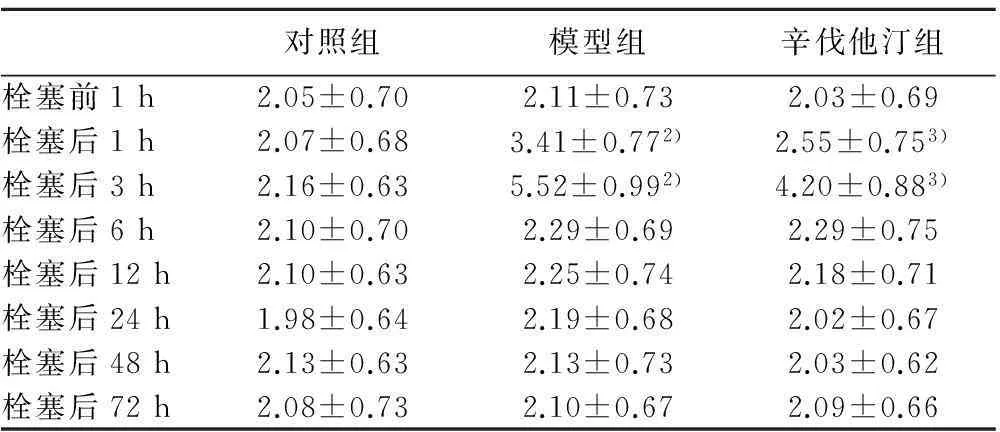
表2 各组兔血清TNF-α的浓度变化(ng/ml, x± s, n=10)
与同期对照组相比较:1)P<0.05,2)P<0.01;与治疗组比较:3)P<0.05,4)P<0.01

表3 各组兔血清IL-1β的浓度变化(pg/ml, x± s, n=10)
与同期对照组相比较:1)P<0.05,2)P<0.01;与治疗组比较:3)P<0.05,4)P<0.01

对照组(×4)
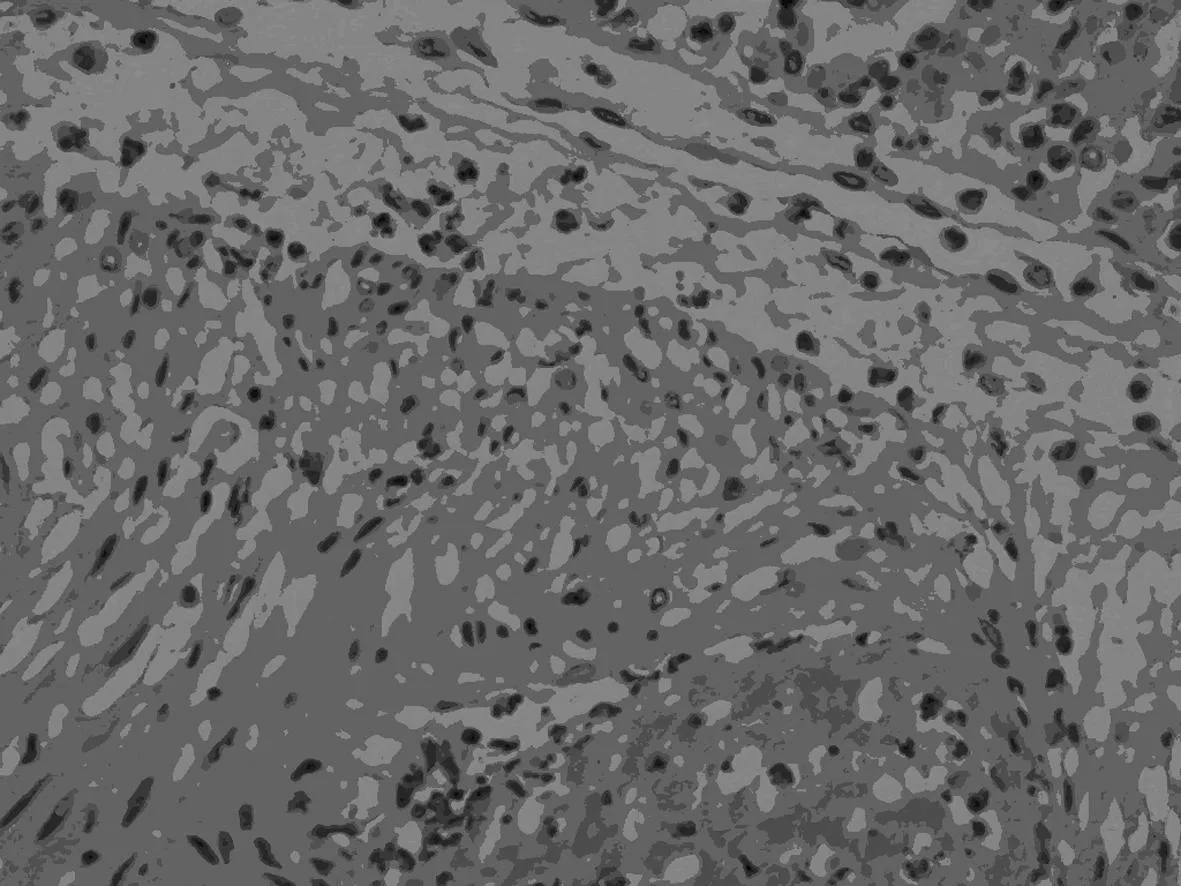
模型组(×10)

辛伐他汀组(×10)
3讨论
急性肺栓塞是涉及细胞因子网络的多种炎症介质参与的病理生理过程。近年来研究发现,HGF在肺动脉结扎后肺缺血模型中表达异常,提示HGF参与了肺缺血损伤的病理生理过程〔4〕。HGF是一种间质细胞源性的促进细胞有丝分裂的多功能因子,其合成、分泌受TNF-α、IL-1β因子的调节。研究显示,HGF分泌与急性肺损伤患者支气管肺泡灌注液中IL-β水平相关,给予IL-β抗体可一定程度抑制HGF的分泌〔5〕; TNF-α可促进人类间充质干细胞迁移并合成、分泌HGF,TNF受体Ⅱ抗体可抑制上述效应〔6〕。本实验结合文献报道的TNF-α、IL-1β有HGF的合成、分泌的效应,提示在急性血栓性肺栓塞时TNF-α、IL-1β可能参与了上调HGF的表达。
他汀类药物是HMG-COA还原酶抑制剂,常用来调脂,近年来研究显示它具有独立于调脂外的作用,如抗炎、免疫抑制、抑制血小板聚集、保护血管内皮、减轻心肌缺血再灌注性损伤等作用。有研究证实在炎症反应中,辛伐他汀可通过抑制TNF-α、IL-1α诱导的细胞凋亡有效地保护内皮祖细胞〔7〕。本研究结果提示辛伐他汀可能通过抑制促炎细胞因子TNF-α、IL-1β降低了它们对HGF的刺激诱导作用,但具体机制有待进一步探讨。
目前,HGF在肺栓塞动物模型的研究中较少,Nagai等〔4〕结扎肺动脉建立的肺缺血模型与肺栓塞还不完全相同。临床上关于肺栓塞患者血浆及肺组织HGF水平变化规律及意义国内外均未见相关报道,因此有待进一步探讨。急性肺栓塞后血清HGF浓度升高,辛伐他汀抗感染治疗后可降低其水平,因此HGF有可能成为诊断并评价肺血栓栓塞预后的新生物学指标之一。
4参考文献
1翟振国, 王辰. 肺栓塞-深静脉血栓形成的研究现状与展望〔J〕. 中国实用内科杂志,2006;26(14):1050-2.
2Yao HW, Mao LG, Zhu JP. Protective effects of pravastatin in murine lipopolysaccharide-induced acute lung injury〔J〕. Clin Exp Pharmacol Physiol,2006;33 (9): 793-7.
3季颖群, 高鹤立, 张中和. 家兔自体血凝块制备肺栓塞模型的探讨〔J〕.实验动物科学与管理, 2001;18(4):1-4.
4Nagai K, Aoe M, Shimizu N. Rapid response of hepatocyte growth factor in pulmonary ischemia in a rat model〔J〕. Acta Med Okayama, 2004;58(3):119-25.
5Quesnel C, Marchand-Adam S, Fabre A,etal. Regulation of hepatocyte growth factor secretion by fibroblasts in patients with acute lung injury〔J〕. Am J Physiol Lung Cell Mol Physiol, 2008;294(2):L334-43.
6Zhang A, Wang Y, Ye Z,etal. Mechanism of TNF-α-induced migration and hepatocyte growth factor production in human mesenchymal stem cells〔J〕.J Cell Biochem, 2010;111(2):469-75.
7Henrich D, Seebach C, Wilhelm K,etal. High dosage of simvastatin reduces TNF-α-induced apoptosis of endothelial progenitor cells but fails to prevent apoptosis induced by IL-1beta in vitro〔J〕.J Surg Res, 2007;142(1):13-9.
〔2014-01-12修回〕
(编辑安冉冉/曹梦园)

