蛇床子素通过抑制PI3K/Akt信号通路减轻糖尿病脑病的炎症反应
蛇床子素通过抑制PI3K/Akt信号通路减轻糖尿病脑病的炎症反应
毛小元周宏灏刘昭前
(中南大学湘雅医院临床药理研究所,湖南长沙410008;中南大学临床药理研究所湖南省遗传药理学重点实验室,湖南长沙410078)
摘要〔〕目的探讨蛇床子素(OST)对糖尿病脑病的神经保护作用及其分子机制。方法应用水迷宫实验检测OST对糖尿病大鼠模型学习记忆的影响;应用试剂盒法检测不同实验组海马中胆碱酯酶(AChE)和胆碱乙酰基转移酶(ChAT)、炎症因子(包括NF-κB p65、TNF-α和IL-1β)和caspase-3的活性;应用Western印迹方法检测检测不同实验组海马中磷酸化Akt(p-Akt)蛋白的表达。结果OST改善了糖尿病大鼠模型的学习记忆能力,降低了糖尿病大鼠模型组海马中AChE和炎症因子(包括NF-κB p65、TNF-α和IL-1β)及cascapse-3的活性(P<0.01),提高了ChAT的活性(P<0.01),降低了p-Akt蛋白的表达(P<0.01)。同时,当使用LY294002阻断PI3K后,OST抑制炎症的作用更为明显,且进一步下调了p-Akt蛋白的表达。结论OST对糖尿病脑病大鼠模型具有神经保护作用,这种保护作用可能是通过抑制PI3K/Akt信号通路减轻炎症反应来实现的,其可能成为临床上缓解糖尿病患者并发学习记忆障碍的新型治疗药物。
关键词〔〕蛇床子素;糖尿病脑病;神经保护;炎症;PI3K;Akt;caspase-3
中图分类号〔〕R587.1〔文献标识码〕A〔
基金项目:国家自然科学基金(81302750)
第一作者:毛小元(1984-),男,博士,讲师,主要从事神经药理学和临床药理学研究。
Osthole alleviates the inflammation in rats with diabetes-associated cognitive decline via inhibiting PI3K/Akt signaling pathway
MAO Xiao-Yuan, ZHOU Hong-Hao, LIU Zhao-Qian.
Institute of Clinical Pharmacology, Xiangya Hospital, Central South University, Changsha 410008, Hunan, China; Institute of Clinical Pharmacology, Hunan Key Laboratory of Pharmacogenetics, Central South University, Changsha 410078, Hunan, China
Abstract【】ObjectiveTo explore the neuroprotective effects of osthole in rats with diabetes-associated cognitive decline (DACD) and potential molecular mechanisms. MethodsThe learning and memory performance were assessed by Morris water maze test; The activities of AChE, ChAT, inflammatory cytokines including NF-κB p65, TNF-α and IL-1β and caspase-3 in the hippocampus were detected by respective commercial kits; Western blot analysis was employed to determine the protein level of phosphor-Akt (p-Akt) in the hippocampus.ResultsOsthole significantly improved learning and memory functions in diabetic groups. Additionally, the activities of AChE and inflammatory cytokines including NF-κB p65, TNF-α and IL-1β and caspase-3 in the hippocampus were all remarkably decreased, while increased ChAT was found in diabetic rats. Furthermore, osthole also diminished the protein expression of p-Akt in diabetic rats.ConclusionsOsthole exerts protective potential against DACD and this neuroprotection is associated with suppressing PI3K/Akt-mediated inflammation in diabetic rats. It is likely to be a novel therapeutic drug for the treatment of diabetic patients with cognitive deficits in clinical practice.
【Key words】Osthole; Diabetes-associated cognitive decline; Neuroprotection; Inflammation; PI3K; Akt; caspase-3
糖尿病脑病是糖尿病发生过程中的主要并发症,表现为学习记忆功能减退,同时伴有大脑结构及神经生理等方面的病理性改变〔1,2〕。糖尿病患者发生学习记忆障碍的概率是普通健康人群的两倍〔3〕。目前糖尿病脑病的发病机制尚不十分明确,但是近年来发现高血糖可能是糖尿病脑病发生的关键因素,通过对血糖的控制可以显著改善糖尿病并发的认知功能障碍〔4〕。蛇床子素(OST)具有抗炎、抗氧化及延缓细胞衰老等作用〔5,6〕;但是否对糖尿病脑病具有保护作用,目前尚不清楚。本研究旨在探索OST对糖尿病大鼠模型的神经保护作用从而为治疗糖尿病脑病提供理论基础。
1材料与方法
1.1动物、主要试剂和仪器成年3月龄雄性Wistar大鼠80只,体重210~230 g,由中南大学实验动物部提供。STZ,LY294002和OST(美国Sigma公司)。盐酸多奈哌齐片(中国卫材药业)。糖过氧化物酶诊断试剂盒(印度Span Diagnostic公司)。胆碱酯酶(AChE)和胆碱乙酰基转移酶(ChAT)活性检测试剂盒(南京建成生物技术研究所)。caspase-3活性检测试剂盒(江苏碧云天生物技术研究所)。小鼠抗大鼠p-Akt和Ak抗体(美国Santa Cruz公司)。DYY-5型稳流稳压电泳仪(北京六一仪器),Centrifuge 5810R低温高速离心机(德国Eppendorf),化学发光成像系统(美国BioRad公司)。
1.2糖尿病大鼠模型制作及药物干预Wistar大鼠适应1 w后,随机选取72只Wistar大鼠给予STZ(0.1 mol/L柠檬酸钠缓冲液pH4.5稀释)65 mg/kg一次性腹腔注射,其余8只大鼠给予等剂量柠檬酸钠缓冲液腹腔注射作为对照组。给予STZ 72 h之后,使用糖过氧化物酶诊断试剂盒检测血糖,快速血糖浓度大于250 mg/dl认为糖尿病模型制作成功,可以进行下一步实验。实验分为10组,每组8只:(1)对照组(Con);(2)模型组;(3)低剂量治疗组〔OST (1)〕;(4)中剂量治疗组〔OST (10)〕;(5)高剂量治疗组〔OST(50)〕;(6)阳性对照组(Don);(7)低剂量OST联合PI3K抑制剂组〔OST(1)+LY294002〕;(8)中剂量联合PI3K抑制剂组〔OST(10)+LY294002〕;(9)高剂量联合PI3K抑制剂组〔OST(50)+LY294002)〕;(10)模型给予PI3K抑制剂组。其中模型组中给予等量的生理盐水作为对照,OST以腹腔注射方式分别按照1、10和50 mg/kg给药,1次/d,连续给药5 w;PI3K抑制剂LY294002在OST最后一次给药时进行腹腔注射,给药浓度为50 mmol/L,多奈哌齐在实验结束前21 d开始腹腔注射给药,1次/d,连续给药21 d。各组动物每周测体重和血糖。给药结束后,进行后续的水迷宫实验。
1.3水迷宫实验参照以前的实验方法采用Morris水迷宫实验考察各组实验动物的空间学习记忆能力〔7〕。实验周期共5 d。第1天将大鼠放入水中自由游泳2 min,水迷宫里未放平台。第2~4天为定位航行实验,记录各组实验动物的逃逸潜伏期(找到平台所需的时间)。第5天为空间探索实验,记录各组实验动物在60 s内穿梭平台的次数和于平台所在象限内(目标象限)探索时间。
1.4AChE和ChAT活性测定水迷宫实验结束后,各组实验动物在麻醉状态下断头迅速剥离海马,参照试剂盒说明书测定各组实验动物的AChE和ChAT活性。
1.5炎症因子的活性测定各组实验动物剥离海马后,按照试剂盒说明书检测炎症相关因子(NF-κB p65、TNF-α和IL-1β)的活性。
1.6Western印迹实验各组实验动物于麻醉状态下断头迅速剥离海马,加入预冷的500 μl RIPA裂解液同时加入5 μl PMSF,超声匀浆后低温高速离心(4℃,12 000 r/min,20 min),取上清后,BCA法进行蛋白定量。按照50 μg蛋白的量进行电泳(10% SDS-PAGE凝胶),浓缩胶为120 V,分离胶为80 V。转印至NC膜(200 mA,1.5 h),5%脱脂奶粉室温封闭1.5 h,加入p-Akt一抗(1∶300)或Akt一抗(1∶300)4℃孵育过夜,次日加入相应的二抗(1∶5 000)室温孵育2 h。ECL化学发光法显色,结果经化学发光成像系统采集,测定灰度值。
1.7caspase-3活性测定各组实验动物于麻醉状态下断头迅速剥离海马,按照试剂盒说明书测定caspase-3的活性。
2结果
2.1OST改善了糖尿病大鼠模型的体重和血糖给予OST治疗5 w后,与Con组比较,STZ诱导的糖尿病大鼠模型体重明显减少,差异有统计学意义(P<0.01)。使用不同剂量的OST治疗5 w后,这种体重减少的现象得到明显逆转(P<0.01)。与此同时,相比于Con组,糖尿病大鼠模型的血糖显著升高,差异有统计学意义(P<0.01)。而OST显著降低了糖尿病大鼠的血糖浓度,差异有统计学意义(P<0.01),且呈现剂量依赖性。OST改善糖尿病大鼠模型的体重和血糖的作用与阳性对照药多奈哌齐的作用非常相似。见表1。
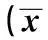
表1 OST对糖尿病大鼠体重、血糖及空间探索实验的影响 ± s, n=8)
与Con组比较:1)P<0.01,与模型组比较:2)P<0.01,下表同
2.2OST改善了糖尿病大鼠模型的学习记忆能力糖尿病大鼠模型在第1天至第4天实验中,逃逸潜伏期均比Con组明显增加(P<0.01);同时,在第5天的空间探索实验时,模型组中穿梭平台的次数和在目标象限中探索的时间均比Con组显著缩短(P<0.01)。而使用不同剂量的OST(1,10和50 mg/kg)显著减少了逃逸潜伏期,增加了穿梭次数和在目标象限中探索的时间(P<0.01),且50 mg/kg OST改善糖尿病大鼠模型的学习记忆作用与阳性对照药多奈哌齐的作用非常相似。见图1,表1。

图1 OST对糖尿病大鼠模型逃逸潜伏期的影响
2.3OST改变了糖尿病大鼠模型海马中AChE和ChAT的活性DM组AChE的活性显著高于Con组(P<0.01),而ChAT的活性却显著低于正常组(P<0.01)。不同剂量(1、10和50 mg/kg)OST干预后,海马中AChE的活性显著降低(P<0.01),同时ChAT的活性显著增高(P<0.01),且50 mg/kg OST改变糖尿病大鼠模型海马中AChE和ChAT活性的作用与阳性对照药多奈哌齐的作用非常相似。见表2。

表2 各组AchE及ChAT活性比较
2.4OST抑制了糖尿病大鼠模型海马中炎症因子的活性DM组炎症因子(包括p65 of NFκB,TNF-α和IL-1β)的活性显著高于Con组(P<0.01)。而使用不同剂量(1、10和50 mg/kg)的OST能够显著抑制DM组中炎症因子的活性(P<0.01),且这种抑制作用与阳性对照药多奈哌齐的作用非常相似。此外,使用不同剂量的OST与LY294002联合干预后,与单独使用OST相比较,炎症因子的活性进一步降低(P<0.01);同时发现,高剂量(50 mg/kg)OST与LY294002联合干预后,抑制海马中炎症因子活性的作用最明显(P<0.01)。见表3。
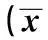
表3 各组炎症相关因子水平比较 ± s, n=8)
与Con组比较:1)P<0.01;与模型组比较:2)P<0.01;与Don组比较:3)P<0.01,下表同
2.5各组p-Akt相对表达量及caspase-3水平比较糖尿病模型大鼠海马中p-Akt蛋白表达、caspase-3的活性显著高于Con组(P<0.01)。不同剂量OST(1、10和50 mg/kg)显著降低了DM组中p-Akt的蛋白表达,并抑制了caspase-3的活性(P<0.01)。且50 mg/kg OST对糖尿病大鼠模型海马中p-Akt蛋白、caspase-3活性的改变与阳性对照药多奈哌齐的作用非常相似。使用不同剂量的OST与LY294002联合干预后,与单独使用OST干预相比较,p-Akt蛋白的表达显著降低(P<0.01);高剂量(50 mg/kg)OST与LY294002联合干预后,降低海马中p-Akt蛋白的表达最为明显(P<0.01)。在所有实验组中,海马中总Akt蛋白的表达没有任何影响。见表4。

表4 各组p-Akt相对表达量及caspase-3水平比较
3讨论
高血糖可能是糖尿病脑病发生发展的关键因素〔6〕。因此,通过对血糖的控制,可能对于减轻糖尿病并发学习记忆障碍具有十分重要的意义。本研究表明OST具有降糖作用,能够提高糖尿病大鼠模型的学习记忆能力。OST能够增强东莨菪碱引起的学习记忆障碍〔7〕。
以往有证据表明,胆碱能神经元功能异常与糖尿病并发学习记忆障碍的发生密切相关,即胆碱能神经元中乙酰胆碱含量的降低能够促使糖尿病脑病的发生〔8〕。AChE和ChAT是胆碱能神经元中两种关键酶,其中AChE分解乙酰胆碱,降低乙酰胆碱的含量,而ChAT能够合成乙酰胆碱,提高乙酰胆碱的含量,它们在学习记忆的调节中起着至关重要的作用。笔者的研究结果发现,OST能够显著降低糖尿病大鼠模型海马中AChE的活性,同时也可以显著提高海马中ChAT的含量。
炎症因子在学习记忆障碍中也发挥着关键作用。大量研究表明,糖尿病脑病的大鼠模型中往往会释放大量的炎症因子〔9,10〕。有研究报道,NF-κB p65介导的炎症反应可以促进糖尿病的发生发展过程〔11〕。笔者的研究结果表明,OST可以显著抑制糖尿病大鼠模型海马中的炎症反应。同时当OST联合PI3K的抑制剂LY294002时,OST抑制炎症反应的作用得到加强。OST还可提高糖尿病大鼠模型海马中p-Akt蛋白的表达;而联合PI3K的抑制剂LY294002时,蛇床子素的这种作用得到逆转;提示OST抑制糖尿病脑病的炎症反应可能是通过抑制PI3K/Akt信号通路来实现的。以往有研究表明,PI3K/Akt信号通路与炎症的发生发展密切相关〔12~14〕,通过抑制PI3K/Akt通路可以显著降低炎症反应的发生。
4参考文献
1Somfai G M,Knippel B,Ruzicska E,etal.Soluble semicarbazide-sensitive amine oxidase (SSAO) activity is related to oxidative stress and subchronic inflammation in streptozotocin-induced diabetic rats〔J〕.Neurochem Int,2006;48(8):746-52.
2Sehirli O,Tozan A,Omurtag GZ,etal.Protective effect of resveratrol against naphthalene-induced oxidative stress in mice〔J〕.Ecotoxicol Environ Saf,2008;71(1):301-8.
3Maiese K,Chong ZZ,Shang YC.Mechanistic insights into diabetes mellitus and oxidative stress〔J〕.Curr Med Chem,2007;14(16):1729-38.
4Wessels AM,Scheltens P,Barkhof F,etal.Hyperglycaemia as a determinant of cognitive decline in patients with type 1 diabetes〔J〕.Eur J Pharmacol,2008;585(1):88-96.
5Zimecki M,Artym J,Cisowski W,etal.Immunomodulatory and anti-inflammatory activity of selected osthole derivatives〔J〕.Z Naturforsch C,2009;64(5-6):361-8.
6沈丽霞,张丹参,张力,等.蛇床子素对学习记忆的影响及其机制分析〔J〕.药学学报,1999;34(6):405-9.
7Shen LX,Zhang DS,Zhang L,etal.Action of osthole on learning and memory and its mechanism analysis〔J〕.Acta Pharm Sinica,1999;34(6):405-9.
8丁慧,陈虹,姜勇,等.松果菊苷对阿尔茨海默病大鼠海马、皮质内神经递质水平的影响〔J〕.中国药理学通报,2014;30(11):1564-9.
9Ding H,Cheng H,Jiang Y,etal.Effect of echinacoside on monoamine neurotransmitters in hippocampus and cortex of rats with Alzheimer's disease〔J〕.Chin Pharm Bull,2014;30(11):1564-9.
10Wang CY,Zheng W,Wang T,etal.Huperzine A activates Wnt/β-catenin signaling and enhances the nonamyloidogenic pathway in an Alzheimer transgenic mouse model〔J〕.Neuropsychopharmacology,2011;36(5):1073-89.
11Liu YW,Zhu X,Li W,etal.Ginsenoside Re attenuates diabetes-associated cognitive deficits in rats〔J〕.Pharmacol Biochem Behav,2012;101(1):93-8.
12Deng W,Lu H,Teng J,etal.Carvacrol attenuates diabetes-associated cognitive deficits in rats〔J〕.J Mol Neurosci,2013;51(3):813-9.
13Kim EK,Kwon KB,Han MJ,etal.Coptidis rhizoma extract protects against cytokine-induced death of pancreatic beta-cells through suppression of NF-kappaB activation〔J〕.Exp Mol Med,2007;39(2):149-59.
14Qin Z,Li Y,Li Y,etal.Tumor necrosis factor alpha stimulates proliferation of dental pulp stem cells via Akt/Glycogen synthase kinase-3β/Cyclin D1 signaling pathway〔J〕.J Endodont,2015;S0099-2399(15):00180-6.
〔2015-02-17修回〕
(编辑曲莉)

