二氢黄酮类化合物的合成研究进展
·综述·
二氢黄酮类化合物的合成研究进展
梁海1,2,向卓2,张学辉2,吴久鸿2(1.安徽医科大学药学院,安徽 合肥 230032;2.解放军306医院药学部,北京 100101)
[摘要]综述二氢黄酮类化合物的合成研究进展,总结已报道的各种类型的二氢黄酮合成方法,为二氢黄酮类新药研发提供方法学支持。合成方法包括:查尔酮环合、Friedel-Crafts反应、Knoevenagel缩合和Hoesch单酰基化反应,以及二氢黄酮的不对称合成,并简要介绍无溶剂合成二氢黄酮等“绿色”化学方法。
[关键词]二氢黄酮类化合物;查尔酮;环合;合成
[基金项目]国家自然科学
[作者简介]梁海,硕士研究生. Tel:15101613630;E-mail:lianghai_ay@163.com
[通讯作者]吴久鸿.主任药师.研究方向:天然药化和药物化学研究.Tel:(010)64879825;E-mail:jiuhongwu@hotmail.com
[中图分类号]R916[文献标志码]A
DOI[]10.3969/j.issn.1006-0111.2015.02.001
[收稿日期]2013-11-28[修回日期]2014-04-21
Reviews on flavanone compounds synthesis research
LIANG Hai1, 2, XIANG Zhuo2, ZHANG Xuehui2, WU Jiuhong2(1. School of Pharmacy, Anhui Medical University, Hefei 230032, China; 2. Department of Pharmacy, No.306 Hospital of PLA, Beijing 100101, China)
Abstract[]Research progress of flavanone compounds synthesis was reviewed, various types of synthesis methods of flavanone compounds were summarized, and methodological support for flavanone compounds in new drug research and development was provided. Research progress in synthesis of flavanone compounds includes chalcone cyclization, Friedel-Crafts reaction, Knoevenagel condensation, Hoesch single acetoxylation, and asymmetric synthesis of flavanone compounds. Solvent-free synthesis of flavanone compounds and other green chemistry methods were also introduced.
[Key words] flavanone compounds; chalcone; cyclization; synthesis
二氢黄酮,又称黄烷酮,是黄酮类化合物中的一种,分布于蔷薇科、芸香科、姜科、菊科、杜鹃花科,豆科等被子植物中。二氢黄酮类化合物具有杀菌[1]、抗炎[2]、抗肿瘤[3]、抗HIV病毒[4]、抗诱变[5]、抗氧化[6]等诸多生物活性,是一类研究价值很高的化合物。天然二氢黄酮类化合物多具有羟基、异戊烯基、苄氧基、甲氧基、香叶基等取代基。此外,二氢黄酮的可修饰位点达10个之多,使其具有极大的结构修饰潜力。因此,对二氢黄酮类化合物的研究与开发成为药物化学的一个研究热点。
二氢黄酮同时也是多种类黄酮化合物的合成中间体,其合成一直备受药化工作者的关注。本文综述了二氢黄酮化学合成的研究进展,其中反应类型包括查尔酮环合、Friedel-Crafts反应、Knoevenagel缩合和Hoesch单酰基化反应,以及二氢黄酮的不对称合成,同时亦总结了近年来出现的较新的合成方法。
1查尔酮的环合
二氢黄酮的经典合成方法(图1)为査尔酮在催化剂的条件下进行关环反应,传统催化剂一般多为盐酸或氢氧化钾的醇溶液。但由于关环反应时间较长(约12 h),产率较低(约40%)等缺点,研究者对其环化条件进行不断改进,提出了很多新型的催化试剂。例如:HI和SnCl2、醋酸钠、醋酸汞、氢氧化三甲基苄基铵、氟化钾、三氟乙酸、沸石、大孔树脂A-21等。

图1 二氢黄酮的经典合成路线
1.1酸碱催化剂环化传统碱催化在合成多羟基取代的二氢黄酮多表现出反应难、产率低的特点。Bhattachaqryya[7]以5-甲氧基查尔酮为原料,在HI和SnCl2两种酸性物质的条件下,合成didymocarpin-A(4,5,6,7-四羟基二氢黄酮),产率为60%左右。
如取代基活性高,在较强的酸、碱条件下易发生其他反应,需采用较温和的催化剂。Aanguly等[8]合成candidone-A(5,7-二甲氧基-8-异戊烯基二氢黄酮),查尔酮关环时所用的催化剂为triton-B(氢氧化三甲基苄基铵),在室温下搅拌反应10 h,产率70%;郭冬冬等[9]合成(±)-5,7,3′-三羟基-4′-甲氧基-8-异戊烯基二氢黄酮,查尔酮关环时所用的催化剂为无水醋酸钠,乙醇回流反应25 h,总产率仅11.6%。
为了提高目标产物收率,Deshpande等[10]在KOH的醇溶液中将2,6-二羟基苯乙酮和异香草醛直接缩合生成查尔酮,然后在15%盐酸的水溶液中环化成目标产物。反应1 h,产率高达91%(图2);何文香等[11]采用吡啶-水为催化剂,其体积比为40:60,加热到90 ℃,反应1 h,可将2′-羟基查尔酮环化成二氢黄酮,产率达91.9%。
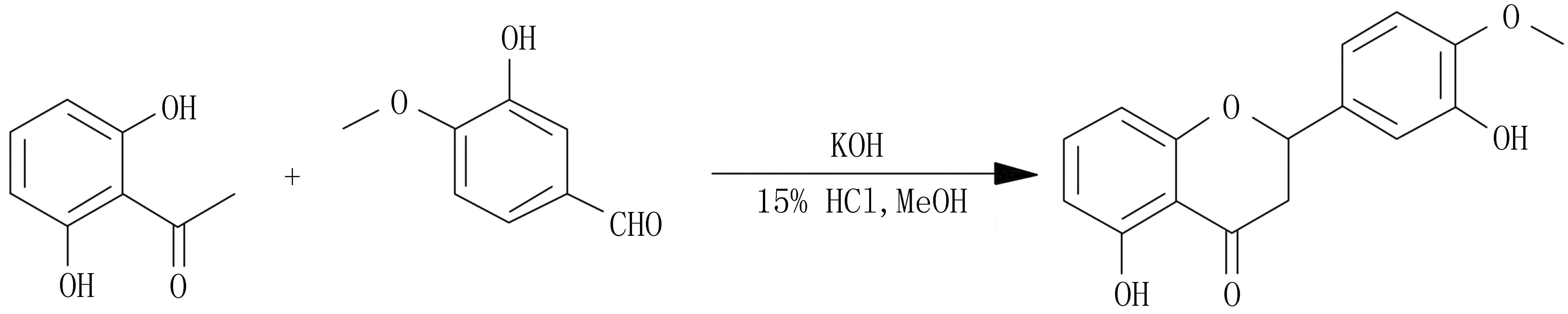
图2 KOH醇溶液缩合、盐酸溶液环化制备二氢黄酮类化合物
反应底物影响目标产物的收率,Namrata等[12]研究合成二氢黄酮衍生物时,当芳基环上有甲氧三唑基取代时产率最高,吡唑查尔酮、呋喃查尔酮合成二氢黄酮衍生物的产率较低。
1.2硅胶催化剂为实现“绿色”化学合成,化学工作者不断探索和研究非均相催化体系,将各种硅胶催化剂应用于二氢黄酮的合成。硅胶作为环化试剂廉价易得,且反应条件温和、反应时间短、产率高。适用于在酸/碱性条件下不易关环的多羟基查尔酮的环化。
Sangwan等[13]以2′-羟基查尔酮为原料,用硅胶作为催化剂,在110 ℃加热的条件下反应,产率在40%~75%之间。在反应底物不变的基础上,Bagade等[14]用色谱柱级硅胶作为催化剂,再加入一些二氯乙烯,室温搅拌反应3~4 h,产率为50%。此方法较之其他固体催化剂,没有复杂的制备过程,也不需要昂贵、高毒性的溶剂,充分体现了“绿色”合成的理念。
为了提高产物收率,Naseem等[15]采用带BiCl3的硅胶,加热到70~80 ℃,并间断振荡3~6 h,合成二氢黄酮的产率高达94%(图3)。同时,Naseem等[16]还选用固定在硅胶上的TaBr5为催化剂,虽然温度提高到140~150 ℃,但反应时间大大减少,3~4 min即可催化2′-羟基查尔酮环化合成二氢黄酮。
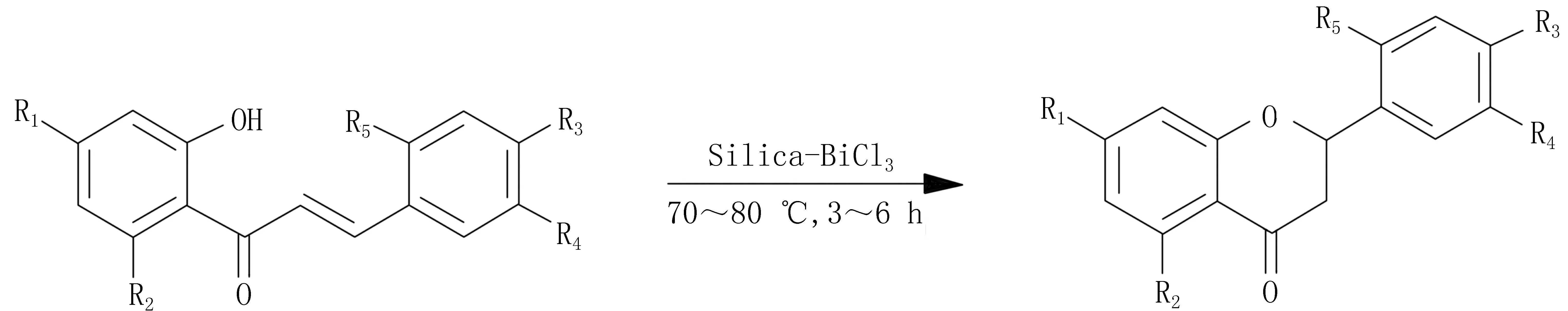
图3 BiCl 3固体硅胶催化制备二氢黄酮类化合物
Beena等[17]选用固定在硅胶上的浓硫酸为催化剂,在室温下将α-甲基-2′-羟基查尔酮环化合成二氢黄酮。该反应操作简单,不需要加热。
1.3金属及金属氧化物催化剂随着绿色化学方法概念的普及,金属及金属氧化物催化剂也逐渐被应用,它们具有收率高、操作简便、环境污染小等优点。
Michele等[18]采用MgO为催化剂,以苯甲醛和2′-羟基苯乙酮为原料,缩合生成二氢黄酮和2′-羟基查尔酮。
为了验证MgO的催化活性,Liu等[19]选用MgO组合不同阴离子做催化剂,经邻羟基苯乙酮和苯甲醛缩合合成查尔酮和二氢黄酮。实验结果发现,MgO 的活性比PO43-/MgO、SO42-/MgO、F-/MgO、Cl-/MgO组合催化剂的活性都要高,在溶剂DMSO反应下得到的产率为60%。
纳米级催化剂也表现出良好的潜力,Choudary等[20]研究纳米的MgO非均相催化剂合成二氢黄酮过程中发现:当催化剂为NAP-MgO(SSA:590 m2/g),催化活性最高,产率高达90%。该反应的催化剂可重复使用,不仅节省了原料,而且对环境污染少,是一种绿色的合成反应(图4)。
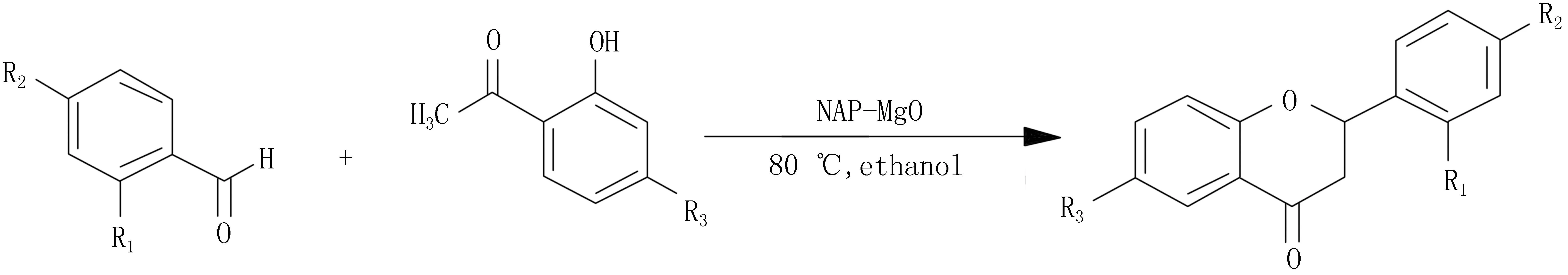
图4 NAP-MgO催化制备二氢黄酮类化合物
Saravanamurugan等[21]更系统研究了金属氧化物间不同质量比、不同温度及催化剂用量对合成二氢黄酮产率的影响。该方法是使用ZnO和其他金属氧化物如MgO、BaO、K2O、Na2O混合作催化剂,在无溶剂下经查尔酮合成二氢黄酮。
1.4相转移催化剂相转移催化剂用于非均相体系的有机合成中,通过自身阳离子表面活化作用,使非均相转化为均相反应,以加快反应速率、缓和反应条件、减少副反应、提高选择性,从而得到越来越多的关注和应用。
Makrandi等[22]用相转移催化剂CHCl3、K2CO3、(n-C4H9)4NHSO4和K3Fe(CN)6,合成了二氢黄酮,产率为40%~60%。
在比较微波辅助加热和传统加热的方法研究中,Hemanth等[23]用SiO2-NaHSO4作为相转移催化剂,在650 W微波中只要在短时间内(6~8 min)就可以达到70%的产率;在传统加热条件下,反应5~6 h,产率只有60%。研究结果表明,微波辅助合成可明显缩短反应时间。
采用回流的方式以稳定反应温度,减少副产物,提高产率。Raghavendra等[24]用PMA-SiO2作为相转移催化剂,在乙醇的溶剂中,回流反应8.5 h,产率为87%~93%(图5)。
1.5氨基酸催化剂氨基酸类有机小分子催化剂

图5 PMA-SiO 2催化制备二氢黄酮衍生物
具有类似酶的高选择性,反应条件温和,副反应少;原料廉价易得,可以重复利用;无毒、稳定,符合环境友好、绿色化学的要求。
Koichi等[25]用甘氨酸、L-亮氨酸、L-丙氨酸、L-脯氨酸这4种氨基酸为催化剂,在NaOH-H2O的体系下,常温反应1 h,合成了二氢黄酮,其产率在90%以上。此反应操作简单、反应率高、反应条件温和、催化剂无污染。
为考察反应条件对氨基酸催化反应的影响,Jiang等[26]研究L-丙氨酸在各种碱性溶液体系中的催化活性。结果表明,KOH溶液中的L-丙氨酸的催化活性最高,其次是NaOH、LiOH溶液。在确定了反应体系的基础上,又对不同氨基酸在KOH溶液体系中的催化效率加以研究,结果表明L-脯氨酸在KOH溶液体系中催化活性最高。
此外,氨基酸类小分子催化剂也逐渐应用在不对称催化合成。Chandrasekhar等[27]以邻羟基苯乙酮和苯甲醛为原料,用L-脯氨酸作催化剂,在80 ℃的DMF中,合成二氢黄酮化合物和相应的查尔酮化合物。反应时间18 h,得到的是R型二氢黄酮,产率为60%~70%;反应20 h,得到S型二氢黄酮,产率为85%~95%。合成路线简单,反应一步完成(图6)。
1.6有机介孔材料催化剂Wang等[28]以邻羟基苯乙酮和苯甲醛为原料,用氨丙基官能化SBA-15介孔分子筛作催化剂,在140 ℃下反应10 h,产率为60%~80%。该反应体系无溶剂,提高了催化剂的催化选择性,增加了产率(图7)。
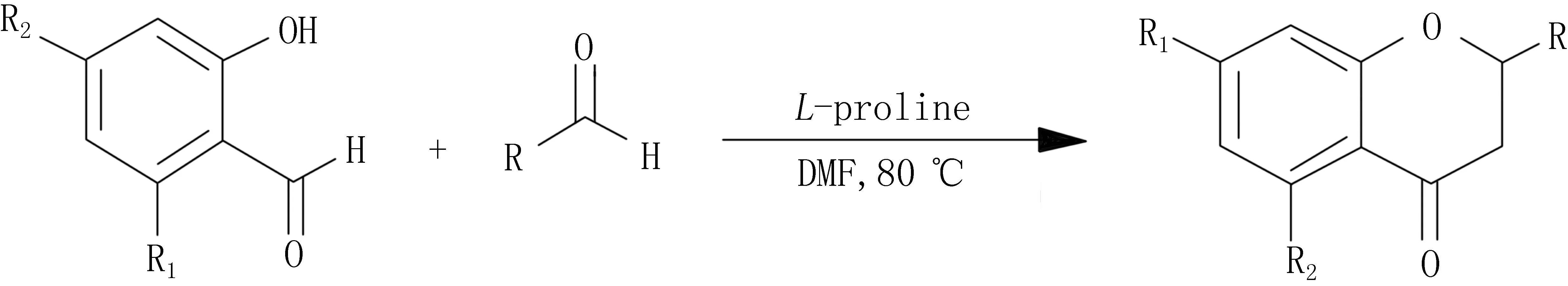
图6 L-脯氨酸催化制备S型二氢黄酮
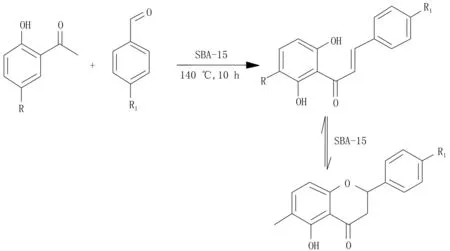
图7 氨丙基官能化SBA-15介孔分子筛催化制备二氢黄酮类化合物
为了保持底物不变,Shunmugavel等[29]采用了以SO3H-SBA-15作为催化剂,分别在微波和传统加热条件下反应2 h,温度为140 ℃,产率都在50%左右。此反应体系用时短,节省了反应中能源的消耗。
此外,将苄基和蒽基官能团分别键合在氨丙基官能化SBA-15介孔材料,显著增强了其催化活性和选择性[30]。
2Friedel-Crafts反应
早期,Tibor等[31]提出以AlCl3作为催化剂、POCl3作为酰化剂,用Friedel-Crafts反应形成苯并吡喃酮,产率为79%~82%。在Lewis酸催化剂不变的基础上,覃章兰等[32]以肉桂酸的衍生物与苯三酚反应关环,成功合成一系列二氢黄酮类化合物,反应产率均在70%以上,无取代基的二氢黄酮用此法合成产率高达90%(图8)。因Friedel-Crafts反应使用的催化剂无法重复利用,而且反应过程中易产生废液,不符合绿色化学的要求,所以在一定程度上限制了该反应的发展。
3Knoevenagel缩合和Hoesch单酰基化反应
此法省去了以往合成中羟基保护的步骤, 一般用于芳香醛上具有吸电子的基团。当芳香醛上的基团具有强供电子共轭效应时,可能增加氰基上的电荷密度,从而影响其酰化的性能,不能得到预期的目标产物。该方法反应条件温和、操作简便、产率较高。
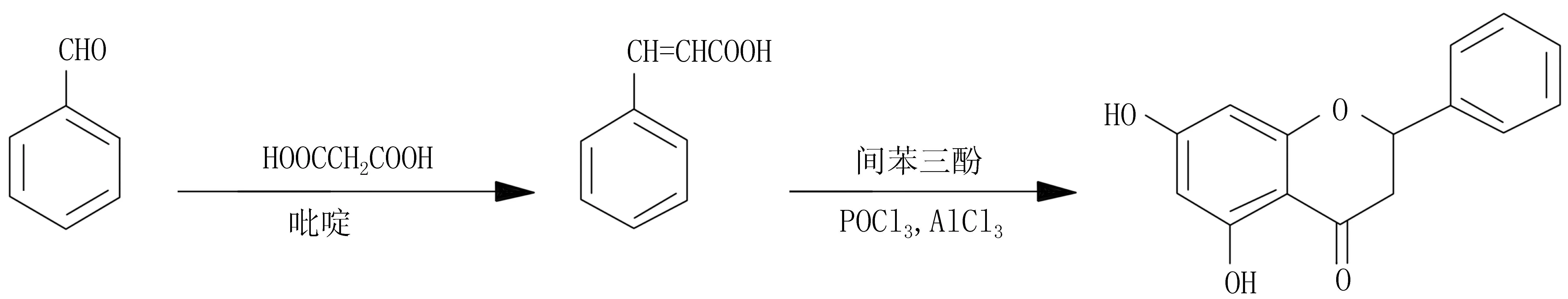
图8 以肉桂酸为反应物的FC反应下的二氢黄酮类化合物的合成
陈俊杰等[33]以丙二腈及相应的芳香醛、酚为原料,通过Knoevenagel缩合和Hoesch单酰基化反应,同时水解、脱羧、关环而直接得到二氢黄酮化合物。
替换相对活泼的亚甲基化合物硼酸复合物,采用弱碱性的哌啶,更有利于Knoevenagel缩合,Zhang等[34]将硼酸复合物与哌啶苯甲醛的加成物通过与邻代羟基苯乙酮反应,生成哌啶子基酮,经消除哌啶生成查尔酮,然后环化生成二氢黄酮。
沸石分子筛具有无毒、无污染、环境友好等特点,Takashi等[35]以丙二酸衍生物及相应2′-羟基乙酰苯、苯甲醛为原料,在β-沸石中进行反应,通过碱金属离子交换进行Knoevenagel缩合生成查尔酮,再进行分子内环化得到二氢黄酮。
4二氢黄酮的不对称合成
具有旋光性的二氢黄酮化合物的合成较为困难,选择性要求高。随着不对称催化技术的飞速发展,合成活性更高、实际应用价值更大的二氢黄酮类化合物吸引了更多的科研工作者。
Solladie等[36]利用生物仿生学合成(R)-(+)-5-羟基-6-羟甲基-7-甲氧基-8-甲基二氢黄酮,过程分为9步,是一条先连接A环和C环,再上B环的方案,总收率仅为6.1%。该反应合成路线复杂、产率低。
为了简化合成路线,提高产物收率,Biddle等[37]以α-叔丁氧羰基取代的查尔酮为原料,在手性硫脲催化下进行分子内加成,直接生成二氢黄酮(图9)。Wang等[38]通过使用一种具有手性结构的N,N′-二氧化碳镍复合物进行不对称分子内的Oxa-Michael加成,实现对映选择性地合成二氢黄酮。Nibbs等[39]将2位芳基取代的苯并吡喃通过不对称催化氢化合成2位芳基取代的苯并二氢吡喃酮,然后氧化成二氢黄酮。以上3种方法反应条件温和、合成路线简单、产率较高。
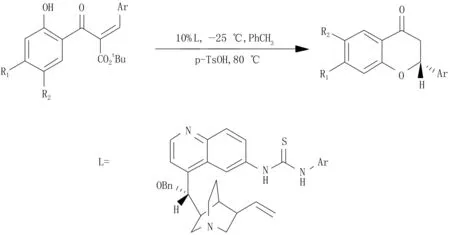
图9 α-叔丁氧羰基取代的查尔酮合成二氢黄酮类化合物
5展望
二氢黄酮类化合物具有多种良好的生物活性,并且作为黄酮类化合物等多种天然产物的重要中间体,它的合成一直受到国内外化学工作者的关注。目前已经发展出多种二氢黄酮合成方法,这些新方法不仅减少了反应时间,优化了反应条件,提高了反应收率,而且在立体选择性以及环境友好等方面也具有优势,为二氢黄酮的合成和研究等提供了重要方法依据。随着越来越多天然二氢黄酮类化合物被发现,化学工作者借助飞速发展的有机合成技术,正在设计合成具有更高活性、实际应用价值更大的二氢黄酮类化合物。
【参考文献】
[1]Noushin A, Alireza N, Christophe W. Anti-bacterial, antioxidant activity and phytochemical study ofUvariagrandiflora: a rare species of Annonaceae[J]. J Pharm Res, 2011, 4(4): 944-955.
[2]Chavan PN. Comparative study of flavonoids from chyavanprash for anti-inflammatory activity[J]. J Pharm Res, 2011, 4(5): 1338-1339.
[3]Szliszka E, Kostrzewa SE, Bronikowska J,etal. Synthetic flavanones augment the anticancer effect of tumor necrosis factor-related apoptosis-inducing ligand (trail)[J]. Molecules, 2012, 17(10): 11693-11711.
[4]Wang B, Ge L, Huang WL,etal. Synthesis and preliminary anti-HIV activities of andrographolide derivatives[J]. J Med Chem, 2010, 6(4): 252-258.
[5]Resende FA, Vilegas W, Dos Santos LC,etal. Mutagenicity of flavonoids assayed by bacterial reverse mutation (Ames) test[J]. Molecules, 2012, 17(5): 5255-5268.
[6]Zhou ZL, Fu CY. A new flavanone and other constituents from the rhizomes ofCyperusrotundusand their antioxidant activities[J]. Chem Nat Compd, 2013, 48(6): 963-965.
[7]Bhattachaqryya A, Chaudhuri A. Synthesis of didymocarpin-A, a new flavanone isolated from didymocarpus pedicellata[J]. Indian J Chem, 1980, 19B: 428-429.
[8]Anguly A, Bhattacharyya P, Bhattacharyya A,etal. A synthesis of candidone—a new flavanone isolated fromTephrosiacandida[J]. Indian J Chem, 1988, 27(5): 462-463.
[9]郭冬冬, 杨金会, 梁西周, 等. 两种天然异戊烯基黄烷酮的全合成[J]. 合成化学, 2013, 21(5): 550-553.
[10]Deshpande VH. Synthesis of 5,3′-dihydroxy-4′-methoxy-flavanone[J]. Indian J Chem, 1981, 20(10): 917-918.
[11]何文香, 郑旭煦, 殷钟意, 等. 基于吡啶-水体系的2′-羟基查尔酮的环化反应研究[J]. 化学研究与应用, 2010, 22(9): 1142-1146.
[12]Namrata A, Priyanka S, Anindra S,etal. Synthesis and evaluation of small libraries of triazolylmethoxy chalcones, flavanones and 2-aminopyrimidines as inhibitors of mycobacterial FAS-II and PknG[J]. J Med Chem, 2012, 20(17): 5150-5163.
[13]Sangwan MK, Verma BS. Association and path-coefficients inPlantagoovataForsk[J]. Indian J Chem, 1984: 54(12) 1090-1091.
[14]Bagade MB, Thool AW, Lokhande PD,etal. Simple technics for isomerization of 2′-hydroxychalcones to flavanones—use of silicagel, ethylenediamine and hydroxylamine hydrochloride[J]. Ind J Chem, 1991, 30B: 973-975.
[15]Naseem A, Ansare WH. An improved procedure for the isomerisation of 2′-hydroxy substituted chalcones to flavaones using silica supported-BiCl3 under dry conditions[J]. J Chem Res, 2004,35(17):572-573.
[16]Naseem A, Johan EVL. Silica gel supported TaBr5: new catalyst for the facile and rapid cyclization of 2′-aminochalcones to the corresponding 2-aryl-2,3-dihydroquinolin-4(1H)-ones under solvent-free conditions[J]. Tetrahedron Lett, 2006, 47(16): 2725-2729.
[17]Beena N, Sharad F, Abdul R,etal. Efficient synthesis of 3-methyl-flavanones and evaluation of their anti-bacterial activity[J]. Chin J Chem, 2012, 30(8): 1695-1698.
[18]Michele TD, Michael DA. Kinetic investigation of the heterogeneous synthesis of flavanone over MgO[J]. Catal Lett, 2002, 79(1-4): 175-181.
[19]Liu Z, Cortés-Concepción JA, Mustian M,etal. Effect of basic properties of MgO on the heterogeneous synthesis of flavanone[J]. Appl Catal A-Gen, 2006, 302(2): 232-236.
[20]Choudary BM, Ranganath KVS, Yadav J,etal. Synthesis of flavanones using nanocrystalline MgO[J]. Tetrahedron Lett, 2005, 46(8): 1369-1371.
[21]Saravanamurugan S, Palanichamy M, Arabmdoo B,etal. Solvent free synthesis of chalcone and flavanone over zinc oxide supported metal oxide catalysts[J]. Catal Commun, 2005, 6(6): 399-403.
[22]Makrandi JK,Shasi B.Potassium ferricyanide mediated cyclisation of 2′-hydroxychalcones to flavanones using phase transfer catalysis [J].Synth Commun,2000,30(19):3555-3558.
[23]Hemanth KK, Perumal TP. A simple and facile solventless procedure for the cyclization of 2′-amino-and-2′-hydroxychalcones sodium hydrogen sulphate as heterogenous catalyst[J]. Can J Chem, 2006, 84(8): 1079-1083.
[24]Raghavendra S, Marzieh Y, Noorsaadah AR. Synthesis of flavanones, azaflavanones, and thioflavanones catalyzed by PMA-SiO2as a mild, efficient, and reusable catalyst[J]. Monatsh Chem, 2012, 143(5): 797-800.
[25]Koichi T, Teize S. Efficient conversion of 2′-hydroxychalcones into flavanones and flavanols[J]. Green Chem, 2001, 3(3): 133-134.
[26]Jiang HY, Zheng XX, Yin ZY,etal. An efficient catalytic synthesis of flavanones under green conditions[J]. J Chem Res, 2011, 35(4): 220-221.
[27]Chandrasekhar S, Vijeender K, Venkatram RK. New synthesis of flavanone catalyzed byL-proline[J]. Tetrahedron Lett, 2005, 46(41): 6991-6993.
[28]Wang X, Cheng S. Solvent-free synthesis of flavanones over aminopropyl-functionalized SBA-15[J]. Catal Commun, 2006, 7(9): 689-695.
[29]Shunmugavel S, Sujandia, Prasetyantoa EA,etal. Liquid-phase reaction of 2′-hydroxyacetophenone and benzaldehyde over SO3H-SBA-15 catalysts: influence of microwave and thermal effects[J]. Micropor Mesopor Mat, 2008, 112(1): 97-107.
[30]Wang H, Nu XD, Zhao M,etal. Solvent-free synthesis of flavanone over new hybrid mesoporous base- catalysts[J]. Chem Res Chin U, 2011, 27(4): 664-668.
[31]Tibor T.A novel synthesis of precocenes. Efficient synthesis and regioselectiveo-alkylation of dihydroxy-2,2-dimethyl-4-chromanones[J].J Heterocycl Chem,1988,25(3):871-877.
[32]覃章兰, 李文新, 黄天宝, 等. 5,7-二羟基-4′-苄氧基黄烷酮的合成及生物活性[J]. 武汉大学学报(自然科学版), 2000, 46(6): 706-708.
[33]陈俊杰, 李裕林. 黄酮类化合物的合成方法[J]. 厦门大学学报(自然科学版), 1992, 31(6): 651-655.
[34]Zhang WH, Chan WL, Lin YH,etal. Synthesis of hydroxyflavanones from substituted acetophenones and benzaldehydes in the presence of silica gel, boric acid and piperidine[J]. Heterocycles, 1997, 45(1): 71-75.
[35]Takashi Y, Kodai N, Kanji S,etal. Synthesis of chalcone and flavanone derivatives from condensation of 2′-hydroxyacetophenones and benzaldehyde over basic β-zeolites[J]. J Jpn Petrol Inst, 2010, 53(6): 351-354.
[36]Solladie G, Gehrold N, Maignan J. Synthesis of (+)-(R)-5-hydroxy-6-hydroxymethyl-7-methoxy-8-methyl-flavanone[J]. Tetrahedron Asymmetr, 1999, 10(14): 2739-2747.
[37]Biddle MM, Lin M, Scheidt KA. Enantioselective synthesis of flavanones and chromanones[J]. J Am Chem Soc, 2007, 129(13): 3830-3831.
[38]Wang LJ, Liu XH, Dong ZH,etal. Asymmetric intramolecular Oxa-Michael addition of activated a,b-unsaturated ketones catalyzed by a chiral N,N′-dioxide nickel(II) complex: highly enantioselective synthesis of flavanoneses[J]. Angew Chem Int Ed, 2008, 47(45): 8670-8673.
[39]Nibbs AE, Scheidt KA. Asymmetric methods for the synthesis of flavanones, chromanones and azaflavanones[J]. Eur J Org Chem, 2012, 2012(3): 449-462.
[本文编辑]李睿旻

