循环冷却水中钙离子对生物酶缓蚀性能的影响
(中国石油大学化学工程学院,山东青岛266100)
现阶段循环水中常用的缓蚀剂主要有锌盐、聚磷酸盐等,而生物酶缓蚀剂却鲜有报道。生物酶作为一种环境友好物质,对循环水的缓蚀有很好的效果。可作为缓蚀剂的生物酶主要有溶菌酶和脂肪酶两种[1]。溶菌酶又称胞壁质酶,是一种有效的抗菌剂,可引起细菌的裂解[2-3],通过抑制水体中的细菌数量来减缓腐蚀作用。脂肪酶可以分解脂类物质,在工业中作为催化剂得到广泛应用[4-6]。脂肪酶可降解循环水中混入的脂类物质从而减小管道的腐蚀速率。钙离子作为循环水中的常见离子会引起循环水管道的结垢[7-8],对于循环水管道的使用寿命威胁很大,现行的处理方法大多是物理方法,且需要投加其它药剂[9-10],不但成本较高且易造成二次污染。有研究发现,钙离子可以作为溶菌酶的辅剂提高溶菌酶的酶活性[11],通过控制水中的钙离子浓度提高生物酶的活性,从而提高缓蚀效果。
作者研究了循环冷却水中钙离子对溶菌酶和脂肪酶的酶活性、特征性能及缓蚀性能的影响,以期在降低钙离子危害的同时提高生物酶的活性。
1 实验
1.1 材料、试剂与仪器
循环冷却水,青岛某炼化企业;溶菌酶(BR,MW:145.2,酶活性>40 000 U·mg-1),科昊生物工程有限责任公司;脂肪酶(BR,酶活性>30 000U·g-1),上海金穗生物科技有限公司;A3碳钢挂片(50mm×25mm×2mm)。
无水氯化钙、壳聚糖,国药集团化学试剂有限公司;正己烷、无水乙醇、盐酸、氢氧化钠,西陇化工股份有限公司;三油酸甘油酯、铁氰化钾、硫酸高铁铵,天津博迪化工股份有限公司。
78HW-1型恒温磁力搅拌器,金坛良友实验仪器厂;分析天平(±0.0001g),梅特勒-托利多仪器(上海)有限公司;UV 6000PC型紫外分光光度计,上海元析仪器有限公司;RCC-Ⅱ型旋转挂片腐蚀试验仪,高邮摩天电子仪器有限公司。
1.2 循环冷却水水质分析(表1)

表1 循环冷却水水质分析Tab.1 Water quality analysis of circulating cooling water
1.3 方法
首先测定循环冷却水中钙离子浓度并采用旋转挂片法测定溶菌酶及脂肪酶在无外加离子情况下的缓蚀率,确定其最适浓度。然后在溶菌酶及脂肪酶的最适浓度下,分别测定不同钙离子质量浓度下两种酶的酶活性,并测定钙离子对溶菌酶抑菌性能及脂肪酶油脂降解能力的影响。最后测定不同钙离子质量浓度下溶菌酶及脂肪酶的缓蚀性能。通过正交实验确定最佳配比。
1.3.1 缓蚀性能的测定
根据GB/T 18175-2000旋转挂片法对不同浓度的溶菌酶、脂肪酶进行缓蚀性能的测定,具体方法如下:
配制质量浓度分别为0 mg·L-1、20 mg·L-1、40mg·L-1、60mg·L-1、80mg·L-1的溶菌酶溶液及质量浓度分别为0mg·L-1、10mg·L-1、30mg·L-1、50mg·L-1、70mg·L-1、90mg·L-1的脂肪酶溶液各2L,选用A3碳钢挂片作为腐蚀对象,在温度40 ℃、转速80r·min-1的条件下,在旋转挂片腐蚀试验仪中运转72h。实验结束后清洗挂片,称量,并计算前后质量损失,做酸洗空白实验,分别按式(1)、式(2)计算腐蚀速率X1和缓蚀率X2:

式中:m为试片质量损失,g;m0为试片酸洗空白实验的质量损失平均值,g;s为试片表面积,cm2;ρ为试片密度,g·cm-3;t为试片的实验时间,h;8 760为与一年相当的小时数;10为厘米与毫米的换算系数;X0为试片在未加水处理剂空白实验中的腐蚀速率,mm·a-1。
1.3.2 溶菌酶酶活性的测定
参照GB/T 25879-2010的方法,以壳聚糖代替溶壁微球菌[12],测定溶菌酶酶活性。具体方法如下:
配制质量浓度为20mg·L-1的溶菌酶溶液,溶液额外投加钙离子质量浓度分别为0mg·L-1、25mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1的溶液,使体系中钙离子质量浓度分别为82.57mg·L-1、107.57 mg·L-1、132.57 mg·L-1、182.57 mg·L-1、282.57mg·L-1,备用。将质量浓度为1.200g·L-1的壳聚糖乙酸盐溶液(pH=4.5)58mL与上述溶菌酶溶液2.0mL在55 ℃下反应60min,取出6.0 mL 至具塞试管中,加入1.0 mL 浓度为0.1 mol·L-1的碱性铁氰化钾溶液,摇匀,沸水中加热5min后取出,加入浓度为0.05 mol·L-1的硫酸高铁铵1.0 mL,以空白试剂作参比,于670nm 处测定吸光度。同时做无酶溶液的对照实验,测定吸光度。酶活性U按式(3)计算:

式中:A为加酶溶液的吸光度;A0为无酶溶液的吸光度;m为溶液中含酶的质量,mg;100 为比例系数。
1.3.3 脂肪酶酶活性的测定
参照白光伟[13]的酶活性测定方法,测定脂肪酶活性,具体方法如下:
分别配制质量浓度为2mg·mL-1的脂肪酶溶液和离子质量浓度分别为0mg·L-1、25 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1的离子溶液5份,备用。在100mL锥形瓶中加入25mL 离子溶液和25mL磷酸缓冲溶液,再加入1mL三油酸甘油酯,磁力搅拌乳化10~20 min。将乳化好的底物平均分成2份,一份加入酶溶液5 mL,另一份加入5 mL 去离子水。将两份溶液置于35 ℃恒温水浴中反应20 min,取出后加入95%乙醇10mL终止反应,加入5滴酚酞作指示剂,用氢氧化钠溶液分别滴定并记录消耗量。酶活性U′按式(4)计算:

式中:V为加酶溶液消耗的氢氧化钠溶液体积,mL;V0为无酶溶液消耗的氢氧化钠溶液体积,mL;m为溶液中含酶的质量,mg;t为反应时间,min;100为比例系数。
1.3.4 溶菌酶抑菌性能的测定
分别配制质量浓度为5mg·mL-1的溶菌酶溶液和离子质量浓度分别为0mg·L-1、25 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1的离子溶液5份,备用。分别取8mL 离子溶液,加入酶溶液2 mL和新鲜循环冷却水水样20mL 充分混合,设置水样空白对照后置于35 ℃恒温水浴中反应10 min,备用。配制固体培养基,待培养基凝固后,每个培养基中加入0.2mL混合溶液,用三角刮涂匀后在30 ℃下培养24 h,每个浓度梯度做3组平行实验,记录菌落总数,以抑菌率表征溶菌酶的抑菌性能。抑菌率按式(5)计算:

式中:M0为无酶平板菌落数;Mi为有酶平板菌落数。
1.3.5 脂肪酶降解油脂性能的测定
分别配制质量浓度为2mg·mL-1的脂肪酶溶液和离子质量浓度分别为0mg·L-1、25 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1的离子溶液5份,备用。在100mL锥形瓶中加入25mL 离子溶液和25mL磷酸缓冲溶液,再加入1mL橄榄油,磁力搅拌乳化10~20min。向乳化好的底物中加入酶溶液5 mL。将溶液置于35 ℃恒温水浴中反应20min,取出后加入95%乙醇10mL终止反应,加入5滴酚酞作指示剂,后用氢氧化钠溶液分别滴定,以油脂去除率表征脂肪酶降解油脂性能。油脂去除率按式(6)计算:

式中:H0为无酶油脂溶液消耗的氢氧化钠溶液体积,mL;Hi为有酶油脂溶液消耗的氢氧化钠溶液体积,mL。
1.3.6 添加钙离子后缓蚀性能的测定
配制溶菌酶、脂肪酶质量浓度分别为20 mg·L-1、70mg·L-1的溶液,额外投加钙离子质量浓度分别为0mg·L-1、25mg·L-1、50mg·L-1、100mg·L-1、200mg·L-1的溶液,使体系中钙离子质量浓度分别为82.57mg·L-1、107.57mg·L-1、132.57mg·L-1、182.57mg·L-1、282.57mg·L-1,参考1.3.1方法进行实验,计算腐蚀速率和缓蚀率。
1.3.7 正交实验
为了验证钙离子在复合型生物酶缓蚀剂中的作用效果,设计以溶菌酶质量浓度(A)、脂肪酶质量浓度(B)和钙离子质量浓度(C)为考察因素的L9(34)正交实验。正交实验的因素与水平见表2。

表2 正交实验的因素与水平/(mg·L-1)Tab.2 The factors and levels of L9(34)orthogonal design experiment/(mg·L-1)
2 结果与讨论
2.1 生物酶缓蚀作用研究
2.1.1 溶菌酶缓蚀作用(图1)
由图1可知,随着溶菌酶质量浓度的增加,缓蚀率先升后降,在溶菌酶质量浓度为20mg·L-1时,缓蚀率最大,为82.40%,相应的腐蚀速率为0.0194mm·a-1。这是因为,溶菌酶能抑制几种特定细菌[14],其杀菌作用主要是通过破坏微生物的细胞壁结构而不影响其内部结构而实现的,由于溶菌酶是一种蛋白质,酶质量浓度过高时,其它不被溶菌酶所作用的微生物可以将过剩的酶作为营养物质利用,反而削弱了溶菌酶的缓蚀作用。李鹤等[15]研究得出相似的结论。因此,确定循环冷却水中最佳的溶菌酶质量浓度为20 mg·L-1。

图1 不同质量浓度溶菌酶的缓蚀率及腐蚀速率Fig.1 Corrosion inhibition efficiency and corrosion rate of different mass concentration of lysozyme
2.1.2 脂肪酶缓蚀作用(图2)

图2 不同质量浓度脂肪酶的缓蚀率及腐蚀速率Fig.2 Corrosion inhibition efficiency and corrosion rate of different mass concentration of lipase
由图2可知,随着脂肪酶质量浓度的增加,缓蚀率先升后降,在脂肪酶质量浓度为70mg·L-1时,缓蚀率最大,为88.32%,相应的腐蚀速率为0.0316mm·a-1。这是因为,脂肪酶可以促进脂类物质的水解,与利用脂类的微生物形成竞争关系从而抑制微生物的生长,刘海洲等[16]研究得出相似的结论。因此,确定循环冷却水中最佳的脂肪酶质量浓度为70mg·L-1。
2.2 钙离子对溶菌酶性能的影响
2.2.1 溶菌酶酶活性(表3)
由表3 可知,钙离子质量浓度在107.57~282.57mg·L-1的范围内,对溶菌酶的酶活性均有较大的提高。当钙离子质量浓度为182.57mg·L-1时,酶活性达到最高,为15 675U·mg-1,对于酶活性的提高效果较显著。这与赖晓芳等[17]的研究结果相吻合。
在整个实验离子质量浓度范围内,钙离子均对溶菌酶的酶活性有较大的提高,较适宜作为提高溶菌酶酶活性的助剂使用。

表3 钙离子质量浓度对溶菌酶酶活性的影响Tab.3 Effect of Ca2+mass concentration on the enzyme activity of lysozyme
2.2.2 溶菌酶抑菌性能(表4)由表4可知,在钙离子质量浓度为182.57 mg·L-1时,抑菌性能最佳,与酶活性实验结果一致。溶菌酶的特性之一就是杀菌作用,因此可应用于循环冷却水管道防腐。由此可以推测,钙离子对于溶菌酶的缓蚀效果将有一定的提升。
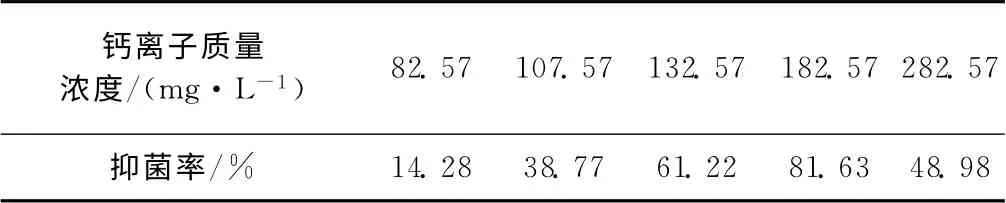
表4 钙离子质量浓度对溶菌酶抑菌性能的影响Tab.4 Effect of Ca2+mass concentration on the antibacterial performance of lysozyme
2.2.3 溶菌酶缓蚀性能(图3)
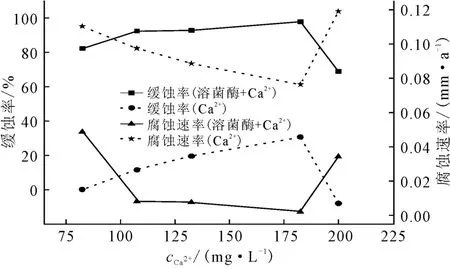
图3 不同钙离子质量浓度下溶菌酶的缓蚀率及腐蚀速率Fig.3 Corrosion inhibition efficiency and corrosion rate of lysozyme with different mass concentration of Ca2+
由图3可知,在钙离子质量浓度范围为107.57~182.57mg·L-1时,溶菌酶的缓蚀性能非常好,缓蚀率均超过90%;在钙离子质量浓度为182.57 mg·L-1时,缓蚀率达到最大,为99.18%,此时的腐蚀速率为0.0022mm·a-1。钙离子的有效质量浓度范围较大,在质量浓度范围为107.57~182.57mg·L-1时,缓蚀率相比仅投加酶的缓蚀率(图1,82.40%)均有较大提高。这是因为钙离子是很好的离子稳定剂[10],可以通过稳定酶的蛋白质结构达到提高酶活性的目的。
2.3 钙离子对脂肪酶性能的影响
2.3.1 脂肪酶酶活性(表5)

表5 钙离子质量浓度对脂肪酶酶活性的影响Tab.5 Effect of Ca2+mass concentration on the enzyme activity of lipase
由表5可知,钙离子质量浓度在107.57~282.57 mg·L-1的范围内,对脂肪酶的酶活性均有较大的提高。当钙离子质量浓度为182.57mg·L-1时,酶活性达到最高,为20 600U·g-1。
2.3.2 脂肪酶油脂降解能力(表6)
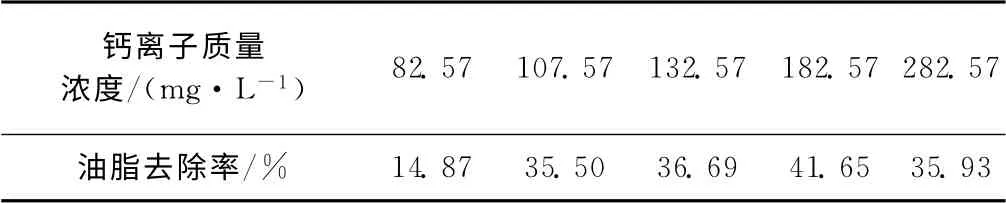
表6 钙离子质量浓度对脂肪酶油脂降解能力的影响Tab.6 Effect of Ca2+mass concentration on the lipid degradation ability of lipase
由表6可以知,当钙离子质量浓度为182.57 mg·L-1时,脂肪酶油脂降解能力最大,与酶活性实验结果一致。
2.3.3 脂肪酶缓蚀性能(图4)

图4 不同钙离子质量浓度下脂肪酶的缓蚀率及腐蚀速率Fig.4 Corrosion inhibition efficiency and corrosion rate of lipase with different mass concentration of Ca2+
由图4可知,当钙离子质量浓度为107.57mg·L-1时,相比仅投加脂肪酶的缓蚀效果(图2,88.32%)有所下降;当钙离子质量浓度范围为132.57~182.57 mg·L-1时与仅投加脂肪酶的缓蚀率相差很小;在钙离子质量浓度为182.57 mg·L-1时,缓蚀率达到最大,为92.12%,此时的腐蚀速率为0.0183mm·a-1;当钙离子质量浓度超过200mg·L-1时,脂肪酶的缓蚀率又有所下降,相比仅投加脂肪酶的缓蚀率有所降低。这可能是由于钙离子提高了水体的硬度,而在高硬度的水体中氯离子的腐蚀作用会被增大[18],且钙离子本身会引起结垢而加重腐蚀,会对脂肪酶的缓蚀作用起到一定的抵消效果。因此,在钙离子存在的情况下脂肪酶的缓蚀作用的提高并没有预期的效果好。
综上,钙离子对脂肪酶的影响较小,在选择钙离子浓度时应主要考虑不同浓度钙离子对溶菌酶的影响,其浓度只要不对脂肪酶起毒害作用即可。
2.4 正交实验结果与分析(表7)
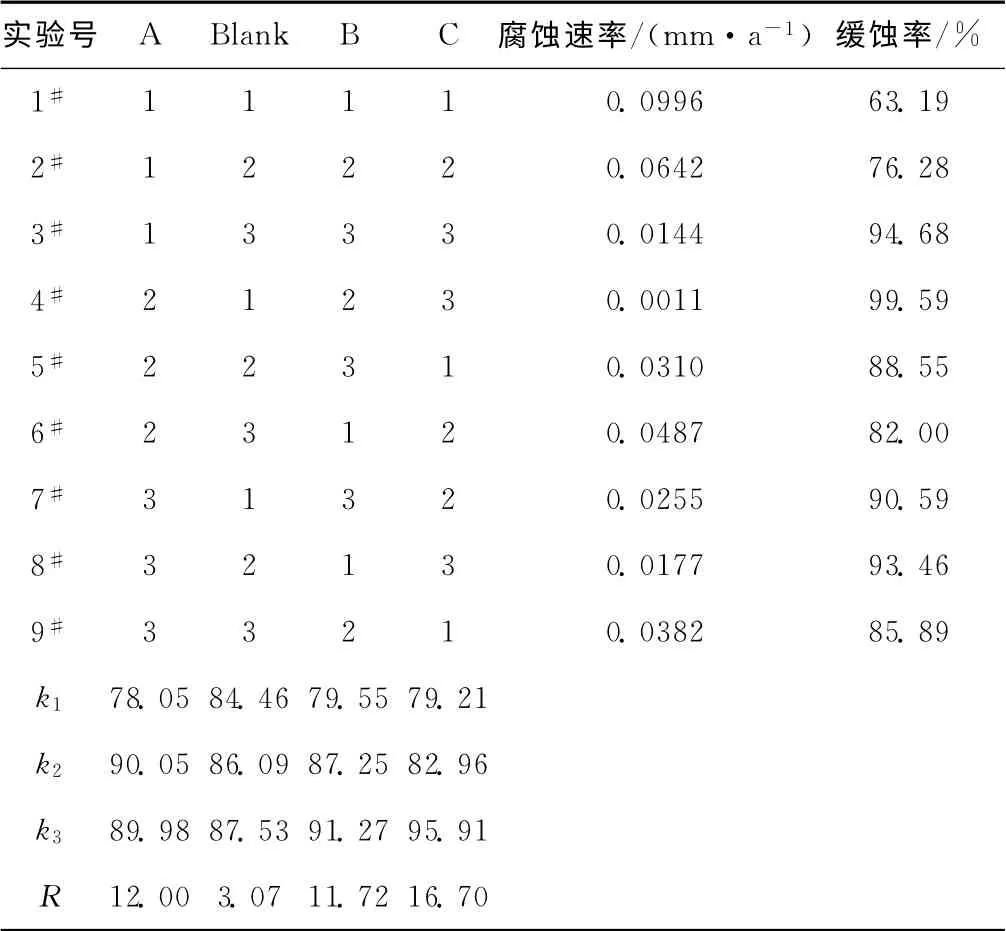
表7 正交实验结果与分析Tab.7 Results and analysis of orthogonal experiment
由表7可知,5#、6#、9#实验缓蚀率基本在80%以上,3#、4#、7#、8#实验缓蚀效果很稳定,缓蚀率在90%以上,碳钢的腐蚀速率也能控制在很低的水平。其中,4#实验的效果最为理想,缓蚀率达到99.59%,缓蚀效果总体良好。
由极差分析可知,最优方案为A2B3C3,即溶菌酶质量浓度为20mg·L-1、脂肪酶质量浓度为70mg·L-1、钙离子质量浓度为157.57mg·L-1。在最优方案下进行验证实验,在循环冷却水中碳钢挂片的腐蚀速率为0.0007mm·a-1,缓蚀率达99.79%。
从正交实验结果可以看出,在投加复合型生物酶缓蚀剂时,钙离子起的作用要比对单一酶时起的作用更大,说明钙离子对生物酶缓蚀剂可以起到很好的增效作用。
3 结论
(1)钙离子对溶菌酶的缓蚀性能提高较大,当钙离子质量浓度为182.57mg·L-1时,溶菌酶的缓蚀率达到99.18%,腐蚀速率为0.0022mm·a-1。
(2)钙离子虽然可以提高脂肪酶的酶活性,但几乎没有提高脂肪酶的缓蚀性能。
(3)当溶菌酶质量浓度为20mg·L-1、脂肪酶质量浓度为70mg·L-1、钙离子质量浓度为157.57mg·L-1时,缓蚀效果最佳,缓蚀率达99.79%,碳钢挂片的腐蚀速率为0.0007mm·a-1。
[1]段成龙,尚东华,刘博文,等.生物酶在循环冷却水中的缓蚀作用研究[J].广州化工,2013,41(22):64-67,70.
[2]方元超,梅丛笑,尹宁.溶菌酶及其应用前景[J].中国食品添加剂,1999,(4):39-43.
[3]BLAKE C C,KOENIG D F,MAIR G A,et al.Structure of hen egg-white lysozyme A three-dimensional Fourier synthesis at 2 Angstrom resolution[J].Nature,1965,206(4986):757-761.
[4]张胜利,陈贵连.微生物胞外脂肪酶研究进展[J].工业微生物,1990,20(5):29-37.
[5]MACRAE A R.Lipase-catalyzed inter esterification of oils and fats[J].JAOCS,1983,60(2):291-294.
[6]IBRAHIM C O,HISASHI S,NAOMICHI N.Hydrolysis of triglycerides by immobilized thermostable lipase from humicola lanuginosa[J].Agric Biol Chem,1988,52(1):99-105.
[7]周玉春.循环水系统缓蚀阻垢剂的研究[D].杭州:浙江大学,2004.
[8]王光辉,强敏,王光华,等.热电厂碱性净水脱除循环冷却水中Ca2+,Mg2+的研究[J].武汉科技大学学报,2001,24(2):138-141.
[9]李卫红.有色冶炼重金属净水回用研究[J].工业安全与环保,2002,28(11):14-17.
[10]赵明,李艳荣.循环水结垢和腐蚀的机理及其控制[J].油气储运,1998,17(2):25-30.
[11]于东润.常见二价金属离子对鸡溶菌酶蛋白结构稳定性的影响及其分子机制研究[D].沈阳:辽宁大学,2012.
[12]谢红伟.溶菌酶活力测定方法的改进[J].食品科学,2003,24(9):119-121.
[13]白光伟.以F68为模板剂介孔SiO2的合成及其对脂肪酶的固定化[D].济南:山东轻工学院,2010.
[14]林翠花,肖素荣,孟庆国.溶菌酶结构特点及其应用[J].潍坊学院学报,2005,5(2):108-110.
[15]李鹤,马力,王维香.溶菌酶的研究现状[J].食品研究与开发,2008,29(1):182-185.
[16]刘海洲,吴小飞,牛佰慧,等.脂肪酶在食品工业中的应用与研究进展[J].粮食加工,2008,33(5):55-57,77.
[17]赖晓芳,沈善瑞,王炜军,等.离子对萝卜中具有溶菌酶活性的几丁质结合蛋白活性的影响[J].江苏农业科学,2012,40(12):171-172.
[18]郭亚丽,于素青,奴尔江.循环水高硬度条件下氯离子的腐蚀控制[J].全面腐蚀控制,2010,24(3):25-28.

