轮状病毒结构蛋白自组装修饰金纳米粒子
(苏州百拓生物技术服务有限公司,江苏苏州215123)
金纳米粒子由于其独特的理化性质,在纳米生物医学领域得到了广泛的应用。病毒结构蛋白具有自组装能力,能把外源纳米粒子通过自组装包覆到病毒样颗粒(virus like particles,VLP)的内腔中,形成病毒蛋白-纳米材料复合物,并具有粒径均一、生物相容性好、表面具有丰富的化学基团可供修饰等特点,在纳米科学领域具有广阔的应用前景[1]。
在病毒的内壳结构蛋白中,与病毒基因组相互作用的肽链氨基末端会伸展出一段带正电荷的氨基酸,能把很长的基因组压缩折叠后包覆到病毒中[2]。利用这种能力,可以把外源治疗性基因装载到VLP中构建基因治疗载体[3]。除治疗性核酸外,人们尝试了装载其它具有诊疗功能的外源物质到VLP中,构建药物治疗或造影载体,Lewis 等[4]和Leong等[5]利用羧基化荧光基团Alexa Fluor 555 与豇豆花叶病毒(cowpea mosaic virus,CPMV)交联,构建了新生血管的靶向造影系统;Zhao等[6]利用重组表达的轮状病毒结构蛋白VP6交联阿霉素后进行体外组装,构建了肝癌细胞的靶向药物输运体系;Everts等[7]通过共价交联的方式,将金纳米粒子交联到腺相关病毒上,构建了肿瘤靶向热疗体系;Sun等[8]研究发现,不同粒径的金纳米粒子能诱导雀麦草花叶病毒(brome mosaic virus,BMV)组装,诱导病毒蛋白形成不同对称结构的VLP。
在将外源性的纳米粒子装载进VLP的过程中,静电相互作用、纳米粒子的形貌和尺寸对装载效率影响较大。目前,除金纳米粒子外,量子点[9]、四氧化三铁纳米粒子[10]等均是对纳米粒子进行仿基因组的负电修饰,诱导外壳蛋白进行组装,形成纳米复合材料[11-14]。鉴于此,作者采用原核重组表达的方法,获得轮状病毒结构蛋白VP6,利用其内腔表面带负电荷的特点[15],用聚乙酰亚胺(polyetherimide,PEI)还原法合成表面带正电荷的金纳米粒子,通过静电相互作用诱导VP6进行自组装,获得VP6包覆的金纳米复合材料,有望为靶向诊疗、病毒基础研究等方面提供新思路。
1 实验
1.1 材料、试剂与仪器
轮状病毒结构蛋白VP6基因(GenBank accession number:AY787645),全长1 356bp,编码397个氨基酸,分子量45kDa,来源于人类A 组轮状病毒TBChen株;限制性内切酶、T4DNA 连接酶,大连宝生物公司。
氯金酸、聚乙烯亚胺(PEI),阿尔法公司。
透射电镜,FEI公司;检测型凝胶电泳仪(7cm×12cm),上海六一仪器厂;聚丙烯酰胺凝胶电泳仪(20 cm×20cm)、紫外可见光谱仪,PE 公司;恒温摇床,上海一恒;低温高速离心机,Thermo;灭菌高压锅;细胞超声粉碎仪,新芝。
1.2 方法
轮状病毒结构蛋白VP6 的内腔是负电性的[15],不和基因组直接相连,而直接接触结构蛋白VP2。基于此,作者采用了和其它文献不同的诱导组装方式,首先对金纳米粒子进行PEI正电修饰,然后诱导VP6围绕金纳米粒子进行组装,如图1所示。
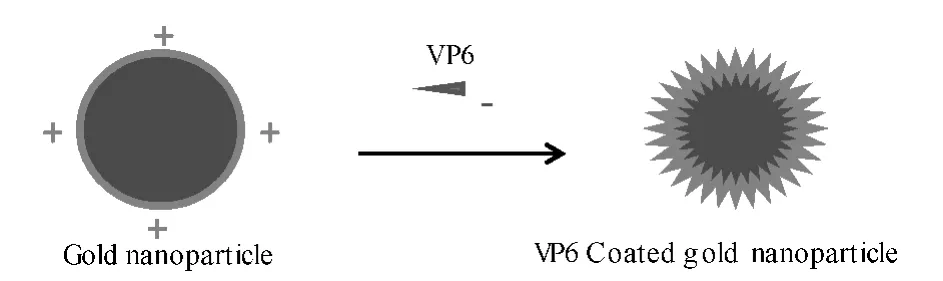
图1 VP6组装修饰金纳米粒子示意图Fig.1 Schematic diagram of gold nanoparticles modified by VP6
1.2.1 金纳米粒子的合成[16]
将25 mL 氯金酸(纯度99.99%,1.4 mmol·L-1)分别与0.9mL、0.7mL、0.5mL PEI(质量分数1%)混合,得到不同粒径的金纳米粒子,在80 ℃下剧烈搅拌2h,12 000r·min-1离心,水洗2遍,再离心,即得到水溶性的带正电荷的金纳米粒子。金纳米粒子的粒径由反应体系的PEI的量控制。
1.2.2 VP6的重组表达
质粒的构建和蛋白的表达[6]:培养的病毒经RTPCR 获得VP6 的编码基因。在正向引物(5′-ATCATATGGATGTTTGTATTCA-3′)和反向引物(5′-ATCCGCGGAGCTCCACCGCGGTGGC-3′)中分别引入限制性核苷酸内切酶位点NdeⅠ和SacⅠ(下划线)。VP6基因的PCR 产物经纯化后,用NdeⅠ/SacⅠ双酶切,制备插入基因片段。插入基因片段和载体基因片段经T4DNA 连接酶连接后,转化至大肠杆菌DH5α感受态细胞。经酶切鉴定,筛选阳性菌落,制备携带VP6编码基因的重组表达质粒pET-VP6,并对其进行核苷酸序列测定。核苷酸序列测定证明准确无误后,将pET-VP6转化至大肠杆菌BL21(DE3)感受态细胞,挑选阳性菌落接种于LB培养液(含200μg·mL-1氨苄青霉素)于37 ℃(12~16h)培养。8 000r·min-1离心10min,收集菌体,用超声裂解缓冲溶液(200mmol·L-1NaCl,50 mmol·L-1Tris,5%glycerol,5%Triton X-100,2mmol·L-1EDTA)悬浮,于冰水浴中超声破碎20 min(超声5s,暂停5s,功率400 W,超声探头直径10mm),12 000r·min-1离心15min,收集上清,沉淀(主要是包涵体蛋白)先用2 mol·L-1尿素洗涤,然后用8mol·L-1尿素溶解后,分装保存于-20 ℃冰箱,SDS-PAGE电泳检测表达产物。
蛋白的纯化:利用切胶的方法对蛋白进行纯化。在裂解产物的沉淀中检测到目标蛋白,所以可以判断蛋白以包涵体的形式表达。包涵体洗涤纯化后,溶解在8mol·L-1尿素中。溶解的蛋白经SDS-PAGE 凝胶分离(5%浓缩胶,10%分离胶),用150mmol·L-1的KCl显色,切下VP6所在的条带,装入透析袋(截留分子量8 000~14 000kDa)中,透析袋中加入不含SDS的电泳缓冲溶液。电泳(电压120 V,电流160 mA,4 ℃,3h)透析回收蛋白。电泳完后从透析袋中吸出透析液,装入另一透析袋中,用聚乙二醇20000浓缩蛋白。Bradford 法测定蛋白的浓度。甲醇沉淀法除去蛋白中的SDS:取100μL 1mg·mL-1纯化蛋白,加甲醇400μL、氯仿100μL、去离子水300μL,漩涡混匀。在12 000r·min-1条件下离心15min,此时蛋白在氯仿和甲醇/水相的分界处。轻轻吸去上清,加400μL甲醇,混匀,12 000r·min-1离心5min。此时蛋白沉降到管底,弃上清,加400μL 甲醇漂洗,12 000 r·min-1离心15 min。打开管盖,使甲醇自然挥发干,用8mol·L-1尿素溶解蛋白。
蛋白的复性:利用稀释-透析法对蛋白进行复性。将纯化的VP6蛋白溶液稀释到2mg·mL-1,加入到筛选出的复性液中,8 ℃复性24h,依次在1 mol·L-1、0.5mol·L-1和0mol·L-1(含50mmol·L-1Tris-HCl)的尿素复性液中进行透析复性,每次24h,最后用水进行透析,除去Tris-HCl。复性结束后将透析袋放入聚乙二醇20000中浓缩,12 000r·min-1离心去除沉淀。用蛋白分析试剂盒(Pierce)计算复性效率。
1.2.3 VP6包覆的金纳米复合材料的诱导组装
室温下,按n(金)∶n(VP6)=1∶20在碳酸钠-碳酸缓冲溶液(0.02mol·L-1,pH 值5.5)中诱导16h进行组装。
组装完成后于12 000r·min-1离心30min,水洗2次,用2%磷钨酸染色,进行透射电镜表征。
2 结果与讨论
2.1 金纳米粒子的紫外可见光谱分析
25mL氯金酸分别与0.9 mL、0.7 mL、0.5 mL PEI混合得到不同粒径的金纳米粒子,其紫外可见光谱见图2。
由图2 可知,随着PEI用量的减少,金纳米粒子的最大紫外吸收峰从528nm 红移到了533nm。
2.2 VP6蛋白的SDS-PAGE分析
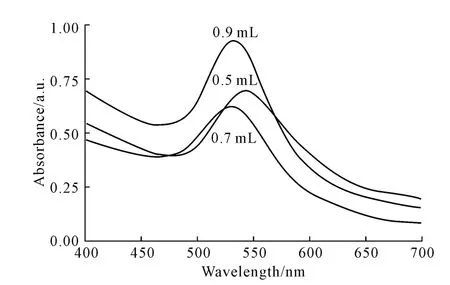
图2 不同粒径金纳米粒子的紫外可见光谱Fig.2 UV-Vis Spectra of gold nanoparticles with different particle sizes
采用SDS-PAGE检测表达和纯化的VP6,结果见图3。
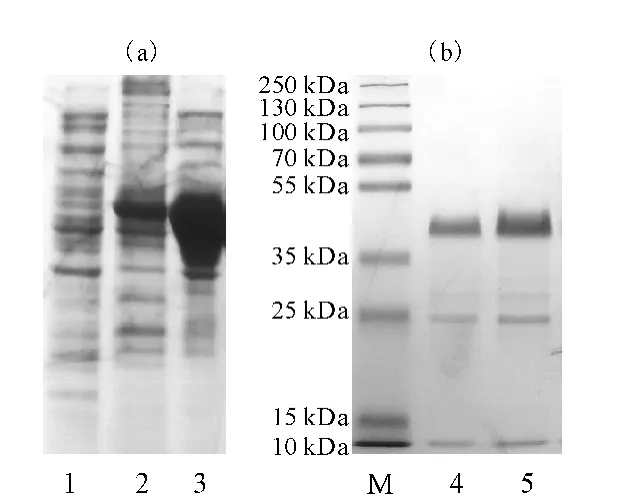
图3 表达(a)和纯化(b)的VP6的SDS-PAGE电泳图谱Fig.3 SDS-PAGE Electrophorogram of expressed(a)and purified(b)VP6
由图3可看出,VP6蛋白在大肠杆菌BL21(DE3)中获得了高效表达(条带2),主要以包涵体的形式存在(条带3)。用SDS-PAGE 电泳对洗涤后的包涵体进行进一步的纯化,将目的条带从胶上切下,经电泳回收后,用SDS-PAGE电泳检测纯化结果(条带4)。经复性后,采用Bradford法,通过蛋白分析试剂盒对复性效率进行计算:先用蛋白分析试剂盒制作牛血清白蛋白(BSA)的标准曲线并得到拟合方程,测定复性后的蛋白浓度,计算得到复性效率为32.38%。
2.3 VP6自组装修饰金纳米粒子的TEM 分析
将紫外吸收波长为533nm 的金纳米粒子与VP6混合,使VP6以金纳米粒子为核进行组装,组装完成后进行TEM 表征,结果见图4。
由图4可看出,金纳米粒子成功地对VP6进行了诱导组装,该组装方式主要是靠静电相互作用完成,即VP6上的负电荷和金纳米粒子表面的正电荷作用后进行组装。
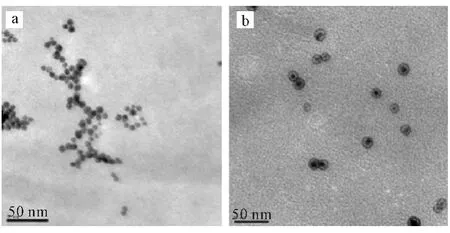
图4 金纳米粒子(a)及VP6自组装修饰金纳米粒子(b)的TEM 照片Fig.4 TEM Images of gold nanoparticles(a)and VP6 self-assembly modified gold nanoparticles
3 结论
通过轮状病毒结构蛋白VP6自组装的方式对金纳米粒子进行了修饰,获得了VP6包覆的金纳米复合材料。一方面,VP6蛋白的修饰可以改善金纳米粒子的生物相容性、分散性,并使其表面携带上丰富的化学基团(如氨基、羧基、巯基),方便进一步的化学修饰;另一方面,功能化的金纳米粒子也可以改变VP6蛋白的组装方式,如打破病毒的天然组装,使其组装成其它对称结构的VLP,这样的改变可能不止在癌症的诊断和治疗中有着潜在应用,在病毒本身的机制研究方面,如组装、感染途径、疫苗研究等方面也有可能带来潜在运用。
[1]GOICOCHEA N L,DE M,ROTELLO V M,et al.Core-like particles of an enveloped animal virus can self-assemble efficiently on artificial templates[J].Nano Letters,2007,7(8):2281-2290.
[2]BELYI V A,MUTHUKUMAR M.Electrostatic origin of the genome packing in viruses[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(46):17174-17178.
[3]GINN S L,ALEXANDER I E,EDELSTEIN M L,et al.Gene therapy clinical trials worldwide to 2012-An update[J].Journal of Gene Medicine,2013,15(2):65-77.
[4]LEWIS J D,DESTITO G,ZIJLSTRA A,et al.Viral nanoparticles as tools for intravital vascular imaging[J].Nature Medicine,2006,12(3):354-360.
[5]LEONG H S,STEINMETZ N F,ABLACK A,et al.Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles[J].Nature Protocol,2010,5(8):1406-1417.
[6]ZHAO Q H,CHEN W H,CHEN Y D,et al.Self-assembled viruslike particles from rotavirus structural protein VP6for targeted drug delivery[J].Bioconjugate Chemistry,2011,22(3):346-352.
[7]EVERTS M,SAINI V,LEDDON J L,et al.Covalently linked Au nanoparticles to a viral vector:Potential for combined photothermal and gene cancer therapy[J].Nano Letters,2006,6(4):587-591.
[8]SUN J S,DUFORT C,DANIEL M C,et al.Core-controlled polymorphism in virus-like particles[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(4):1354-1359.
[9]LI F,ZHANG Z P,PENG J,et al.Imaging viral behavior in mammalian cells with self-assembled capsid-quantum-dot hybrid particles[J].Small,2009,5(6):718-726.
[10]HUANG X L,BRONSTEIN L M,RETRUM J,et al.Self-assembled virus-like particles with magnetic cores[J].Nano Letters,2007,7(8):2407-2416.
[11]DANIEL M C,TSVETKOVA I B,QUINKERT Z T,et al.Role of surface charge density in nanoparticle-templated assembly of bromovirus protein cages[J].ACS Nano,2010,4(7):3853-3860.
[12]ELRAD O M,HAGAN M F.Mechanisms of size control and pol-ymorphism in viral capsid assembly[J].Nano Letters,2008,8(11):3850-3857.
[13]JOO K I,LEI Y N,LEE C L,et al.Site-specific labeling of enveloped viruses with quantum dots for single virus tracking[J].ACS Nano,2008,2(8):1553-1562.
[14]XU Y,YE J,LIU H J,et al.DNA-Templated CMV viral capsid proteins assemble into nanotubes[J].Chemical Communications,2008,(1):49-51.
[15]MATHIEU M,PETITPAS I,NAVAZA J,et al.Atomic structure of the major capsid protein of rotavirus:Implications for the architecture of the virion[J].EMBO J,2001,20(7):1485-1497.
[16]KIM K,LEE J W,LEE H B,et al.Novel fabrication of Au nanoparticle films on planar and curved surfaces of glass and fiber materials[J].Langmuir,2009,25(17):9697-9702.

