玉米样品前处理方法和掩蔽剂对ELISA检测玉米赤霉烯酮的影响
甄玉萍,裴世春*,王 岩,高建伟,李 妍
(齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006)
玉米样品前处理方法和掩蔽剂对ELISA检测玉米赤霉烯酮的影响
甄玉萍,裴世春*,王 岩,高建伟,李 妍
(齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006)
探讨粉碎时间、提取剂、掩蔽剂质量分数等因素对酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)法检测玉米赤霉烯酮的影响。结果表明,玉米样品粉碎时间180 s以上、70%甲醇溶液为提取剂、添加0.025%鱼皮胶的磷酸盐缓冲液为掩蔽剂时,检测结果最为稳定。本实验结果对高稳定性玉米赤霉烯酮检测ELISA试剂盒的开发具有参考价值。
真菌毒素;玉米赤霉烯酮;酶联免疫吸附分析法;定量检测
玉米赤霉烯酮(zearalenone,ZON)是常见的真菌毒素之一,常污染玉米、小麦、水稻等谷物,并通过加工过程会转移到食品和饲料中,最终通过食物链危害人类的健康[1-2]。因此,关于ZON的检测、去除及危害评估等方面[3-9]一直备受研究者们的关注,其中基于抗原抗体特异性反应的ZON检测酶联免疫吸附分析(enzymelinked immunosorbent assay,ELISA)法因其具有快速、简便、高通量等特点[4],已经广泛应用于农产品及相应食品中ZON毒素的检测[5-9],但是,ZON的快速ELISA检测方法在实际样品的定量分析过程中常发生测定值偏差较大的现象,产生这一现象的原因涉及到众多因素,其中样品前处理方法和样品基质对抗原抗体反应的影响可以认为是原因之一。虽然在提高样品前处理效果的方法中有应用超声波、微波、超临界等各种补助措施[10-14],但这些有悖于ELISA检测的快速简便的初衷,因此,在确保ELISA检测方法的简便、快速等特点的基础上如何通过改善样品前处理[15-17]和消除样品基质[18]的影响等措施提高ELISA检测稳定性相关研究已经被研究者所关注。
为此,本研究选取污染了ZON的玉米为实验材料,以ZON污染度的ELISA测定值为指标,分析玉米样品的粉碎程度、提取剂的选择、提取剂的体积分数、样品基质等因素对ELISA检测结果的影响,以期为有效提高ZON检测ELISA方法的稳定性提供实验性基础。
1 材料与方法
1.1 材料与试剂
玉米采自黑龙江省玉米种植区;甲醇、乙醇、乙腈、磷酸氢二钠、磷酸二氢钾、碳酸钠、碳酸氢钠、氯化钠、氯化钾、硫酸(均为分析纯) 天津市广成化学试剂有限公司;鱼皮胶(fish skin gelatin,FG)、四甲基联苯胺(tetramethylbenzidine,TMB)、ZON标准品美国Sigma公司;ZON偶联抗原(ZON-BSA) 北京中科汇文遗传技术发展中心;山羊抗小鼠IgG /辣根酶标记北京中杉金桥生物技术有限公司;抗ZON抗体 实验室自行制备[19-20]。
1.2 仪器与设备
VICTOR X4多功能酶标仪、Wahser400 96 孔洗板机 美国GE公司;S-4300扫描电镜 日本日立公司;Acquity超高效液相色谱-质谱(ultra-performance liquid chromatography-mass spectrometry,UPLC-MS)联用仪(光电二极管阵列检测器、Masslynx4.1工作站) 美国Waters公司;HH.CP-7培养箱 上海博迅实业有限公司医疗设备厂;PEFERENCE超纯水系统 美国密理博公司;FA1004N电子天平 上海菁海仪器有限公司;TG1650-WS台式高速离心机 上海汗诺仪器有限公司;HY-200筛子 北京祥宇伟业设备有限公司;AISITE高速万能粉碎机 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 缓冲液的配制
0.05 mol/L的碳酸盐缓冲液(carbonate buffer solution,CBS)的配制方法:取1.59 g碳酸钠、2.93 g碳酸氢钠,加到1 000 mL去离子水中,加酸或碱调节pH值至9.6,置于4 ℃保存,备用。
0.01 mol/L的磷酸盐缓冲液(phosphate buffer solution,PBS)的配制方法:取0.27 g磷酸二氢钾、1.42 g磷酸氢二钠、8.0 g氯化钠、0.2 g氯化钾,加到1 000 mL去离子水中,加酸或碱调节pH值至7.4,置于4 ℃保存,备用。
1.3.2 ZON检测间接竞争ELISA方法
采用CBS作为抗原ZON-BSA的包被稀释液,将其质量浓度稀释为0.25 μg/mL包被96 孔酶标板,4 ℃条件下过夜。用质量分数为5%的脱脂奶粉作为封闭液,37 ℃封闭1 h后洗板3 次,每孔加入50 μL标准品/样品,再加抗ZON单克隆抗体50 μL/孔,37 ℃孵育1 h后洗板3 次,加入以辣根过氧化物酶标记的山羊抗小鼠IgG 100 μL/孔,37 ℃孵育1 h后洗板3 次,加入TMB显色液100 μL/孔,显色15 min后,加入稀硫酸50 μL/孔作为终止液,用VICTOR X4多功能酶标仪在450 nm波长处测定OD值并计算样品中的毒素含量。
1.3.3 UPLC-MS法
UPLC条件:色谱柱为Waters Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm);流动相A为体积分数0.1%甲酸溶液,流动相B为乙腈;梯度洗脱条件为0~2 min,20% B;2~9 min,20%~95% B;9~9.1 min,95%~100% B;9.1~11 min,100% B;11~11.1 min,100%~20% B,11.1~13 min,20% B;流速0.3 mL/min;进样量10 μL;柱温40 ℃;样品室温度4 ℃;柱后分离进入质谱仪。
质谱条件:电离方式为电喷雾电离源;检测方式为负离子[M-H]-模式;锥孔电压40 V;毛细管电压3.0 kV;离子源温度100 ℃;脱溶剂气流速600 L/h;反吹气流量 10 L/h;质量扫描范围m/z 50~1 200。
1.3.4 粉碎样品
玉米采摘后晾干,取足量玉米用高速万能粉碎机对其进行磨碎并计时,计时时间分别为15、30、60、120、180、240 s。
1.3.5 粉碎样品颗粒分布的测定
按时间磨粉后取出粉碎样品,依次过20、40、60、80、100、120、140、160 目的筛子,然后分别称质量,计算每两个筛子之间的样品质量占总质量的百分比。
1.3.6 ZON的提取
用四分法分别从各时间段粉碎样品中取5 g样品,分别用50 mL体积分数为30%、50%、70%、90%的甲醇、乙醇、乙腈剧烈振荡5 min[21],然后4 000 r/min离心5 min,取上清液作为样品提取液,待用。以上步骤重复3 次。
1.3.7 添加FG对ELISA检测的影响
在0.05 mol/L的PBS溶液中,分别添加0%、0.001%、0.01%、0.1%、1%、10%的FG,用其作为掩蔽剂,将ZON标品的质量浓度以10 倍梯度稀释为100、10、1、0.1、0.01、0 ☒g/L,采用ELISA法进行测定。
1.3.8 FG掩蔽效果的测定
在1.3.7节测定结果的基础上,确定可用FG的范围,配制成稀释液作为掩蔽剂,将1.3.6节所提取的样品提取液平均分为2 份,一份添加体积均等的30 ☒g/L的ZON标准品,一份添加体积均等的0.05 mol/L的PBS溶液,然后均采用1∶9的比例对提取液用配制好的梯度稀释液进行稀释。采用酶联免疫法进行测定,添加毒素一组测定值为Cn(n≥1),未添加毒素一组测定值为Cn*(n≥1),用Cn-Cn*,所得数值与30 ☒g/L标准添加值进行比较。
1.3.9 回收率实验
在以上实验的基础上挑选几组粉碎时间,将每组粉碎时间下的样品均平均分为4 份,在前3 份样品中分别添加量为500、50、5 ☒g/L的ZON标准品,最后一份不加毒素做空白对照,采用以上经过多次实验得出的最佳提取条件进行提取,按照以上实验所得的最适ELISA方法和UPLC-MS法进行测定,分别计算其回收率,比较2 种检测方法的相关性。
2 结果与分析
2.1 粉碎时间与颗粒分布
玉米中ZON污染度的ELISA检测过程主要包括玉米样品粉碎、ZON毒素提取、提取液稀释、抗原抗体特异性反应等程序,其中玉米颗粒样品的粉碎是所有ZON检测方法中必须进行的一个过程,国内针对ZON的检测GB/T 23504—2009《食品中玉米赤霉烯酮的测定:免疫亲和层析净化高效液相色谱法》[22]规定,硬质的粮食是用高速万能粉碎机磨细后过1 mm的孔径筛,但具体磨细到什么程度没有界定,因此很难保障不同检测者处理样品时的一致性,进而有可能产生测定值的实验误差。
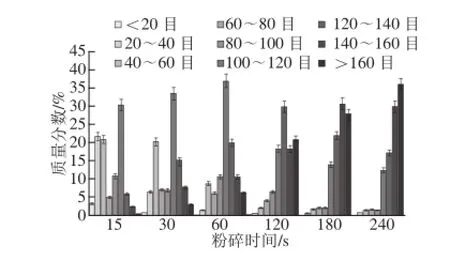
图1 不同粉碎时间对样品粒径质量分数的影响Fig.1 Effect of grinding time on the mass fraction of samples with different particle sizes
为了考察分析玉米粉碎程度对颗粒分布的影响,首先对粉碎时间与颗粒分布的相关性进行了测定,即利用高速万能粉碎机按不同时间粉碎玉米后过不同目数的筛子,分别称量后计算颗粒质量分配比例,其结果如图1所示,当粉碎时间从15 s延长到240 s时,小于100 目的大颗粒比例分别为61.21%、 41.06%、26.69%、13.04%、6.10%、4.95%,由此可知,随着粉碎时间的延长,大颗粒玉米粉所占比例逐渐减小。当粉碎时间超过120 s时,表现为细颗粒开始明显增加,但还有部分100~120 目的颗粒,而在粉碎180 s以后,颗粒分布发生显著变化,过160 目及更细的颗粒比例超过了其他颗粒的质量。由此实验数据可知,随着磨碎时间的不断延长,不同颗粒大小的玉米粉分布具有显著的变化,考虑到玉米不同大小颗粒的比例分布会产生比表面积的差异,进而有可能对玉米样品中提取ZON的效果产生影响,因此有必要在实验基础上分析ELISA检测ZON过程中样品粉碎时间对ZON检测结果的影响,进而为国内ZON检测GB/T 23504—2009中硬质玉米样品的粉碎方法的完善提供科学的实验依据。
为了更好地观察各时间段粉碎玉米颗粒的状态,将粉碎样品在10 Pa真空度、15 mA离子电流条件下镀金160 s,用扫描电镜在20 kV加速电压条件下进行观察,其结果如图2所示。当粉碎时间少于120 s时有大量的大颗粒玉米,当粉碎时间在180 s以后大颗粒玉米显著减少,小颗粒玉米粉增多且分布较为均匀。结合图1的颗粒分布测定结果可知,玉米的粉碎时间在180 s时,过100目以上的颗粒质量合计超过93.90%,其中过160目以上的颗粒占总质量的27.70%;玉米的粉碎时间在240 s时,过100 目以上的颗粒质量合计达到95.05%,其中过160 目的颗粒占总质量的35.82%。玉米的粉碎时间在180 s以上时虽然超过160 目以上的颗粒分布随着粉碎时间的延长而增加,但是超过100 目以上的颗粒质量总和没有显著变化,趋于稳定状态。

图2 不同粉碎时间对玉米颗粒分布的影响Fig.2 Effect of grinding time on the particle size distribution of corn powder
2.2 添加FG对ELISA检测的影响研究
用ELISA方法检测玉米中的ZON毒素,一般程序是将玉米粉碎后用有机溶剂对毒素进行提取,然后对提取液进行稀释后直接进行测定,这一过程中提取液及样品基质成分会影响ELISA的测定结果,因为在利用有机溶剂提取后的溶液中,会含有许多大分子蛋白、脂肪、色素等,这些成分甚至样品溶液的pH值等都会非特异的影响抗体对抗原的亲和作用,这种影响会降低抗体与抗原的结合能力,进而降低免疫检测方法的灵敏度和可靠性。
消除基质影响是免疫检测方法应用到实际样品检测中的重要保证,在传统方法中,多采用稀释法,降低这些基质成分的质量浓度来保证检测方法的可靠性,但是,仅仅依靠单纯的稀释待检测样品的浓度并不能从根本上解决这些基质成分的干扰,为此,于春娣等[23]试图采用不同的掩蔽剂消除样品提取液中基质对检测的影响,发现利用0.5%的FG-PBS在检测西维因时克服基质影响方面效果较好,但是,此种方法是否也同样适用于ZON的检测中的基质影响消除,未有定论。
本实验采用在PBS溶液中添加不同质量分数鱼皮胶的方法,用添有不同质量分数鱼皮胶的PBS溶液稀释ZON标准品,经过与抗原的竞争和抗体的特异性的结合,最后测得吸光度,分别建立标准曲线。其结果如图3所示,将鱼皮胶添加量定在0~10%,当鱼皮胶添加到10%时,高质量浓度鱼皮胶本身就会对ELISA产生影响,而且随着ZON含量的降低,鱼皮胶对抗原抗体的竞争性反应影响增大。用添加鱼皮胶为0%的PBS溶液作为空白对照,添加的鱼皮胶在1~10%时,对低于1 ☒g/L的ZON测定值具有显著性影响,而当鱼皮胶添加至0.1%以下时,对利用ELISA方法测定ZON含量结果的影响明显减小,因此在利用ELISA检测ZON过程中,对鱼皮胶的使用不应该超过0.1%。

图3 添加不同质量分数的鱼皮胶作为标品稀释液建立标准曲线Fig.3 Standard curves established using 10-fold serial dilutions of fish skin gelatin in PBS buffer
2.3 FG的掩蔽效果与添加质量分数的研究
为了验证鱼皮胶是否能作为玉米提取液的掩蔽剂以及在稀释液中添加多少质量分数的鱼皮胶可以达到掩蔽的效果,按1.3.8节所述实验进行测定与计算,其结果如图4所示。当添加鱼皮胶的质量分数为0.1%、0.025%、0.006 3%、0.001 6%、0.000 39%的PBS溶液作为稀释液时,测定结果分别为25.80、26.18、27.50、28.18、30.23、32.46 ☒g/L,随着添加鱼皮胶质量分数的增大,掩蔽剂的效果逐渐增强,但是在添加到0.1%时测定结果超过了标准添加值,表现为鱼皮胶本身对ELISA测定结果产生了一定的影响,而当添加鱼皮胶的量为0.025%时,与标准添加值30 ☒g/L无显著性差异,说明该添加量既对ELISA测定没有影响,又可以消除基质的干扰,有效提高了检测精密度,当添加鱼皮胶的量为0.006 3%时,与标准添加值差异显著性较添加量为0.025%时略微增大,因此可知当添加鱼皮胶的质量分数为0.025%时,可显著消除样品基质对ELISA测定的影响。本实验结果与于春娣等[23]所做有一定的差异性,前人在建立基质中的西维因标准曲线时,采用的西维因含量是0.1~1 000 ☒g/L,添加FG-PBS的量为0.5%,本研究在建立ZON的标准曲线时,因ZON在谷物中的含量大多较低,国标[24]中对其限量有严格的要求,所以将其测定范围定在0~100 ☒g/L之间,在此测定范围内得出添加FG-PBS的量为0.025%为最佳。因此,本实验中ELISA标准曲线制作过程中的标准毒素稀释液和样品提取液的稀释液均使用质量分数为0.025%的FG-PBS溶液。
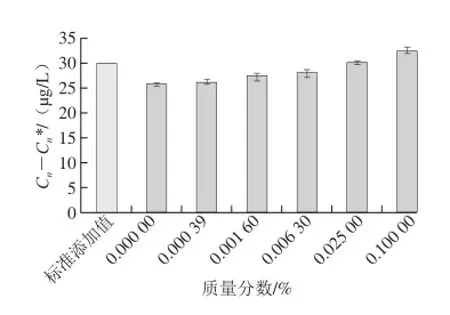
图4 添加不同质量分数的FG对消除样品基质的影响Fig.4 Effect of fish skin gelatin concentration on the elimination of sample matrix
2.4 粉碎时间及提取溶剂对ELISA测定的影响
在2.1、2.2节和2.3节分析的基础上,为了进一步考察颗粒分布及提取溶剂对ELISA检测玉米中ZON含量的影响,选择用不同体积分数的甲醇、乙醇、乙腈对不同粉碎时间的玉米样品进行毒素提取,并利用ELISA进行定量测定,其结果如表1所示。

表1 粉碎时间及提取溶剂对ELISA测定天然玉米样品中ZON含量的影响Table 1 Effect of grinding time and extraction solvents on the content of ZON determined by ELISA☒g/L
在2.1节中已得知随着粉碎时间的延长,过100 目筛子以上的颗粒累积总和由38.79%增加至95.05%,等到120 s之后,粉碎颗粒大于100 目的累积总和均在86.96%以上。为了进一步验证玉米粉碎程度对ELISA检测玉米中ZON的影响,在图1粉碎分布实验结果的基础上,对不同粉碎时间的样品进行了ELISA检测分析。
从表1可以看出,ELISA检测ZON的测定值随着玉米粉碎时间的延长,测定值在不断的增加,从180 s时开始ZON的测定值和240 s时的测定值差异不显著,结合图1颗粒分布可知,玉米粉碎180 s后,100目以上颗粒分布趋于稳定,因此,100目以上颗粒百分比可以作为一项ELISA检测玉米中ZON毒素的一个处理指标。
提取溶剂的选择也可从表1看出,根据数值进行比较,提取剂效果最好的是甲醇,其次是乙腈,乙醇也可进行毒素提取,但其提取效果不如前两者。从溶剂的体积分数来看,70%的甲醇溶液为效果最佳,当粉碎时间达到180 s以后,50%的甲醇与70%的甲醇提取效果差异性并不十分显著,但是在120 s以前有差异,说明当甲醇体积分数为50%时可能会对不同粉碎时间的样品产生误差。当甲醇体积分数过高达到90%时,提取毒素效果反而减弱,其减弱的机理有待于进一步研究。张艺兵等[25]在利用ELISA方法检测ZON时,也采用了70%的甲醇溶液作为提取剂,刘涛[21]在谷物中ZON毒素ELISA的研究中,同样使用了甲醇作为提取剂,本实验结果也进一步证明了体积分数为70%的甲醇作为提取剂效果最佳。
为了验证用ELISA检测样品中ZON含量结果的准确性,将粉碎时间为180 s,用70%甲醇作为提取剂的提取液采用UPLC-MS和Masslynx4.1工作站进行定性定量测定与分析,其结果如图5、6所示。图5为添加1 000 ☒g/L的ZON毒素标准品图谱,可以看出ZON的流出时间为5.66 min,对应的其定性分子[M-H]-为m/z 317.15[26]。图6为天然含有ZON的玉米样品测定图谱,同样在5.66 min时出峰,且具有相同的分子离子峰([M-H]-,m/z 317.15),与ZON的标准品图谱一致。将该标准毒素进行梯度稀释后分别用UPLC-MS进行检测,测得数值绘制标准曲线,将天然含有ZON的玉米样品带入标准曲线中进行计算,最终求得样品中ZON的污染量为750.84 ☒g/L,该数值与用ELISA测得的数值无显著性差异,证明了以上结果的准确性。
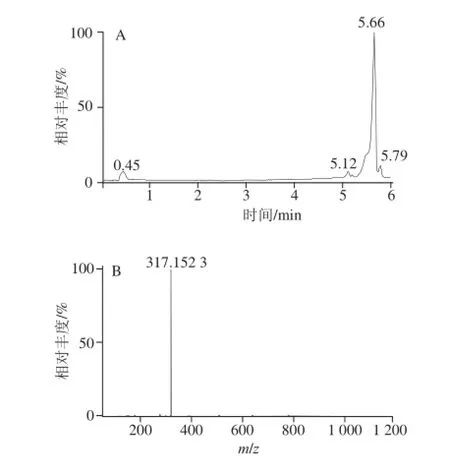
图5 ZON标准品离子流(A)及质谱图(B)Fig.5 Ion current chromatogram and mass spectrum of ZON standard

图6 玉米样品离子流图(A)及质谱图(B)Fig.6 Ion current chromatogram and mass spectrumof corn sample
2.5 添加回收实验结果
为了验证表1采用ELISA方法所得的测定值的精确性和准确性,选取120、180、240 s粉碎时间的粉碎样品,在粉碎样品中添加不同水平的ZON标准品,用ELISA和UPLC同时进行检测,分别计算其回收率,其结果如表2所示。由表2可知,ELISA测定值与UPLC检测值基本一致,两种检测方法的回收率均在87%以上,因此,ELISA方法可应用于样品中ZON的检测。

表2 ZON添加回收实验结果Table 2 Recoveries of ZON from spiked corn
3 结 论
综合上述实验结果可知,当粉碎时间180 s以上,提取剂为甲醇,体积分数为70%,样品稀释液使用含有FG的质量分数为0.025%的PBS溶液时,玉米中ZON毒素的ELISA检测结果最为稳定。本研究进一步明确了玉米粉碎程度、提取剂、掩蔽剂等因子对ELISA检测ZON含量的影响,优化了检测效果,本实验为高稳定性检测ZON ELISA试剂盒的开发提供了基础性数据,同时也为优化其他真菌毒素的ELISA检测方法的研究提供了新思路。
参考文献:
[1] 邓友田, 袁慧. 玉米赤霉烯酮毒性机理研究进展[J]. 中国卫生检验杂志, 2007, 28(2): 89-92.
[2] RASHEDI M, SOHRABI H R, ASHJAAZADEH M A, et al. Zearalenone contamination in barley, corn, silage and wheat bran[J]. Toxicology and Industrial Health, 2012, 28(9): 779-782.
[3] 路子显, 伍松陵, 孙长坡. 玉米赤霉烯酮生物合成和降解的研究进展[J]. 中国生物工程杂志, 2011, 31(2): 116-123.
[4] 李志勇. 食品安全ELISA快速检测技术[M]. 北京: 中国标准出版社, 2009.
[5] 王元凯, 王君, 王雨晨, 等. 玉米赤霉烯酮单克隆抗体的制备及间接竞争ELISA检测方法的建立[J]. 微生物学通报, 2011, 38(12): 1793-1880.
[6] JOSEPHS R D, SCHUHMACHER R, KRSKA R. International interlaboratory study for the determination of the Fusarium mycotoxins zearalenone and deoxynivalenol in agricultural commodities[J]. Food Additives and Contaminants, 2001, 18(5): 417-430.
[7] TRUCKSESS M W, POHLAND A E. Methods and method evaluation for mycotoxins[J]. Molecular Biotechnology, 2002, 22: 287-292.
[8] 曹纪亮, 孔维军, 杨美华, 等. 真菌毒素快速检测方法研究进展[J].药物分析杂志, 2013, 33(1): 159-164.
[9] CHOI E H, KIM D M, CHOI S W, et al. Optimisation and validation of a fluorescence polarisation immunoassay for rapid detection of zearalenone in corn[J]. International Journal of Food Science and Technology, 2011, 46(10): 2173-2181.
[10] 田苗苗. 新型样品前处理方法在食品分析中的应用[D]. 长春: 吉林大学, 2014: 90-97.
[11] OVEISI M R, HAJIMAHMOODI M, MEMARIAN S, et al. Determination of zearalenone in corn flour and a cheese snack product[J]. Food Additives and Contaminants, 2005, 22(5): 443-448.
[12] PALLARONI L, von HOLST C. Comparison of alternative and conventional extraction techniques for the determination of zearalenone in corn[J]. Analytical and Bioanalytical Chemistry, 2003,376(6): 908-912.
[13] WINKLER J, KERSTEN S, MEYER U, et al. Residues of zearalenone(ZEN), deoxynivalenol (DON) and their metabolites in plasma of dairy cows fed Fusarium contaminated maize and their relationships to performance parameters[J]. Food and Chemical Toxicology, 2014,65(3): 196-204.
[14] LIAO C D, LIN H Y, CHIUEH L C, et al. Simuitaneous quantification of aflatoxins, ochratoxin a and zearalenone in cereals by LC-MS/ MS[J]. Journal of Food and Drug Analysis, 2011, 19(3): 259-268.
[15] 陈树兵, 单正军, 胡秋辉, 等. 食品中农药残留检测的样品前处理技术[J]. 中国卫生检验杂志, 2004, 25(12): 152-155.
[16] 谢刚. 粮食污染主要真菌毒素的研究[D]. 成都: 四川大学, 2005: 11-18.
[17] 伏春燕. 玉米中三种真菌毒素检测方法的研究[D]. 泰安: 山东农业大学, 2014: 20-35.
[18] 董婷婷. 西维因农药残留酶联免疫检测方法的研究[D]. 天津: 天津科技大学, 2009: 24-45.
[19] 甄玉萍, 裴世春, 高建伟, 等. 基于HTS-ELISA的单克隆抗体分泌杂交瘤细胞筛选技术进展[J]. 食品安全质量检测学报, 2014, 5(7):1960-1964.
[20] PEI Shichun, ZHEN Yuping, GAO Jianwei, et al. Screening and monitoring zearalenone-producing Fusarium species by PCR and zearalenone by monoclonal antibodies in feed from China[J]. Food Additives and Contaminants, 2014, 7(4): 37-41.
[21] 刘涛. 谷物中玉米赤霉烯酮酶联免疫检测方法的研究[D]. 天津: 天津科技大学, 2007: 23-47.
[22] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 23504—2009 食品中玉米赤霉烯酮的测定免疫亲和层析净化: 高效液相色谱法[S]. 北京: 中国标准出版社, 2009.
[23] 于春娣, 慕鸿雁, 赵梅, 等. 直接竞争酶联免疫法测定西维因残留[J].药物分析杂志, 2008, 33(11): 266-270.
[24] 卫生部. GB 2761—2011 食品中真菌毒素限量[S]. 北京: 中国标准出版社, 2011.
[25] 张艺兵, 鲍蕾, 褚庆华. 农产品中真菌毒素的检测分析[M]. 北京: 化学工业出版社, 2005.
[26] de BOEVREA M, di MAVUNGUA J D, MAENE P, et al. Development and validation of an LC-MS/MS method for the simultaneous determination of deoxynivalenol, zearalenone, T-2-toxin and some masked metabolites in different cereals and cereal-derived food[J]. Food Additives and Contaminants, 2012, 29(5): 819-835.
Effect of Pretreatment Methods and Masking Agents for on the Detection of Zearalenone in Corn by ELISA
ZHEN Yuping, PEI Shichun*, WANG Yan, GAO Jianwei, LI Yan
(College of Food and Biological Engineering, Qiqihar University, Qiqihar 161006, China)
In the present study, the effects of grinding time, extraction solvents and different amounts of masking agents on the detection of zearalenone were explored. The most stable results were obtained when corn samples were ground for more than 180 s, and then extracted with 70% methanol using phosphate buffer solution with 0.025% fish skin gelatin as the masking agent. The findings of this study can provide a reference for the development of highly stable ELISA kit for the detection of zearalenone in corn.
mycotoxin; zearalenone; enzyme-linked immunosorbent assay; quantitative detection
R446.61
A
1002-6630(2015)16-0255-06
10.7506/spkx1002-6630-201516049
2015-04-28
齐齐哈尔大学研究生创新科研项目(YJSCX2014-015X);国家科技基础性工作专项(2013FY113400);黑龙江省教育厅科学计划项目(12541871)
甄玉萍(1990—),女,硕士研究生,研究方向为食品营养与安全。E-mail:15146694340@139.com
*通信作者:裴世春(1966—),男,教授,博士,研究方向为食品营养与安全。E-mail:1079481030@qq.com

