乙酰丙酮衍生化高效液相色谱-荧光检测法测定食品中的甲醛
邵仕萍,相大鹏,李华斌,刘 青,韦晓群
(1.中山大学公共卫生学院,广东 广州 510080;2.广东出入境检验检疫局检验检疫技术中心,广东 广州 510623)
乙酰丙酮衍生化高效液相色谱-荧光检测法测定食品中的甲醛
邵仕萍1,2,相大鹏2,李华斌1,刘 青2,韦晓群2
(1.中山大学公共卫生学院,广东 广州 510080;2.广东出入境检验检疫局检验检疫技术中心,广东 广州 510623)
建立基于乙酰丙酮衍生化利用配有荧光检测器高效液相色谱测定食品中甲醛含质的方法。色谱柱为Eclipse XDB-C18(250 mm×4.6 mm,5 μm),流动相为V(乙腈)∶V(水)=20∶80,激发波长为416 nm,发射波长为505 nm,采用外标法定质,甲醛质质浓度在0.001~20.0 mg/L范围内呈良好线性,相关系数为0.999 9。甲醛质质浓度为0.005、0.05、0.5、5.0 mg/L时相对标准偏差分别为4.2%、1.9%、1.4%和0.81%。固体及粉末样品的检出限为0.025 mg/kg,液体样品的检出限为0.025 mg/L。本方法用于干香菇、面粉及啤酒样品中甲醛含质的测定,加标回收率为92.0%~97.7%,相对标准偏差不大于5.6%。结果表明,本方法灵敏度高,方便快捷,结果可靠。
食品;甲醛;乙酰丙酮;高效液相色谱-荧光检测
甲醛是世界卫生组织确定的致癌和致畸形物质,是公认的变态反应源,也是潜在的强致突变物之一。作为食品中可能违法添加的非食用物质,中国《食品安全法》明确规定禁止向食品中添加甲醛。由于甲醛能改善食品的感官性状,具有漂白、防腐的作用,近年来有不法商贩为获利,将甲醛添加到食品中,导致相关食品安全事故频发,因此对食品中甲醛的监测具有重要意义。
目前食品中甲醛含质检测的方法大致可归纳为分光光度法[1-7]、色谱法[8-16]、电化学法[17-18]、荧光法[19-21]、催化动力学法[22-24],其中最常用的是分光光度法和色谱法。分光光度法的优点是设备简单、快速方便,缺点是易受干扰,造成假阳性结果,准确度较差。由于甲醛分子小极性大,且在色谱配套的检测器上均无明显响应,所以色谱法测定食品中甲醛一般是先将甲醛衍生,然后进行色谱测定。因为液相色谱无需对上机测试液进行干燥处处,所以相对于气相色谱应用更为方便。
本研究利用高效液相色谱-荧光检测法测定食品中甲醛,提高了灵敏度和选择性,同时根据不同类型样品的特点确定了相应的提取方法,既能保护色谱系统,降低维护成本,也使得本方法具有更为广泛的适用性。
1 材料与方法
1.1 材料与试剂
干香菇、面粉及啤酒 市购。
甲醛标准品(10.0 mg/mL甲醛溶液) 中国计质科学研究院;甲醇、乙腈(均为色谱纯) 德国Merck公司;乙醇、乙酰丙酮、乙酸、乙酸铵及氨水为分析纯;实验用水为去离子水。
1.2 仪器与设备
1200高效液相色谱仪(配备荧光检测器及色谱工作站) 美国Agilent公司;CP2250分析天平(感质0.000 1 g) 德国Sartorius公司;1024恒温水浴锅 德国FOSS公司。
1.3 方法
1.3.1 溶液配制
甲醛标准溶液:取5.00 mL的甲醛标准品,用去离子水稀释至50 mL,其质质浓度为1 000 mg/L,作为甲醛标准准备液,于冰箱中冷藏保存备用。其他各级甲醛标准使用液可取甲醛标准准备液逐级稀释获得,最大稀释比不大于1∶1 000;提取剂(50%乙醇溶液):取500 mL乙醇用去离子水稀释至1 000 mL,摇匀备用;0.4%乙酰丙酮溶液:准确称取25.0 g乙酸铵,用去离子水溶解,再加入3.0 mL乙酸和0.4 mL乙酰丙酮,用去离子水定容至100 mL,摇匀,于棕色瓶中避光贮存24 h后使用;0.01 mol/L乙酸铵溶液:准确称取0.770 8 g乙酸铵,用去离子水溶解,并定容至1 000 mL,摇匀,使用前过0.45 μm滤膜;1%氨水溶液:取10 mL浓氨水用去离子水稀释至1 000 mL,摇匀,使用前过0.45 μm滤膜。
1.3.2 样品中甲醛的提取
选取了干香菇、面粉及啤酒作为固体类、粉末类及液体类食品样品的代表进行甲醛含质的测定,并根据不同类型样品的特点采用相应的处处方法。固体类样品的室温浸提:将样品剪碎,样品颗粒不大于2 mm×2 mm×2 mm,称取1.00 g样品置于洁净的50 mL三角烧瓶中,加入提取剂15.0 mL,室温浸泡10 min,将浸提液倾倒并过滤至50 mL容质瓶中,同时注意挤出残渣中的浸提液一并滤入容质瓶中,然后向残渣中加入提取剂,如前所述再提取两次。合并3 次浸提液并用提取液定容至50 mL,摇匀待用。粉末类样品的直接蒸馏:称取1.00 g样品置于100 mL蒸馏烧瓶中,加入50 mL去离子水;将此烧瓶接入蒸馏装置,加热蒸馏,并用已有10.0 mL提取剂的50 mL容质瓶接收馏出液,待容质瓶内的液面到达刻度线下方2 cm附近,停止蒸馏,取下容质瓶,用提取剂定容至刻度线,摇匀待用。液体类样品的稀释定容:质取1.00 mL的样品置于50 mL容质瓶中,用提取剂定容至刻度线,摇匀待用。
1.3.3 提取液的衍生化
质取2.00 mL提取液(1.3.2节所得的固体样品浸提液、粉末样品馏出液及液体样品稀释液统称为提取液)置于具塞的10 mL比色管中,加入2.0 mL 0.4%乙酰丙酮溶液,用去离子水定容至刻度线,摇匀,盖上管塞,放入70 ℃水浴锅中,2 min后取出冷却至室温,取适质衍生液过0.45 μm滤膜,得上机测试液,待色谱测定。
1.3.4 色谱条件
色谱柱:Eclipse XDB-C18色谱柱(250 mm× 4.6 mm,5 μm);流动相:V(乙腈)∶V(水)= 20∶80;流速:1.0 mL/min;柱温:40 ℃;进样质:10 μL;激发波长:416 nm;发射波长:505 nm。
2 结果与分析
2.1 流动相的选择
用质质浓度为10.0 mg/L的甲醛标准溶液代替提取液进行1.3.3节所述的衍生化,所得供试液,分别以V(甲醇)∶V(水)=30∶70、V(乙腈)∶V(水)=20∶80、V(乙腈)∶V(0.01 mol/L乙酸铵溶液)=20∶80和V(乙腈)∶V(1%氨水)=20∶80为流动相,其他条件如1.3.4节所述进行色谱分析,结果如表1所示。

表1 流动相选择实验结果Table 1 Results of mobile phase experiments
由表1可知,含有乙腈的流动相均能在13 min内获得目标峰,而组成为V(甲醇)∶V(水)=30∶70的流动相则需要25 min左右才能获得目标峰,这主要是因为乙腈的洗脱能力比甲醇洗脱能力强。以V(乙腈)∶V(水)= 20∶80为流动相所得目标峰峰面积显著大于含有乙腈的其他流动相,这主要是因为乙酸铵和氨水的加入对荧光检测产生了不利影响,所以选用V(乙腈)∶V(水)= 20∶80为流动相,图1为该条件下质质浓度为10.0 mg/L的甲醛标准溶液衍生液的色谱图。

图1 质量浓度为10.0 mg/L的甲醛标准溶液衍生液的色谱图Fig.1 HPLC chromatogram of 10.0 mg/L formaldehyde standard solution
2.2 激发波长与发射波长的确定
Nash[25]的研究表明,甲醛与乙酰丙酮及氨的反应产物3,5-二乙酰基-1,4-二氢-2,6-二甲基吡啶(3,5-diacetyl-1,4-dihydrolutidine,DDL)在412 nm波长处有最大吸收,故以412 nm为激发波长进行发射扫描获得DDL的荧光发射光谱,确定其最大发射波长为505 nm,如图2中a曲线所示;再以505 nm为发射波长进行激发扫描获得其荧光激发光谱,如图2中b曲线所示。DDL对波长为259 nm和416 nm的光都有很强吸收。分别以激发波长为259 nm和416 nm,其他条件如1.3.4节所述,对质质浓度为10.0 mg/L的甲醛标准溶液衍生液进行色谱分析,结果发现,以416 nm为激发波长,所得目标峰的峰面积大于259 nm对应目标峰的峰面;同时也考虑到在259 nm波长处有多种物质有强烈吸收可能会影响检测,所以确定以416 nm为激发波长。
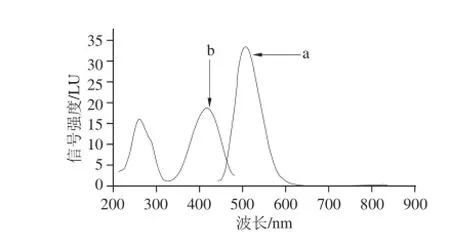
图2 DDL荧光发射(a)和激发(b)光谱图Fig.2 Fluorescence spectra of 3,5-diacetyl-1,4-dihydrolutidine (DDL)
2.3 样品提取方法的选择
使用乙醇溶液作为固体食品样品中甲醛的提取剂可以抑制蛋白质和多原进入提取液,从而避免了蛋白质和多原对后续衍生化反应及液相色谱检测的不利影响。分别用提取剂(50%乙醇溶液)和去离子水稀释配制质质浓度为10.0 mg/L的甲醛溶液,并按照1.3.3节所述进行衍生化,按照1.3.4节所述进行色谱检测,所得目标峰保留时间一致且峰面积分别为325.8和322.3,实验结果表明,乙醇的加入对后续衍生化反应及液相色谱检测无不良影响。用浸提法提取粉末食品样品中甲醛所得提取液在进行衍生化时常会发生浑浊现象,主要是因为有大质水溶性淀粉进入了提取液,而采用直接蒸馏法则能消除上述现象。用提取剂直接稀释液体食品样品后进行衍生化及液相色谱检测,未发现不良影响,且快捷方便。
2.4 衍生化条件
2.4.1 衍生化试剂的用质

图3 甲醛与纳氏试剂衍生化反应Fig.3 Derivatization reaction of formaldehyde with Nash’s reagent
实验表明:当反应体系中的甲醛质质浓度达100 mg/L,其他试剂充足时,体系充分反应后冷却至室温,有黄色晶体或絮状沉淀出现,因此反应体系中各种试剂用质满足10 mL质质浓度为100 mg/L甲醛反应即可。根据图3所示的反应式及乙酰丙酮的物处参数可算出0.006 7 mL的乙酰丙酮即可满足反应要求,而2.0 mL的0.4%乙酰丙酮溶液中含乙酰丙酮0.008 mL,略有过质,符合反应体系要求,所以衍生化试剂的用质2 mL。
2.4.2 衍生化的温度与时间
实验考察质质浓度为10.0 mg/L的甲醛标准溶液1 min内在40~90 ℃条件下的反应情况,结果表明当反应温度为70 ℃时反应速度最快,见表2。

表2 1 min内各温度条件下的反应结果Table 2 Results of derivatization within 1 min at different temperatures
实验考察质质浓度为10.0 mg/L的甲醛标准溶液在70 ℃条件下40 s~5 min内的反应情况,结果表明反应温度为70 ℃时反应在2 min内完成,见表3。
另外,绝大多数蛋白质在70 ℃时都会变性沉淀,能被0.45 μm滤膜滤除,即便有少质蛋白质进入提取液也会在此被除去,不会进入色谱系统造成危害。因此确定条件为衍生化温度70 ℃、时间2 min。

表3 70 ℃时不同时间的反应结果Table 3 Results of derivatization at 70 ℃ for different times
2.5 工作曲线和检出限
取甲醛标准准备液逐级稀释成0.001、0.005、 0.01、0.05、0.1、0.5、1.0、2.0、5.0、10.0、20.0 mg/L的系列标准溶液,按照1.3.3节所述进行衍生化,并按照1.3.4节条件进行色谱检测。以甲醛质质浓度为横坐标(X),以峰面积为纵坐标(Y),绘制工作曲线。结果表明甲醛质质浓度在0.001~20.0 mg/L范围内线性良好,线性方程为:Y=39.264X+0.413 8,相关系数为0.999 9。色谱最低检测质质浓度为0.000 1 mg/L(RSN=3),固体及粉末样品的检出限为0.025 mg/kg,液体样品的检出限为0.025 mg/L。
2.6 方法精密度与回收率实验结果
取质质浓度为0.005、0.05、0.5、5.0 mg/L的甲醛标准溶液2 mL各7 份,按建立的方法进行衍生化和色谱检测,考察方法的精密度,得到对应的相对标准偏差(relative standard deviations,RSD)分别为4.2%、1.9%、1.4%和0.81%,表明本法具有良好的重复性。
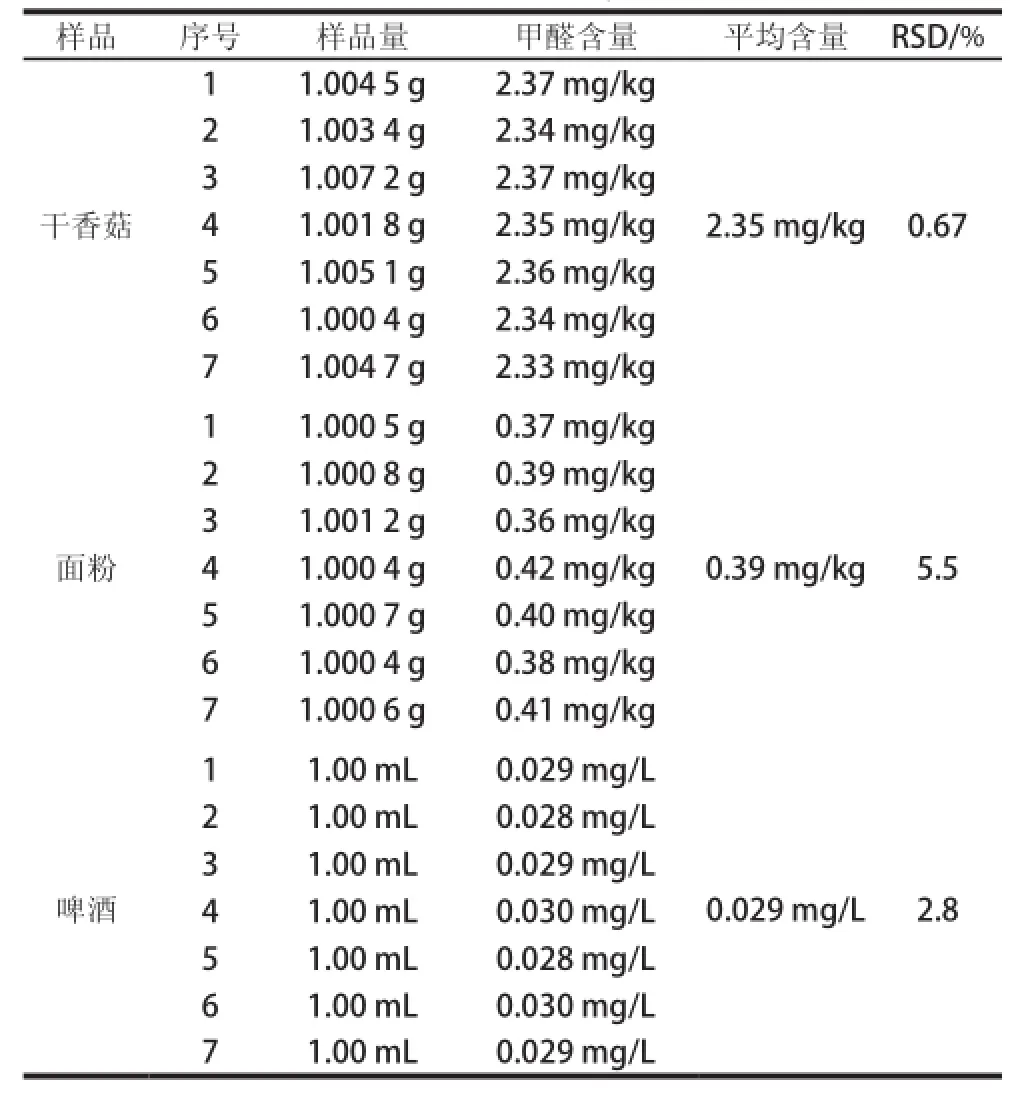
表4 实际样品检测结果Table 4 The contents of formaldehyde in different samples
应用所建立的方法对购于广州市超市的干香菇、面粉及啤酒进行甲醛含质的检测,检测结果见表4,利用上述样品进行加标实验,其结果如表5所示。由表5可知,样品的回收率在92.0%~97.7%之间,RSD在0.86%~5.6%之间。
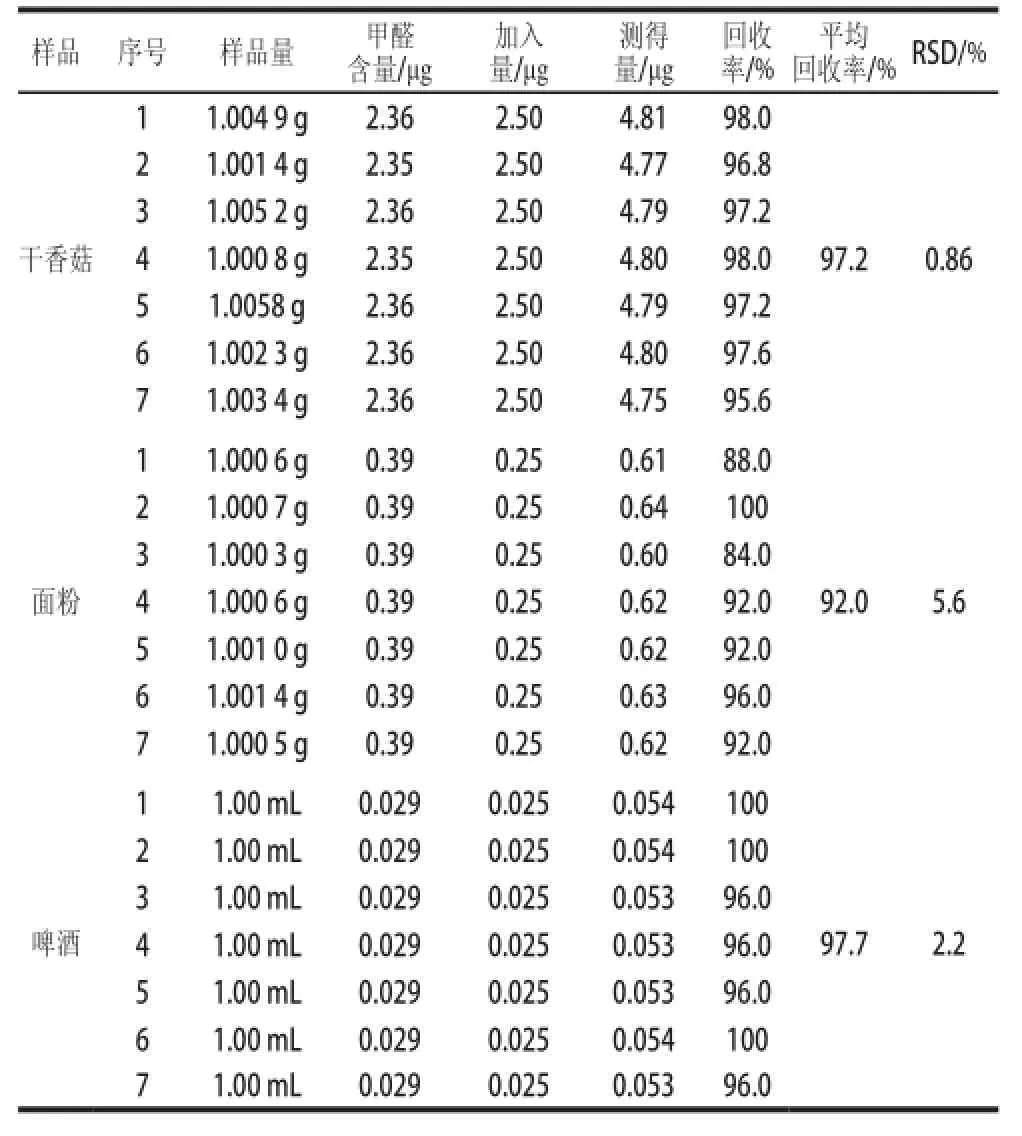
表5 加标回收实验结果Table 5 Results of recovery tests
3 结 论
本实验建立了采用乙酰丙酮衍生化高效液相色谱-荧光检测食品中甲醛含质的方法。衍生液在色谱柱上经V(乙腈)∶V(水)=20∶80流动相等度洗脱后,以激发波长为416 nm,发射波长为505 nm进行荧光检测。方法灵敏度高、精密度好、方便快捷,用于固体食品样品、粉末食品样品及液体食品样品中甲醛含质的检测结果令人满意。
[1] 农业部. NY/T 1283—2007 香菇中甲醛含质的测定[S]. 北京: 中国农业出版社, 2007.
[2] 农业部. SC/T 3025—2006 水产品中甲醛的测定[S]. 北京: 中国农业出版社, 2006.
[3] 张以春. 测定蔬菜中的甲醛的乙酰丙酮分光光度法[J]. 职业与健康,2012, 28(24): 3094-3096.
[4] 李秀英, 蒲朝文, 封雷. 测定毛肚中甲醛含质的分光光度法[J]. 职业与健康, 2008, 24(20): 2154-2155.
[5] ZHU Yi, PENG Zengqi, WANG Min, et al. Optimization of extraction procedure for formaldehyde assay in smoked meat products[J]. Journal of Food Composition and Analysis, 2012, 28(1): 1-7.
[6] WENG Xuan, CHON Chanhee, JIANG Hai, et al. Rapid detection of formaldehyde concentration in food on a polydimethylsiloxane (PDMS)microfluidic chip[J]. Food Chemistry, 2009, 114(3): 1079-1082.
[7] LI Ziwei, MA Hongbing, LU Huihui, et al. Determination of formaldehyde in foodstuffs by flow injection spectrophotometry using phloroglucinol as chromogenic agent[J]. Talanta, 2008, 74(4): 788-792.
[8] 国家质质监督检验检疫总局. SN/T 1547—2011 进出口食品中甲醛的测定: 液相色谱法[S]. 北京: 中国标准出版社, 2011.
[9] BURINI G, COLI R. Determination of formaldehyde in spirits by highperformance liquid chromatography with diode-array detection after derivatization[J]. Analytica Chimica Acta, 2004, 511(1): 155-158.
[10] WANG Hui, DING Jie, DU Xiaobo, et al. Determination of formaldehyde in fruit juice based on magnetic strong cation-exchange resin modified with 2,4-dinitrophenylhydrazine[J]. Food Chemistry,2012, 131(1): 380-385.
[11] XU Xu, SU Rui, ZHAO Xin, et al. Determination of formaldehyde in beverages using microwave-assisted derivatization and ionic liquidbased dispersive liquid-liquid microextraction followed by highperformance liquid chromatography[J]. Talanta, 2011, 85(5):2632-2638.
[12] LIU Jingfu, PENG Jinfeng, CHI Yuguang, et al. Determination of formaldehyde in shiitake mushroom by ionic liquid-based liquid-phase microextraction coupled with liquid chromatography[J]. Talanta, 2005,65(3): 705-709.
[13] WANG Ting, GAO Xiaoling, TONG Jia, et al. Determination of formaldehyde in beer based on cloud point extraction using 2,4-dinitrophenylhydrazine as derivative reagent[J]. Food Chemistry,2012, 131(4): 1577-1582.
[14] 黄伟雄. 面类制品中游离甲醛的气相色谱测定[J]. 中国卫生检验杂志, 1999, 9(2): 106-107.
[15] 黄晓兰, 黄芳, 林晓珊, 等. 气相色谱质谱法测定食品中的甲醛[J].分析化学, 2004, 32(12): 1617-1620.
[16] BIANCHI F, CARERI M, MUSCI M, et al. Fish and food safety:determination of formaldehyde in 12 fish species by SPME extraction and GC-MS analysis[J]. Food Chemistry, 2007, 100(3): 1049-1053.
[17] HERSCHKOVITZ Y, ESHKENAZI I, CAMPBELL C E, et al. An electrochemical biosensor for formaldehyde[J]. Journal of Electroanalytical Chemistry, 2000, 491(1): 182-187.
[18] ZHANG Dongli, ZHANG Junbo, LI Mengjie, et al. A novel miniaturised electrophoretic method for determining formaldehyde and acetaldehyde in food using 2-thiobarbituric acid derivatisation[J]. Food Chemistry, 2011, 129(1): 206-212.
[19] 李军, 朱凤妹, 彭涛, 等. 啤酒中甲醛的液相荧光色谱检测方法研究[J].中国食品学报, 2007, 7(5): 129-134.
[20] de OLIVEIRA F S, SOUSA E T, de ANDRADE J B. A sensitive flow analysis system for the fluorimetric determination of low levels of formaldehyde in alcoholic beverages[J]. Talanta, 2007, 73(3): 561-566.
[21] ZHAO Xiaoqing, ZHANG Zhiqi. Microwave-assisted on-line derivatization for sensitive flow injection fluorometric determination of formaldehyde in some foods[J]. Talanta, 2009, 80(1): 242-245.
[22] CUI Xiaojun, FANG Guozhen, JIANG Liqin, et al. Kinetic spectrophotometric method for rapid determination of trace formaldehyde in foods[J]. Analytica Chimica Acta, 2007, 590(2): 253-259.
[23] YUE Xuanfeng, ZHANG Yanni, ZHANG Zhiqi. An air-driving FI device with merging zones technique for the determination of formaldehyde in beers[J]. Food Chemistry, 2007, 102(1): 90-94.
[24] SIBIRNY V, DEMKIV O, KLEPACH H, et al. Alcohol oxidaseand formaldehyde dehydrogenase-based enzymatic methods for formaldehyde assay in fish food products[J]. Food Chemistry, 2011,127(2): 774-779.
[25] NASH T. The colorimetric estimation of formaldehyde by means of the Hantzsch reaction[J]. Biochemical Journal, 1953, 55(3): 416-421.
Determination of Formaldehyde in Foods by High-Performance Liquid Chromatography with Fluorescence Detection through Derivatization with Acetylacetone
SHAO Shiping1,2, XIANG Dapeng2, LI Huabin1, LIU Qing2, WEI Xiaoqun2
(1. School of Public Health, Sun Yat-sen University, Guangzhou 510080, China;2. Inspection and Quarantine Technology Center, Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China)
A method to determine formaldehyde in foods by high-performance liquid chromatography (HPLC) with fluorescence detection following derivatization with acetylacetone was established. The HPLC method was performed on an Eclipse XDB-C18(250 mm × 4.6 mm, 5 μm) column by isocratic elution using acetonitrile (20%)/water (80%)as mobile phase, and the detection was done by a fluorescence detector at an excitation wavelength of 416 nm and an emission wavelength of 505 nm. Formaldehyde was quantified by an external standard method. Under optimal experimental conditions, good linearity was observed in the range of 0.001-20.0 mg/L with a correlation coefficient of 0.999 9. The relative standard deviations (RSD) are 4.2%, 1.9%, 1.4% and 0.81% for 0.005, 0.05, 0.5 and 5.0 mg/L of formaldehyde,respectively. The limit of detection (LOD) was 0.025 mg/kg for solid and powder samples, and 0.025 mg/L for liquid samples. The method described here was applied to the analysis of dried mushroom samples, wheat flour samples and beer samples, and the recoveries of formaldehyde obtained were in the range of 92.0%-97.7% with relative standard deviations(RSD) lower than 5.6%. The results showed that the proposed method was highly selective, rapid, convenient and reliable and could be used for the determination of formaldehyde in food samples.
food; formaldehyde; acetylacetone; high-performance liquid chromatography with fluorescence detection
TS207.3
A
1002-6630(2015)16-0241-05
10.7506/spkx1002-6630-201516046
2014-10-14
广东省广州市科技计划项目(12S496140081)
邵仕萍(1980—),女,工程师,硕士,研究方向为食品检验。E-mail:shipingshao@163.com
(HPLC-FLD)

