肾小管功能在亚临床糖尿病肾病诊断价值中的初步探讨
张祎 杨菊红 郑妙艳 王颖 任慧珠 徐延光 杨艳辉 程静丽
韩菲 杨笑云 陈莉明 常宝成 单春艳 杨立成
·短篇论著·
肾小管功能在亚临床糖尿病肾病诊断价值中的初步探讨
张祎 杨菊红 郑妙艳 王颖 任慧珠 徐延光 杨艳辉 程静丽
韩菲 杨笑云 陈莉明 常宝成 单春艳 杨立成
目的观察2型糖尿病患者的肾小管功能,分析肾小管损伤标记物与亚临床糖尿病肾病(DN)的关系。方法298例2型糖尿病患者根据24 h尿微量白蛋白(UMA)和估算的肾小球滤过率(GFR)分为对照组(NC组,正常白蛋白尿及正常滤过率,n=100)、亚临床DN组(SDN组,正常白蛋白尿高滤过率,n=87)和早期DN组(EDN组,微量白蛋白尿,n=111)。应用免疫透射比浊法检测24 h UMA、尿视黄醇结合蛋白(RBP)、尿β2-微球蛋白(β2-MG),生化法测定尿N-乙酰-D-氨基葡萄糖苷酶(NAG)、β-半乳糖苷酶(GAL),分析各组肾小管损伤标记物及其与亚临床DN的关系。结果与NC组相比, SDN组NAG较高(χ2=9.032,P<0.01),而与EDN组差异无统计学意义;EDN组RBP水平明显高于NC组及SDN组(χ2=56.341,31.955,P均<0.01);NC组、SDN组、EDN组GAL、β2-MG水平呈升高趋势,但差异无统计学意义。与NC组相比,SDN组及EDN组近端肾小管功能异常率较高(分别为59%,82%,78.2%,χ2=42.658,P<0.01)。SDN组肾小管损伤标记物中一项或两项异常者的比例高于NC组及EDN组。肾小管损伤标记物中两项异常者有发生亚临床DN的风险[优势比(OR)=2.9,P=0.005],但经校正年龄、性别、糖尿病病程、总甘油三酯、总胆固醇、高密度脂蛋白-胆固醇、糖化血红蛋白、体重指数后,差异无统计学意义(OR=1.7,P>0.05)。结论肾小管损伤可能对早期肾功能减退的判断较肾小球损伤更重要,尿白蛋白正常但GFR升高的亚临床DN患者肾小管损伤标记物的水平升高及种类增多。
亚临床糖尿病肾病;肾小管损伤标记物;肾小球滤过率;微量白蛋白尿
随着糖尿病患病率的急剧增加,糖尿病肾病(DN)已经成为终末期肾脏疾病的最主要原因[1]。由于缺乏有效的治疗手段,因此强调对DN的早期预防、早期诊断、早期治疗。微量白蛋白尿是目前临床诊断DN的最早依据,然而,糖尿病患者一旦出现微量白蛋白尿,就意味着肾脏已经出现了不同程度的结构损伤,主要表现为肾小球基底膜增厚、系膜细胞增生及系膜基质合成增加,即使经过积极的治疗,10年内仅20%~25%的患者尿微量白蛋白(UMA)降至正常,30%~35%的患者长期维持在微量白蛋白尿阶段,30%~40%的患者逐渐进展至大量白蛋白尿[2]。肾脏在高血糖等致病因素作用下尚未出现明显的结构改变之前,处于自我功能代偿阶段,按DN的Mogensen分期,即UMA升高前的高滤过率期。如果将UMA升高作为临床DN的标志,那么UMA尚未升高的功能代偿阶段就称为亚临床DN。在这一时期,机体将发生一系列病理生理变化,如:肾小球滤过率增加、血流动力学改变、肾组织不同程度缺血、缺氧、肾素-血管紧张素-醛固酮系统活性增强,从而影响患者肾小管功能。因此,探讨更早期的DN诊断方法具有重要的临床意义。本文回顾性分析了亚临床DN和微量白蛋白尿期DN患者肾小管功能的指标变化,为早期识别亚临床DN提供参考。
1 对象与方法
1.1 研究对象 选取2013年4月至2014年4月于天津医科大学代谢病医院住院治疗的2型糖尿病患者298例,按24 h UMA和Cockcroft-Gault公式估算的肾小球滤过率(eGFR)分为3组:正常白蛋白尿及正常滤过率组(UMA<30 mg/24 h,90 ml·min-1·1.73 m-2≤eGFR<120 ml·min-1·1.73 m-2)100例,其中男54例,女46例,平均年龄(54.7±8.1)岁,设为对照组(NC组);正常白蛋白尿高滤过率组(UMA<30 mg/24 h,eGFR≥120 ml·min-1·1.73 m-2)87例,其中男51例,女36例,平均年龄(52.5±8.4)岁,设为亚临床糖尿病肾病组(SDN组);微量白蛋白尿组(30 mg/24 h≤UMA<300 mg/24 h)111例,其中男77例,女34例,平均年龄(55.7±10.4)岁,设为早期糖尿病肾病组(EDN组)。排除急性感染、急性心脑血管事件、糖尿病酮症、继发性高血压、先于糖尿病发生的原发性高血压、非糖尿病性肾病、肾小球肾炎及其他系统性疾病。所有研究对象均未服用影响尿白蛋白和肾功能的药物,如非甾体类抗炎药、血管紧张素转换酶抑制剂、血管紧张素受体阻断剂、大剂量利尿剂等。所有患者均签署知情同意书。
1.2 方法
1.2.1 血生化指标检测 所有患者禁食、禁水8 h,次日清晨空腹取血,由天津医科大学代谢病医院检验科采用酶法测定血肌酐和甘油三酯、总胆固醇、高密度脂蛋白-胆固醇、低密度脂蛋白-胆固醇、极低密度脂蛋白水平,高效液相法测定HbA1c。
1.2.2 24 h UMA测定 受试者血糖控制平稳后,于动态血压监测当日及次日分别留取24 h尿,排除尿路感染、月经期,留尿前避免剧烈运动,适量饮水。应用免疫透射比浊法检测UMA,取两次平均值,参照Mogensen DN分期,UMA<30 mg/24 h 为正常白蛋白尿;30 mg/24 h≤UMA<300 mg/24 h 为微量白蛋白尿;UMA≥300 mg/24 h 为大量白蛋白尿[3]。
1.2.3 晨尿测定 受试者血糖控制平稳后,晨起空腹留取中段尿,采用免疫透射比浊法测定尿视黄醇结合蛋白(RBP),生化法测定尿N-乙酰-D-氨基葡萄糖苷酶(NAG)、β-半乳糖苷酶(GAL)。尿RBP、NAG、GAL的正常值范围分别为0~0.7 mg/L、0.3~12 mg/L、0~15 mg/L,超出正常值范围视为异常。
1.2.4 随机尿测定 弃去晨起第一次尿,留取上午 9∶00点前的任一次尿,应用免疫透射比浊法测定β2-微球蛋白(β2-MG)。β2-MG的正常参考上限值为0.3 mg/L,超过上限值视为异常。
1.2.5 eGFR测定 eGFR 通过内生肌酐清除率来表示。Cockcroft-Gault公式估算内生肌酐清除率=(140-年龄)×体重(kg)/[72×血肌酐(mg/dl)]×0.85(女性)[4]。

2 结果
2.1 一般资料比较 3组间年龄、性别、糖尿病病程、总胆固醇、低密度脂蛋白-胆固醇、HbA1c均无明显差异,与NC组相比,SDN组及EDN组甘油三酯、高密度脂蛋白-胆固醇、极低密度脂蛋白、体重指数、体表面积均较高(P均<0.01),但SDN组及EDN组间差异无统计学意义。与SDN组相比,NC组及EDN组血肌酐水平较高(P均<0.01),但NC组及EDN组间差异无统计学意义(表1)。
2.2 肾小管损伤标记物比较
2.2.1 肾小管损伤标记物含量比较 与NC组相比,SDN组及EDN组RBP、NAG水平均升高(P均<0.01),但SDN组与EDN组间差异无统计学意义;EDN组RBP水平明显高于NC组及SDN组(P<0.01)。NC、SDN、EDN组GAL、β2-MG水平呈升高趋势,但差异无统计学意义(表2)。
2.2.2 近端肾小管功能异常率比较 将尿GAL、RBP、NAG、β2-MG均正常者视为近端肾小管功能正常,有一项不正常者视为近端肾小管功能异常。SDN组、EDN组近端肾小管功能异常率(分别为78.2%,82%)明显高于NC组(59%),见表2。
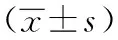
表1 3组一般资料比较
注:NC组:对照组;SDN组:亚临床糖尿病肾病组;EDN组:早期糖尿病肾病组;eGFR:估算的肾小球滤过率;UMA:尿微量白蛋白;TG:甘油三酯;TC:总胆固醇;HDL-C:高密度脂蛋白-胆固醇;LDL-C:低密度脂蛋白-胆固醇;VLDL:极低密度脂蛋白;BMI:体重指数;Scr:血肌酐;BSA:体表面积;与NC组相比,aP﹤0.05,bP﹤0.01;与SDN组相比,dP﹤0.01;e:秩和检验统计检验值为χ2
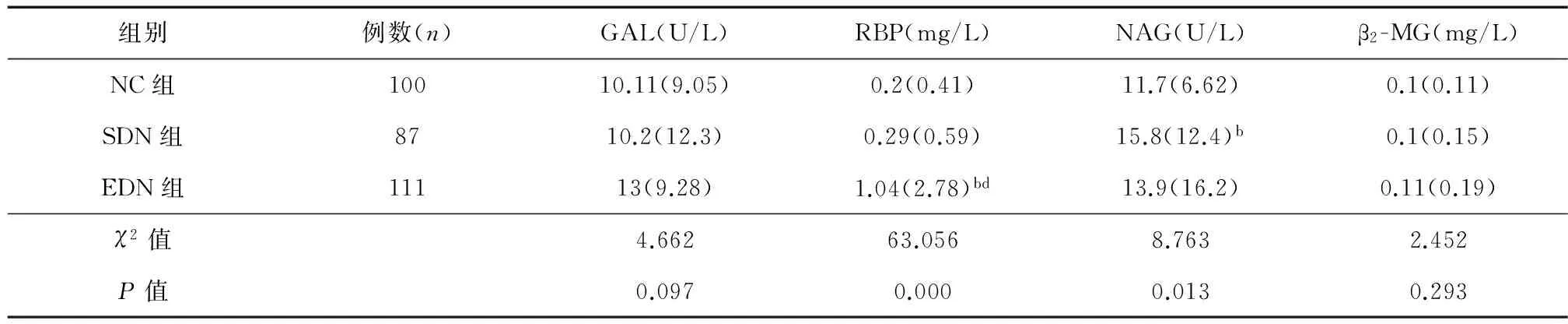
表2 肾小管损伤标记物含量比较[M(QR)]
注:NC组:对照组;SDN组:亚临床糖尿病肾病组;EDN组:早期糖尿病肾病组;与NC组相比,bP﹤0.01;与SDN组相比,dP﹤0.01;GAL:β-半乳糖苷酶;RBP:尿视黄醇结合蛋白;NAG:尿N-乙酰-D-氨基葡萄糖苷酶;β2-MG:β2-微球蛋白
2.2.3 肾小管损伤标记物的异常项数比较 3组间肾小管损伤标记物的异常项数经卡方检验差异有统计学意义(χ2=42.658,P<0.01)。其中与NC组相比,SDN组及EDN组异常项数差异均有统计学意义(χ2=8.984,28.824,P均<0.05)。SDN组与EDN组相比差异有统计学意义(χ2=15.373,P<0.01)。SDN组肾小管损伤标记物中一项或两项升高的比例高于其余两组(表3)。
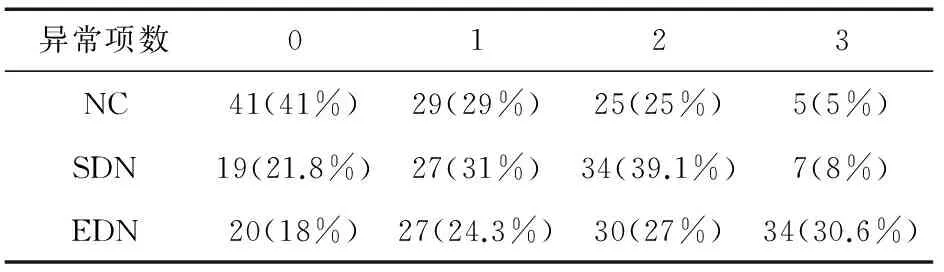
表3 肾小管损伤标记物异常项数比较
注:NC组:对照组;SDN组:亚临床糖尿病肾病组;EDN组:早期糖尿病肾病组;0:β-半乳糖苷酶、尿视黄醇结合蛋白、尿N-乙酰-D-氨基葡萄糖苷酶、β2-微球蛋白均无异常;1:有1项异常;2:有2项异常;3:有3项异常或均异常
2.3Logistic回归分析 将298例患者按肾小管损伤标记物的异常项数重新分为4组,以相关变量最低分组为参照,计算每组的优势比(OR)值和95%可信区间(CI),应用Logistic回归,分析发生亚临床DN的风险。随着肾小管损伤标记物异常项数的增多,发生亚临床DN的危险性增加。肾小管损伤标记物中两项异常者发生亚临床DN的风险增加(OR=2.9,P=0.005),但经校正年龄、性别、糖尿病病程、甘油三酯、总胆固醇、高密度脂蛋白-胆固醇、HbA1c、体重指数后,差异无统计学意义(OR=1.7,P>0.05),见表4。
3 讨论
微量白蛋白尿是临床诊断早期肾病的主要依据,但糖尿病患者一旦出现微量白蛋白尿,即使经过积极治疗,也无法使大多数患者得到有效逆转,因此,寻找更为早期的DN诊断依据具有重要的临床意义。
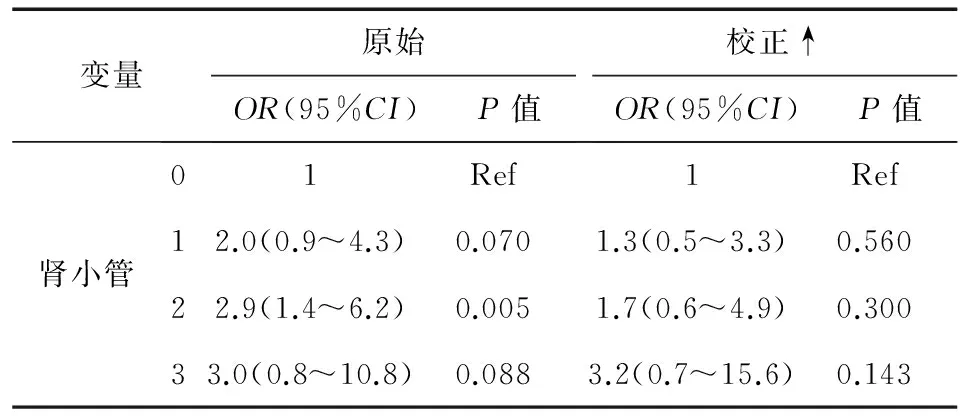
表4 肾小管损伤标记物异常项数对亚临床DN的预测分析
注:DN:糖尿病肾病;95%CI:95%可信区间;Ref:参照;↑:经年龄、性别、糖尿病病程、总甘油三酯、总胆固醇、高密度脂蛋白-胆固醇、HbA1c、体重指数校正;0:β-半乳糖苷酶、尿视黄醇结合蛋白、尿N-乙酰-D-氨基葡萄糖苷酶、β2-微球蛋白均无异常;1:有1项异常;2:有2项异常;3:有3项异常或均异常
目前认为,DN的发生是遗传因素和环境因素长期综合作用的结果。血流动力学异常、代谢紊乱、肾素-血管紧张素-醛固酮系统的激活以及细胞因子等均在DN的发生、发展中起重要作用。在这些因素的作用下,肾脏长期处于“高压力、高灌注、高滤过”状态,久而久之会对肾脏固有细胞造成损伤,导致肾组织出现不同程度缺血、缺氧,最终部分发展为肾小球硬化和肾间质纤维化。正如Mogensen分期所描述,肾脏经历从功能代偿到结构损伤的变化过程,期间伴随着肾小球滤过率(代偿性升高—恢复正常—降低)、尿白蛋白(正常白蛋白尿—间断白蛋白尿—微量白蛋白尿—大量蛋白尿)及肾组织结构(肾小球肥大—基底膜增厚—部分肾小球硬化、灶状肾小管萎缩—广泛肾小球硬化和肾间质纤维化)等一系列变化[5]。从上述演变过程可以看出,在微量白蛋白尿升高之前,肾脏已经出现了一系列病理生理变化,因此,通过分析UMA正常但已经处于肾小球高滤过期的亚临床DN患者,就能在一定程度上发现潜在的DN患者。
DN导致肾小球基底膜病变,产生白蛋白尿[6]。正常情况下,肾小管能重吸收大量蛋白,当肾小管受损或滤过的蛋白超过其重吸收能力时,蛋白才从尿中排出。DN早期尿蛋白中除白蛋白外,还有大量低相对分子质量肾小管性蛋白(如RBP、β2-MG)及肾小管上皮细胞分泌的溶酶体酶(如NAG、GAL)[7]。研究证明,肾小管性蛋白尿及酶尿的出现往往早于白蛋白尿,提示二者是DN的更早期表现[8]。本研究通过检测尿GAL、RBP、NAG、β2-MG水平,发现SDN组患者NAG水平明显高于EDN组,78.2%的患者在出现微量白蛋白尿之前,近端肾小管重吸收功能已经受损,提示在DN更早期,此酶已开始升高,早于白蛋白尿的出现。分析其原因,一是因为DN早期高滤过,大量白蛋白从肾小球滤出后仍能被肾小管重吸收,因此尿白蛋白呈阴性,但此过程会激活细胞内溶酶体酶,使NAG排泄增多;另外,高血糖导致的肾脏微循环障碍会不同程度加重肾组织缺血、缺氧,而肾小管对缺血更敏感[9]。因此,在肾小球出现明显结构改变之前,肾小管已经出现不同程度的损伤,临床上表现为反映肾小管功能的蛋白或酶升高。本研究还发现EDN组RBP明显高于NC组及SDN组(P均<0.01),GAL、β2-MG虽呈升高趋势,但差异无统计学意义,可能与β2-MG受尿pH值影响有关,pH<5.5时β2-MG开始降解,在酸性尿液及不同温度下均不稳定。Logistic回归分析显示肾小管损伤标记物中两项异常者有发生亚临床DN的风险(OR=2.9,P=0.005)。因此,通过检测肾小管性蛋白尿或酶尿,可以对亚临床DN做出判断。
综合本研究结果,尿白蛋白正常但滤过率升高的亚临床DN患者尿NAG含量更高,一旦发展为微量白蛋白尿期DN,尿RBP含量和肾小管损伤标记物异常项数逐渐增多。总之,对正常白蛋白尿高滤过率期的2型糖尿病患者,应加强对肾小管损伤标记物的测定。另外,本研究为回顾性研究,存在选择偏倚,所得结果尚需进行前瞻性、大样本、对照研究加以证实。
[1] Menon R, Mohd Noor FS, Draman CR, et al. A retrospective review of diabetic nephropathy patients during referral to the sub-urban nephrology clinic[J]. Saudi J Kidney Dis Transpl, 2012, 23(5): 1109-1114.
[2] Fioretto P, Caramori ML, Mauer M. The kidney in diabetes: dynamic pathways of injury and repair. The Camillo Golgi Lecture 2007[J]. Diabetologia, 2008, 51(8): 1347-1355.
[3] Liu C, Chen H, Liu C, et al. Combined application of eGFR and albuminuria for the precise diagnosis of stage 2 and 3a CKD in the elderly[J]. J Nephrol, 2014, 27(3): 289-297.
[4] National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification [J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-S266.
[5] Remuzzi G, Bertani T. Pathophysiology of progressive nephropathies[J]. N Engl J Med, 1998, 339(20): 1448-1456.
[6] Nosadini R, Velussi M, Brocco E, et al. Course of renal function in type 2 diabetic patients with abnormalities of albumin excretion rate[J]. Diabetes, 2000, 49(3): 476-484.
[7] Fu WJ, Xiong SL, Fang YG, et al. Urinary tubular biomarkers in short-term type 2 diabetes mellitus patients: a cross-sectional study[J]. Endocrine, 2012, 41(1): 82-88.
[8] Fu WJ, Li BL, Wang SB, et al. Changes of the tubular markers in type 2 diabetes mellitus with glomerular hyperfiltration[J]. Diabetes Res Clin Pract, 2012, 95(1): 105-109.
[9] Bonventre JV. Can we target tubular damage to prevent renal function decline in diabetes?[J].Semin Nephrol,2012,32(5):452-462.
Diagnosticvalueofrenaltubularfunctioninsubclinicaldiabeticnephropathy
ZhangYi*,YangJuhong,ZhengMiaoyan,WangYing,RenHuizhu,XuYanguang,YangYanhui,ChengJingli,HanFei,YangXiaoyun,ChenLiming,ChangBaocheng,ShanChunyan,YangLicheng.
*DepartmentofNephropathy,TheMetabolicDiseasesHospital,TianjinMedicalUniversity,KeyLaboratoryofHormonesandDevelopment,MinistryofHealth,Tianjin300070,ChinaCorrespondingauthor:YangLicheng,Email:yanglicheng@tijmu.edu.cn;ShanChunyan,Email:chunyanshan@hotmail.com
ObjectiveTo investigate the renal tubular function in type 2 diabetic patients, and analyze the relationship between tubular injury markers and subclinical diabetic nephropathy (DN).MethodsTwo hundred and ninty-eight patients with type 2 diabetes were divided into three groups based on their 24-hour urinary microalbumin(UMA) and estimated glomerular filtration rate (eGFR): normal control group (NC group, with normal albuminuria and eGFR,n=100), subclinical diabetic nephropathy group (SDN group, with normoalbuminuria and glomerular hyperfiltration,n=87) and early diabetic nephropathy group (EDN group, with microalbuminuria,n=111). Immunoturbidimetric method was used to detect the level of 24-hour UMA,retinol binding protein (RBP) and β2- microglobubin(β2-MG) in urine. Biochemical method was used to measure N- acetyl-β-D-glucosaminidase (NAG) and galactosidase (GAL) in urine. The tubular injury markers and the relationship between renal tubular function and subclinical DN were analyzed.ResultsNAG in SDN group was higher than that in NC group (χ2=9.032,P<0.01), but no difference was found between SDN and EDN group. Urinary RBP in EDN group was greater than those in other two groups (χ2=56.341,31.955,allP<0.01). Although there was an increasing trend, the levels of β2-MG and GAL in NC, SDN and EDN group had no statistical difference. Compared with NC group,the percentages of patients with proximal tubular dysfunction were higher, in SDN and EDN group(59%,78.2%,82% respectively,χ2=42.658,P<0.01). The percentage of patients with one or two tubular injury markers in SDN group was greater than those in other two groups. Patients with two tubular injury markers were more likely to suffer from subclinical DN [odd ratio (OR)=2.9,P=0.005],but after adjusting for age,sex, diabetic duration,total triglyceride, total cholesterol, high density lipoprotein-cholesterol, glycosylated hemoglobin and body mass index, the predictive value disappeared (OR=1.7,P>0.05).ConclusionCompared with glomerular injury, tubular injury may be more important for judging the early impairment in renal function. Subclinical DN patients with normoalbuminuria and hyperfiltration have higher level of tubular injury markers.
Subclinical diabetic nephropathy;Renal tubular injury markers;Glomerular filtration rate;Microalbuminuria
(IntJEndocrinolMetab,2015,35:22-26)
10.3760/cma.j.issn.1673-4157.2015.01.005
国家自然科学基金资助项目(81173428,81373864,
81200612);天津市自然科学基金资助项目(10JCYBJC13200)
300070 天津医科大学代谢病医院肾病科,卫生部
激素与发育重点实验室(张祎, 杨菊红, 郑妙艳, 王颖,任慧珠,
徐延光,杨艳辉,程静丽,韩菲,杨笑云,陈莉明,常宝成,单春艳);
300070 天津医科大学(杨立成)
杨立成,Email:yanglicheng@tijmu.edu.cn;单春艳,
Email: chunyanshan@hotmail.com
2014-09-05)

