番茄红素对慢性低氧小鼠骨密度和RANKL/OPG的影响
朱再胜,戴爽,郑靖宇,黄卡特,吴玲,杜晓红,李剑敏
(1.温州医科大学附属第一医院,浙江 温州 325015,1.老年病科;2.病理科)
·论 著·
番茄红素对慢性低氧小鼠骨密度和RANKL/OPG的影响
朱再胜1,戴爽2,郑靖宇2,黄卡特2,吴玲2,杜晓红1,李剑敏2
(1.温州医科大学附属第一医院,浙江 温州 325015,1.老年病科;2.病理科)
目的:探讨番茄红素对慢性低氧(CH)小鼠骨密度(BMD)和核因子-kβ受体活化因子配体(RANKL)/骨保护蛋白(OPG)的影响。方法:选用8周龄C57BL/6雄性小鼠24只,随机分为对照组(C组,n=8)、CH组(n=8)和番茄红素组(LCP组,n=8)。C组在正常环境下饲养,CH组和LCP组低氧暴露时间为每日8 h,每周6 d,连续8周。于实验末取血1.5 mL,ELISA法测量血清抗酒石酸酸性磷酸5b(TRACP-5b)、骨钙素(OC);同时检测骨组织丙二醛(MDA)含量,超氧化物歧化酶(SOD)活性;用骨密度仪检测股骨BMD;HE染色光镜观察骨组织形态学改变;用免疫组织化学技术和实时荧光定量PCR(RT-qPCR)技术检测骨组织骨保护素(OPG)和核因子-κ B受体活化因子配体(RANKL)蛋白及mRNA的表达。结果:①CH组股骨干骺端骨小梁分布稀疏,变细及断裂;骨组织SOD活性、BMD和血清OC明显低于C组;而骨组织MDA、RANKL水平、RANKL mRNA/OPG mRNA以及血清TRACP-5b显著高于C组(P<0.01)。②LCP能部分改善CH小鼠骨组织形态学;LCP组骨组织MDA水平、RANKL表达、RANKL mRNA/OPG mRNA和血清TRACP-5b水平低于CH组;而骨组织SOD活性、血清OC水平和BMD高于CH组(P<0.05或0.01)。结论:番茄红素能降低CH小鼠骨组织氧化应激水平,下调RANKL/OPG,减少骨吸收,提高BMD。
低氧;骨保护蛋白;核因子-kβ受体活化因子配体;骨密度;氧化应激;番茄红素;小鼠
Key words: hypoxia; osteoprotegerin; receptor activator for nuclear factor-κB ligand; bone mineral density; oxidative stress; lycopene; mice
骨质疏松症是一种以骨量低下,骨微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性代谢性骨病。低氧性疾病(如慢性阻塞性肺疾病)常伴随骨代谢异常和骨质疏松症[1]。研究发现,慢性低氧(chronic hypoxia,CH)会导致机体氧化应激[2],慢性阻塞性肺病急性加重引起的氧化应激加重,可导致骨吸收较稳定期明显增加[3],故CH导致的氧化应激会影响骨代谢和骨密度(bone mineral density,BMD)。抗氧化剂番茄红素等能通过骨保护蛋白(osteoprotegerin,OPG)和核因子-k β受体活化因子配体(receptor acti-vator for nuclear factor-κB ligand,RANKL)保护骨骼细胞抵御氧化损伤[4]。因此,本实验拟通过CH模型,了解番茄红素对C57BL/6小鼠CH模型的骨组织丙二醛(malondiadehyde,MDA)水平、超氧化物歧化酶(superoxide dismutase,SOD)活性和血清骨钙素(osteocalcin,OC)、抗酒石酸酸性磷酸5b(tartrate-resistant acid phosphatase 5b,TRACP-5b)和BMD以及骨组织RANKL/OPG的影响,探讨其可能的机制。
1 材料和方法
1.1 主要试剂 免疫组织化学试剂:OPG和RANKL兔抗小鼠多克隆抗体(武汉博士德生物工程有限公司);RT-qPCR试剂盒(美国,Invitrogen life technologies);OPG、RANKL及内参GAPDH引物(上海康成生物工程有限公司设计合成);OC、TRACP-5b(上海西唐生物科技有限公司);MDA、SOD、总蛋白等试剂盒(南京建成生物工程研究所)。
1.2 实验动物与分组 SPF级健康7周龄雄性C57BL/6小鼠24只,由温州医科大学实验动物中心提供,动物使用许可证号:SYXK(浙)2010-0150。适应性饲养1周后,按数字随机法随机分为3组,每组8只:①对照组(C组),常压低氧舱外饲养;②CH组,置于常压低氧舱中饲养,舱内氧浓度维持8%~11%,CO2浓度维持1%~3%[5],暴露时间为每日8 h,每周6 d,连续8周。③番茄红素组(LCP组),每天于进舱前灌胃番茄红素(15 mg/kg小鼠体质量,灌胃前先溶于色拉油),其余条件同CH组。C组、CH组每天分别给予同体积的色拉油灌胃,剂量均为0.5 mL/100 g体质量。
1.3 标本采集 在实验8周末,断头处死小鼠,取血1.5 mL,取血清置-80 ℃低温保存待用。取左侧股骨下端,用中性甲醛固定24 h,取出后置20% EDTA溶液中4 ℃脱钙,用于组织形态学观察;取左侧股骨上端,置-80 ℃保存用于RT-qPCR检测。取双侧胫骨,置-80 ℃保存用于MDA、SOD检测。取右侧股骨,用0.9%氯化钠溶液浸湿纱布包裹,-20 ℃低温保存,用于BMD测定。
1.4 方法
1.4.1 OC、TRACP-5b检测:用ELISA法测定,具体操作严格按照试剂盒的说明书进行。
1.4.2 MDA、SOD检测:用0.9%氯化钠溶液1∶10稀释匀浆,4 ℃离心(3 000 r/min,10 min)后,取上清于-80 ℃保存备用。MDA采用硫代巴比妥酸(TBA)法;SOD采用羟胺法;总蛋白测定采用考马斯亮兰法。检测均采用722分光光度计,具体操作严格按照试剂盒的说明书进行。
1.4.3 BMD测定:取出于-20 ℃保存的右侧股骨,应用骨密度仪(Hologic QDR-4500)小动物软件(Hologic、Bedford、MA,USA)程序扫描整段股骨的BMD。
1.4.4 骨组织形态学观察:取左侧股骨石蜡包埋组织,切片厚度5 μ m,切片采用连续间隔切片,间隔5张取1张,每个标本取3张切片。1张用于作HE染色,光镜下观察骨组织结构。
1.4.5 免疫组织化学法检测OPG、RANKL蛋白的表达:分别行OPG和RANKL的免疫组织化学染色。油镜下观察骨组织OPG、RANKL蛋白的表达,结果判定[6]:每张切片随机取光学显微镜1 000倍5个视野,进行阳性细胞百分比计分与着色强度记分。阳性细胞百分比记分按每个视野内阳性细胞所占总细胞数的比例记分。≤5%、6%~25%、26%~50%、>51%分别记分为0、l、2、3分。着色强度记分:按阳性细胞着色(颜色)无、弱(淡黄)、中(棕黄)、强(棕褐)分别记分为0、l、2、3分。上述两种记分结果相加,0~1分为阴性(-);2~3分为弱阳性(+);4~5分中等阳性(++); 6分为强阳性(+++)。
1.4.6 RT-qPCR检测OPG、RANKL和GAPDH mRNA表达:采用Trizol一步法提取总RNA。通过甲醛变性琼脂糖凝胶电泳鉴定所提取的RNA的完整性,紫外吸收测定法鉴定RNA的纯度,选择完整性和纯度均符合实验要求的RNA样品-80 ℃保存。OPG上游引物5’-CCTGGGACCAAAGTGAATGC-3’,下游引物5’-TCTGT GGTGAGGTTCGAGTGG-3’,产物197 bp;RANKL上游引物5’-CATCGGGAAGCGTACCTACAG-3’,下游引物5’-GCTC CCTCCTTTCATCAGGTTAT-3’,产物101 bp;GAPDH(内参)上游引物5’-GTTGTCTCCTGCGACTTCA-3’,下游引物5’-GCCCCTCCTGTTATTATGG-3’,产物293 bp。反转录合成cDNA。用real-time RT-PCR反应体系扩增,使用SYBR Green real-time RT-PCR相对定量的方法。比较各组管家基因GAPDH以及目的基因的Ct值,运用2-ΔΔCt方法,得出mRNA的相对表达量。最终结果由PCR仪配套软件自动计算。
1.5 统计学处理方法 用SPSS 11.5统计学软件。计量资料以表示,多组间比较用方差分析,组间两两比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 股骨BMD、骨组织MDA和SOD以及血清OC、TRACP-5b变化 CH组骨组织SOD活性、BMD和血清OC明显低于C组;而MDA和血清TRACP-5b显著高于C组,差异有统计学意义(P<0.01)。LCP组骨组织MDA水平和血清TRACP-5b水平低于CH组;而骨组织SOD活性、血清OC水平和BMD高于CH组,差异有统计学意义(P<0.01或P<0.05),见表1。
表1 各组股骨BMD及骨组织MDA、SOD、OC和TRACP-5b水平(n=8,)
表1 各组股骨BMD及骨组织MDA、SOD、OC和TRACP-5b水平(n=8,)
与C组比:aP<0.01;与CH组比:bP<0.01,cP<0.05
2.2 骨组织HE染色 CN组小鼠股骨干骺端骨小梁饱满、连续,骨小梁间隙分布均匀;CH组小鼠股骨干骺端骨小梁变稀疏、变细,骨小梁间隙增宽,可见骨小梁断裂、消失;LCP组骨小梁较CH组粗,小梁间隔变小,但仍未达到C组水平,见图1。
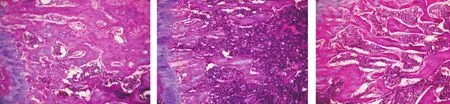
图1 左股骨下端切片(HE,×200)
2.3 免疫组织化学检测OPG、RANKL蛋白表达 OPG的表达定位于软骨细胞、成骨细胞胞浆和胞核,3组之间差异无统计学意义(见图2、表2);RANKL的表达定位于软骨细胞、骨细胞、骨髓细胞胞浆和胞核,C组大部分表达为弱阳性(+),CH组有4只表达为强阳性(+++),LCP组有3只表达为中等阳性(++),差异有统计学意义(P<0.05或P<0.01)(见图3、表2)。
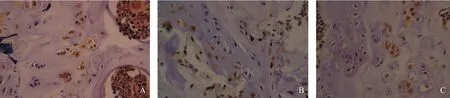
图2 左股骨下端OPG蛋白的表达(免疫组织化学,×1 000)
2.4 各组骨组织OPG mRNA、RANKL mRNA表达变化
CH组骨组织RANKL mRNA表达和RANKL/OPG比值明显高于C组,差异有统计学意义(均P<0.01);LCP组骨组织RANKL mRNA表达和RANKL/OPG比值明显低于CH组,差异有统计学意义(均P<0.01),见表3。

图3 左股骨下端RANKL蛋白的表达(免疫组织化学,×1 000)
表2 各组骨组织OPG、RANKL蛋白表达(n=8,±s)

表3 各组骨组织OPG、RANKL mRNA表达(n=8,±s)
3 讨论
番茄红素是自然界中存在一种很强的抗氧化剂。近年来国内外的研究证实,番茄红素不仅促进成骨细胞的活性,而且能够抑制破骨细胞的活性,进而阻止和减缓骨质疏松症的发生[4,7]。本实验显示,CH小鼠骨组织MDA高于C组,而SOD及BMD低于C组;病理学表现为股骨干骺端骨小梁变稀疏、变细,骨小梁间隙增宽,可见骨小梁断裂、消失,与Song等[8]研究结果一致;相反,LCP组骨组织MDA明显降低,SOD显著升高,BMD和骨组织病理学有所改善;可归因于CH导致骨组织氧化应激增加,进而导致BMD低,而番茄红素能提高抗氧化防御来抵抗氧化损伤,改善BMD和骨组织病理学。
骨代谢表明CH不仅抑制骨形成作用和成骨细胞的活性,而且可以增强骨再吸收作用和破骨细胞的活性,主要表现为血清中OC水平低,而TRACP-5b水平高。本实验显现的,CH对于骨形成的抑制与先前的体内外研究[8-9]结果类似。然而,CH对体内外骨吸收的影响是不同的。体外研究表明CH能促进破骨细胞形成和骨吸收[10];Song等[8]在体内研究发现CH能抑制去卵巢大鼠的骨吸收。而本实验显示,CH能促进骨吸收,可能与低氧的方式和持续时间不同以及研究对象不同有关。相反,番茄红素能保护骨骼抵御CH导致破骨细胞活性的增加,改善受抑制的骨形成作用。
RANKL/OPG的变化可以影响体内破骨功能的程度进而改变骨代谢的平衡[11]。研究发现,抗氧化剂可以通过调节RANKL/OPG改善骨代谢[12]。本实验显示,C组、CH组和LCP组3组间OPG mRNA和蛋白表达水平差异无统计学意义。CH组的RANKL mRNA和蛋白表达水平,RANKL/OPG比值高于C组,这与祝金香等[13]的体内研究结果一致。然而,与体外实验结果不同,低氧抑制小鼠成骨细胞表达OPG,刺激RANKL表达,从而诱导成骨细胞介导的破骨细胞的分化成熟[10,14],增加骨吸收。低氧对体内外骨细胞OPG、RANKL表达影响不同的原因可能是,低氧会引起体内IL-6和TNF-α等促炎细胞因子升高[15],而IL-6和TNF-α等促炎细胞因子会干扰OPG/RANK/RANKL[16],其机制有待研究。本实验还显示,与CH组比较,LCP组RANKL表达水平低,RANKL/OPG比值低,骨组织病理学和BMD有所改善,表明抗氧化剂番茄红素能减少CH引起的骨组织氧化应激,调节RANKL/OPG比值,减少骨吸收,从而改善了BMD。
[1] Agusti AG, Noguera A, Sauleda J, et al. Systemic effects of chronic obstructive pulmonary disease[J]. Eur Respir J, 2003, 21(2): 347-360.
[2] Zhou W, Li S, Wan N, et al. Effects of various degrees of oxidative stress induced by intermittent hypoxia in rat myocardial tissues[J]. Respirology, 2012, 17(5): 821-829.
[3] Stanojkovic I, Kotur-Stevuljevic J, Spasic S, et al. Relation-ship between bone resorption, oxidative stress and infammation in severe COPD exacerbation[J]. Clin Biochem, 2013, 46(16- 17): 1678-1682.
[4] Rao LG, Mackinnon ES, Josse RG, et al. Lycopene consumption decreases oxidative stress and bone resorption markers in postmenopausal women[J]. Osteoporos Int, 2007, 18(1): 109-115.
[5] 董莉, 朱海萍, 李云雷, 等. 5-羟基癸酸盐对低氧肺动脉高压大鼠肺血管重建的影响及其机制[J]. 温州医学院学报, 2010, 40(5): 445-449.
[6] 王敏, 李先平, 赵立玲, 等. ApoE基因敲除鼠骨量改变及其可能机制的初步研究[J]. 中华医学杂志, 2009, 89(42): 2963-2967.
[7] 杨希重, 陈晓亮, 王德春. 番茄红素与成骨细胞、破骨细胞及骨质疏松症[J]. 中国组织工程研究与临床康复, 2007, 11(49): 9980-9983.
[8] Song L, Liang X, Zhou Y. Estrogen-mimicking isoflavone genistein prevents bone loss in a rat model of obstructive sleep apnea-hypopnea syndrome[J]. Int J Clin Exp Pathol, 2014, 7(4): 1687-1694.
[9] Utting JC, Robins SP, Brandao-Burch A, et al. Hypoxia inhibits the growth, differentiation and bone-forming capacity of rat osteoblasts[J]. Exp Cell Res, 2006, 312(10): 1693-1702.
[10] 郎红梅, 金小岚, 万勇, 等. 低氧对小鼠破骨细胞分化影响的时间依赖关系[J]. 中国组织工程研究与临床康复, 2010, 14(28): 5136-5140.
[11] Gravallese EM, Manning C, Tsay A, et al. Synovial tissue in rheumatoid arthritis is a source of osteoclast diferentiation factor[J]. Arthritis Rheum, 2000, 43(2): 250-258.
[12] Xiao Y, Cui J, Li YX, et al. Dyslipidemic high-fat diet affects adversely bone metabolism in mice associated with impaired antioxidant capacity[J]. Nutrition, 2011, 27(2): 214-220.
[13] 祝金香, 张纲, 武曦, 等. RANKL/OPG在高原低氧条件下兔牙周炎发病机制中的作用[J]. 第三军医大学学报, 2012, 34(4): 320-323.
[14] 郎红梅, 金小岚. 低氧对小鼠成骨细胞OPG及RANKL基因表达的影响[J]. 西南国防医学, 2007, 17(1): 28-30.
[15] Guner I, Uzun DD, Yaman MO, et al. The effect of chronic long-term intermittent hypobaric hypoxia on bone mineral density in rats: role of nitric oxide[J]. Biol Trace Elem Res, 2013, 154(2): 262-267.
[16] Kwan TS, Padrines M, Théoleyre S, et al. IL-6, RANKL, TNF-alpha/IL-1: interrelations in bone resorption pathophysiology[J]. Cytokine Growth Factor Rev, 2004, 15(1): 49-60.
(本文编辑:吴健敏)
Effects of lycopene on bone mineral density and RANKL/OPG in chronic hypoxia modal mice
ZHU Zaisheng1, DAI Shuang2, ZHENG Jingyu2, HUANG Kate2, WU Ling2, DU Xiaohong1, LI Jianmin2.
1.Department of Gerontology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Pathology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To investigate the effects of lycopene on bone mineral density (BMD) and RANKL/ OPG in chronic hypoxia (CH) modal mice. Methods: Twenty-four C57BL/6 male mice aged 8 weeks were randomly divided into three groups: Control group (C group, n=8) and CH group (CH group, n=8) and lycopene group (LCP group, n=8). Mice in CH and LCP were exposed in hypoxic environment, 8 h/day, 6 d/week while the C group lived in normal environment. At the end of 8 weeks, the serum levels of OC and TRACP-5b were measured by ELISA. The content of malondiadehyde (MDA) and the activity of superoxide dismutase (SOD) in shinbone were analyzed using hydroxylamine assay and TBA colorimetry. The BMD of right femurs were detected by Hologic QDR-4500 bone densitometer. Histomorphology of bone tissue was observed with H.E stainin under light microscopy. The expressions of OPG and RANKL in bone tissue were detected with immunohistochemical technique and RT-qPCR respectively. Results: Firstly, Histologically, the volume of bones trabecular were decreased and the bones trabecular distribution were sparse, thinner and fracture in bone marrow in CH group. In comparison with the C group mice, BMD and serum OC level and the activities of SOD in bone (P<0.01) were decreased signifcantly in CH group mice, while the serum TRACP-5b level, MDA level in bone, the expression of RANKL protein and RANKL mRNA in bone and RANKL mRNA/OPG mRNA (P<0.01) were increased signifcantly. Secondly, LCP could partially improve the histomorphometric parameters in mice with CH. The serum TRACP-5b level, MDA level in bone, the expression of RANKL protein and mRNA in bone and RANKL mRNA/OPG mRNA in LCP group mice were lower signifcantly than the levels in HC group mice, while BMD and serum OC level and the activities of SOD in bone were higher (P<0.01 or P<0.05). Conclusion: Lycopene can reduce oxidative stress, regulate RANKL mRNA/OPG mRNA, decrease bone resorption and improve BMD in CH mice.
R361.2
ADOI: 10.3969/j.issn.2095-9400.2015.03.007
2014-10-29
温州市科技局科研基金资助项目(Y20120038)
朱再胜(1979-),男,浙江乐清人,主治医师,硕士。
李剑敏,教授,Email:wzyxyljmin@163.com。

