儿童OSAHS危险因素和微觉醒预警机制探讨
苏苗赏,俞晨艺,张渊博,周洋洋,徐莉,蔡晓红
(1.温州医科大学附属第二医院育英儿童医院 儿童呼吸科,浙江 温州 325027;2.温州医科大学 研究生院,浙江 温州 325035)
·论 著·
儿童OSAHS危险因素和微觉醒预警机制探讨
苏苗赏1,俞晨艺1,张渊博2,周洋洋2,徐莉2,蔡晓红1
(1.温州医科大学附属第二医院育英儿童医院 儿童呼吸科,浙江 温州 325027;2.温州医科大学 研究生院,浙江 温州 325035)
目的:调查儿童阻塞性睡眠呼吸暂停低通气综合征(OSAHS)的危险因素,探讨脑电微觉醒与全身炎症反应的相关性。方法:对2013年1月至2014年6月我院儿童呼吸科门诊收治的285例6~11岁鼾症儿童进行睡眠问卷调查和整夜多导睡眠监测(PSG),比较OSAHS患儿和非OSAHS患儿的临床资料,分析OSAHS的相关危险因素。随机选取30例鼾症儿童进行血炎症指标检测,分析睡眠效率(SE)、睡眠结构、微觉醒指数(AI)、氧减指数及各种睡眠呼吸紊乱指数等睡眠参数以及血常规、C反应蛋白(CRP)、白介素-1 β(IL-1 β)的表达水平。结果:56例(占19.6%)患儿被诊断为OSAHS。与非OSAHS组比较,OSAHS患儿与多种睡眠相关症状显著相关。Logistic回归分析显示,OSAHS主要危险因素有扁桃体腺样体肥大、习惯性打鼾(>3次/周)、肥胖、张口呼吸、夜间遗尿、白天过度活跃和脾气暴躁。睡眠参数分析显示,OSAHS患儿睡眠总时间(TST)、SE、深睡眠(I I I期+IV期睡眠)和快速眼动(REM)期睡眠时间减少,浅睡眠(I期+I I期睡眠)时间增多,AI增高;最低氧饱和度(LSaO2)、阻塞性呼吸暂停指数(OAI)、呼吸暂停低通气指数(AHI)和呼吸紊乱指数(RDI)在OSAHS和非OSAHS儿童间差异均有统计学意义。OSAHS患儿血白细胞计数、血CRP及IL-1 β表达水平均明显增高。Pearson相关分析显示,OSAHS患儿AI与RDI呈正相关(r=7.56,P<0.01),与血IL-1 β表达水平亦呈正相关(r=6.85,P<0.01)。结论:OSAHS患儿主要危险因素有扁桃体腺样体肥大、习惯性打鼾、肥胖、张口呼吸、夜间遗尿、白天过度活跃和脾气暴躁。AI增高与呼吸紊乱有关,并且可能与全身轻度炎症反应相关。
阻塞性睡眠呼吸暂停低通气综合征;多导睡眠监测;微觉醒;炎症;危险因素;儿童
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea and hypopnea syndrome,OSAHS)是一种严重的睡眠呼吸障碍性疾病,表现为持续的部分上气道阻塞和/或间歇性完全阻塞,从而影响睡眠时正常通气功能和睡眠模式[1]。与成人OSAHS不同,儿童OSAHS主要由扁桃体腺样体肥大引起,并且伴有睡眠时打鼾、张口呼吸、夜间遗尿、多汗、磨牙、夜惊及梦游等睡眠相关症状及体征。国内外已有临床研究[2-3]报道儿童OSAHS的主要危险因素,但是不同地区的研究结果有所不同,这可能与不同种族、不同饮食和生活习惯等因素有关。随着经济水平及生活方式的改变,儿童OSAHS的临床特征及危险因素需要进行再次评估。目前整夜多导睡眠(polysommongraphy,PSG)监测仍是诊断OSAHS的标准方法[4],但微觉醒指数(arousal index,AI),包括自发性和呼吸努力相关微觉醒(respiratory effort related arousal,RERA)仍被多数临床医师所忽视,其对OSAHS儿童的危害性目前仍不确定。据国内外文献[5-6]报道,OSAHS由于慢性间歇性低氧及氧化应激可引起上气道上皮细胞损伤,并导致上气道慢性炎症性改变。本研究通过问卷调查分析儿童OSAHS的临床特征,并结合PSG各种睡眠参数的变化,分析儿童OSAHS的危险因素和预警机制,并探讨脑电微觉醒与全身炎症反应的关系。
1 对象和方法
1.1 研究对象 2013年1月至2014年6月温州医科大学附属第二医院育英儿童医院儿童呼吸科门诊收治的6~11岁鼾症儿童共285例,男148例,女137例,平均(7.9±2.3)岁。入选标准:有不同程度的睡眠打鼾等症状,并且愿意进行PSG监测;自愿参加本研究并签署知情同意书。排除标准:家属不配合完成睡眠问卷调查;患儿近期有严重神经肌肉性疾病或外周血管疾病。
1.2 诊断标准 OSAHS的整夜PSG诊断标准参照2007年中国儿童OSAHS诊治指南[7]和2012年美国儿童OSAHS诊治指南[1],PSG结果显示呼吸暂停低通气指数(apnea hypopnea index,AHI)>5次/h或阻塞性呼吸暂停指数(obstructive apnea index,OAI)>1次/h,最低血氧饱和度(lowest arterial oxygen saturation,LSaO2)<0.92。呼吸紊乱指数(respiratory disturbance index,RDI)包括AHI和RERA。睡眠效率(sleep efficiency,SE)指睡眠总时间(total sleep time,TST)与有效监测的总记录时间比值。肥胖筛查界值点采用中国肥胖问题工作组制定的诊断标准[8]。
1.3 问卷调查量表 285例鼾症儿童的家长均被邀请完成睡眠问卷调查表(HK-CSQ),此调查表的有效性已经得到确认[2]。HK-CSQ调查患儿过去1年的睡眠习惯和睡眠问题,包括OSAHS相关症状(打鼾、睡眠惊跳、睡眠不安、张口呼吸),异态睡眠(夜间遗尿、梦呓、梦游、磨牙),及白天症状(晨起头痛、反复呼吸道感染、白天过度活跃、脾气暴躁)。家长需填写5分评分(0分:从未发生;1分:<1次/月;2分:1~2次/月;3分:1~2次/周;4分:>3次/周)。此外,还包括以下信息:既往病史如过敏性鼻炎、鼻窦炎、哮喘、扁桃体炎、咽炎和喉炎,父母亲教育背景和儿童体育运动量。
1.4 炎症指标检测和PSG监测 随机选取30例鼾症儿童,在PSG监测次日清晨抽取外周血,应用酶联免疫吸附(ELISA)法(试剂盒购自美国Sigma公司)检测血常规、C反应蛋白(CRP)与白介素-1 β(IL-1 β)的表达水平。30例中男18例,女12例,平均年龄(8.2±2.5)岁,OSAHS患儿14例,非OSAHS患儿16例。所有入组患儿在医院进行7 h以上的整夜PSG监测,由经验丰富的睡眠医师对各种睡眠参数,包括TST、SE、快速眼动睡眠(rapid eye movement,REM)期睡眠占睡眠期总时间比率、I期睡眠占睡眠期总时间比率、I I期睡眠占睡眠期总时间比率、I I I期+IV期睡眠占睡眠期总时间比率、AHI、OAI、AI、LSaO2与血氧饱和度≤90%的时间占总监测时间的百分比(SIT90)。
1.5 统计学处理方法 采用SPSS 18.0软件进行数据分析。计量资料以表示,正态分布资料采用t检验,计数资料采用卡方检验。Logistic回归法分析OSAHS的危险因素。两变量相关分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较 285例鼾症儿童中,诊断为OSAHS者56例,占19.6%,其中轻度36例,中重度20例。与非OSAHS儿童比较,OSAHS患儿在一般资料、行为表现、既往病史、家庭信息及睡眠相关症状、体征方面差异均有统计学意义(P<0.05或P<0.01),见表1。
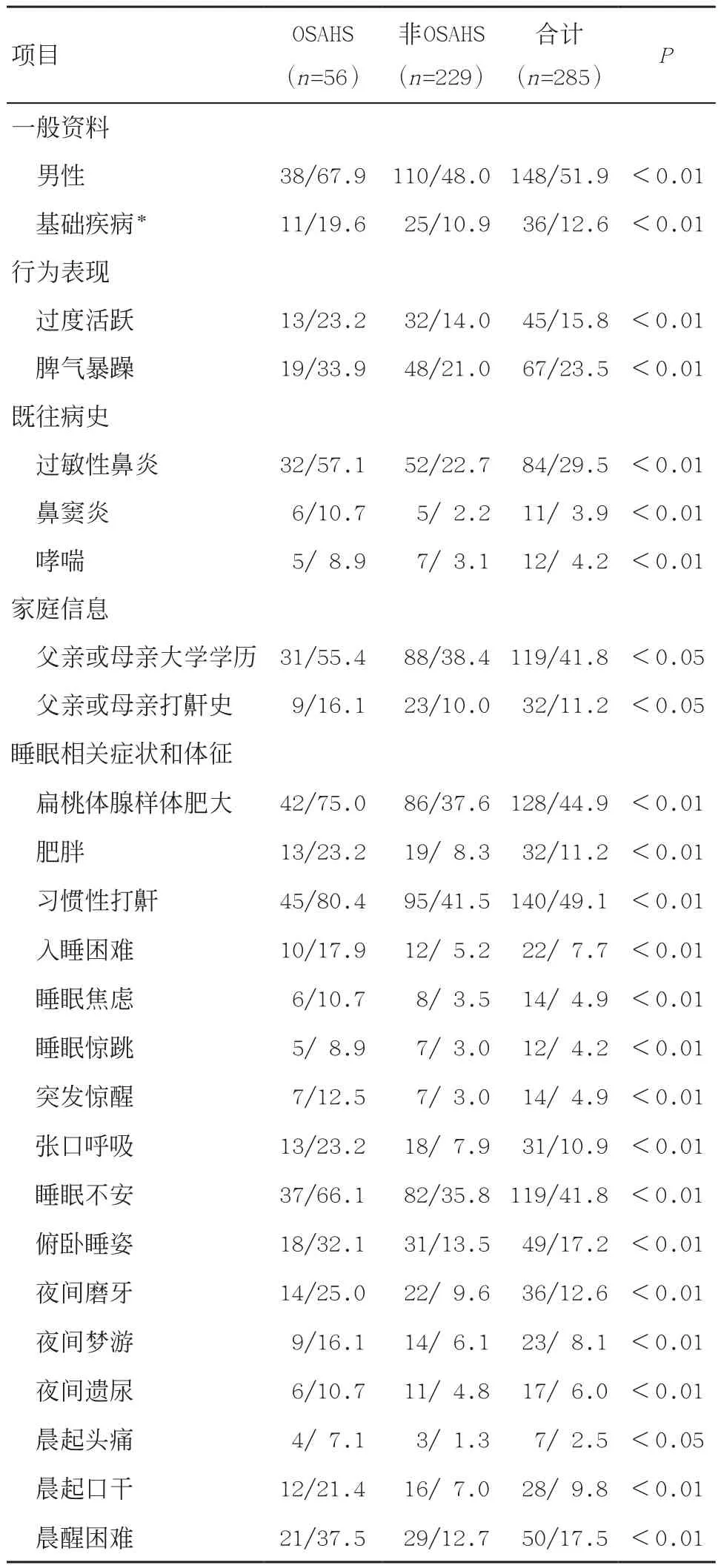
表1 OSAHS与非OSAHS患儿临床资料比较 n/%
2.2 危险因素分析 先采用x2检验对临床资料各变量进行单因素分析,共发现有25项因素与OSAHS相关,然后采取前进法将单因素分析得出的有统计学意义的变量进行非条件Logistic回归模式多因素分析,计算OR值和95%可信区间(CI),筛选出独立危险因素。各因素赋值,有=1,无=2。结果显示,OSAHS主要危险因素有扁桃体腺样体肥大、习惯性打鼾(>3次/周)、肥胖、张口呼吸、夜间遗尿、白天过度活跃和脾气暴躁,见表2。

表2 Logistic回归分析结果
2.3 睡眠参数及炎症因子检测 与非OSAHS患儿比较,OSAHS患儿TST、SE、深睡眠和REM期睡眠时间减少,浅睡眠时间增多,AI增高(P<0.05或P<0.01);LSaO2、OAI、AHI和RDI两组间差异均有统计学意义(P<0.05或P<0.01);OSAHS患儿血白细胞计数、血CRP及IL-1 β表达水平均明显增高(P<0.05或P<0.01)。见表3。Pearson相关分析显示,OSAHS患儿AI与RDI呈正相关(r=7.56,P<0.01),与血IL-1 β表达水平亦呈正相关(r=6.85,P<0.01),见图1-2。
表3 OSAHS与非OSAHS患儿睡眠参数及炎症指标比较()

表3 OSAHS与非OSAHS患儿睡眠参数及炎症指标比较()
与非OSAHS组比:aP<0.05,bP<0.01
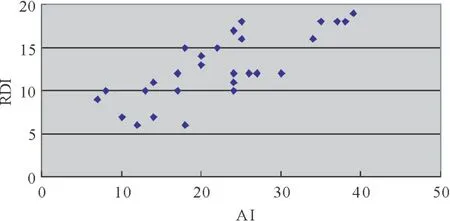
图1 AI与RDI相关散点图

图2 AI与IL-1 β相关散点图
3 讨论
OSAHS是睡眠呼吸紊乱性疾病发展至最严重的阶段,由于频繁间歇低氧,可引起全身炎症及应激反应、血管内皮功能紊乱、认知功能障碍及内分泌功能紊乱等多系统功能损害,严重影响患者的身心健康。儿童OSAHS的危险因素多、涉及面广,临床表现多样,因此,临床医师需注意识别儿童OSAHS的各种危险因素,这对于早期防治OSAHS具有重要意义。
与成人OSAHS比较,扁桃体腺样体肥大是引起儿童OSAHS的主要原因,此研究结果与其他国家及地区的研究[1-3]结果一致。此外,儿童OSAHS可与许多睡眠相关症状密切相关,包括肥胖、习惯性打鼾和白天行为异常及夜间遗尿等[9]。儿童肥胖在西方及发达国家发病率较高,这可能与饮食习惯及社会经济水平有关。本研究发现,儿童肥胖也是OSAHS的主要危险因素。本研究结果还提示,夜间遗尿也是引起OSAHS的主要危险因素,此结果与文献[1-3]的研究结果一致,但也有不同的研究[9]报道,这可能与OSAHS患儿的低氧严重程度以及与性别差异相关[10]。本研究结果还提示白天过度活跃和脾气暴躁与OSAHS相关,这与最近发表的一篇Meta分析[11]报告一致,提示鼾症儿童出现白天过度活跃和脾气暴躁等行为改变,应注意是否合并睡眠呼吸障碍,并进行睡眠监测以确诊。目前不同地区针对儿童OSAHS的预测方法也有所不同:Li等[2]通过睡眠问卷对香港地区6~11岁儿童进行大样本流行病学调查,发现睡眠打鼾、张口呼吸、夜间多汗可作为预测儿童OSAHS的主要危险因素;而Xu等[3]对北京地区学龄儿童进行临床对照研究,发现影像学气道狭窄、张口呼吸和夜间遗尿是儿童OSAHS的主要危险因素。本研究结果发现,温州地区儿童引发OSAHS的主要危险因素有扁桃体腺样体肥大、习惯性打鼾、肥胖、张口呼吸和夜间遗尿。
微觉醒作为睡眠期间一种较特殊的醒觉反应,包括自发性微觉醒和RERA,其发生机制及临床意义仍不明确[12]。微觉醒可以不减少TST,但可以引起反复睡眠结构紊乱,出现片段化睡眠,深睡眠时间减少,导致睡眠质量下降,进一步可能会影响白天的学习认知功能及行为表现。微觉醒的判读容易受儿童体动及外界环境因素影响,目前国内多数睡眠监测仅依赖电脑自动生成的数据,而未对其进行常规手动筛选修正,影响了睡眠参数的准确性。本研究在进行常规的睡眠结构、氧饱和度分析及睡眠紊乱指数的判读外,对入组的鼾症患儿进行脑电微觉醒分析,结合视频及脑电对AI进行手动筛选修正,结果发现,OSAHS患儿AI明显增高,且其与RDI密切相关。OSAHS患儿其他睡眠参数异常,还包括TST、SE、深睡眠和REM期睡眠时间减少,浅睡眠时间增多,LSaO2、OAI、AHI和RDI增高。
近年来的研究[5-6]结果显示,OSAHS患儿上气道及外周血中的炎症递质,如CRP、TNF-a、IL-6、白三烯等均有不同程度增高,提示OSAHS患儿存在气道慢性炎症性改变。临床研究[13-14]结果表明,OSAHS患儿经过白三烯拮抗剂或吸入性糖皮质激素抗炎治疗后,其打鼾症状及睡眠呼吸紊乱程度得到明显的减轻,提示局部和全身炎症反应在OSAHS发病中起重要作用。本研究结果显示,OSAHS患儿的外周血白细胞总数、CRP及IL-1 β均明显增高,并且IL-1 β与AI呈正相关,提示OSAHS患儿持续轻度的炎症状态,可能与低氧-微觉醒反应有关,从而可能影响全身的多系统功能,其潜在的低氧相关微觉醒与炎症反应机制有待进一步研究阐明。
[1] Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome[J]. Pediatrics, 2012, 130(5): 576-582.
[2] Li AM, Cheung A, Chan D, et al. Validation of a questionnaire instrument for prediction of obstructive sleep apnea in Hong Kong Chinese children[J]. Pediatr Pulmonol, 2006, 41(4): 1153-1160.
[3] Xu ZF, Cheuk DK, Lee SL, et al. Clinical evaluation in predicting childhood obstructive sleep apnea syndrome[J]. Chest, 2006, 130(6): 1765-1771.
[4] 李昌崇, 苏苗赏. 儿童阻塞性睡眠呼吸暂停低通气综合征的危险因素及管理策略[J]. 中华实用医学杂志, 2014, 29 (4): 246-248.
[5] Aihara KT, Oga T, Harada Y, et al. Analysis of anatomical and functional determinants of obstructive sleep apnea[J]. Sleep Breath, 2012, 16(2): 473-481.
[6] 蔡晓红, 李秀翠、李美丽, 等. 儿童阻塞性睡眠呼吸暂停低通气综合征多系统影响的研究[J]. 中华儿科杂志, 2012, 50(2): 93-97.
[7] 中华医学会耳鼻咽喉科学分会. 儿童阻塞性睡眠呼吸暂停低通气综合征诊疗指南[J]. 中华耳鼻咽喉头颈外科杂志, 2007, 42(10): 83-84.
[8] 中国肥胖问题工作组. 中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J]. 中华流行病学杂志, 2004, 25(2): 97-102.
[9] Sans Capdevila O, Crabtree VM, Kheirandish-Gozal L, et al. Increased morning brain natriuretic peptide levels in children with nocturnal enuresis and sleep-disordered breathing: a community-based study[J]. Pediatrics, 2008, 121(4): e1208-1214.
[10] Su MS, Li AM, So HK, et al. Nocturnal enuresis in children: prevalence, correlates and relationship with obstructive sleep apnea[J]. J Pediatr, 2011, 159(2): 238-242.
[11] Sedky K, Bennett DS, Carvalho KS. Attention defcit hyperactivity disorder and sleep disordered breathing in pediatric population: a meta-analysis[J]. Sleep Med Rev, 2014, 18(4): 349-356.
[12] Halasz P, Terzano M, Parrino L, et al. The nature of arousal in sleep[J]. Sleep Res, 2004, 13(4): 1-23.
[13] Goldbart AD, Greenberg-Dotan S, Tal A. Montelukast for children with obstructive sleep apnea: a double-blind, placebo-controlled study[J]. Pediatrics, 2012, 130(3): e575-e580.
[14] Kheirandish L, Goldbart AD, Gozal D. Intranasal steroids and oral leukotriene modifer therapy in residual sleep-disordered breathing after tonsillectomy and adenoidectomy in children[J]. Pediatrics, 2006, 117(1): e61-e66.
(本文编辑:丁敏娇)
Mechanism of risk factors alert and systematic inflammation response in children with obstructive sleep apnea and hypopnea syndrome
SU Miaoshang1, YU Chenyi1, ZHANG Yuanbo2, ZHOU Yangyang2, XU Li2,CAI Xiaohong1.
1.Department of Paediatric Respiratory Medicine, the Second Affiliated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.The Second Clinical Medical College of Wenzhou Medical University, Wenzhou, 325035
Objective: To investigate the risk factors alert mechanism in children with obstructive sleep apnea and hypopnea syndrome (OSAHS), and to determine the correlation of arousal and systematic infammation response. Methods: Two hundred and eighty-fve cases of snoring children aged 6-11 years old were included, sleep questionnaires were completed by their parents. All the children performed the whole night polysommongraphy (PSG), the total sleep time (TST), sleep effciency, sleep structure, oxygen desaturation, and various respiratory disorder index were assessed by physician. Thirty children at high risk and low risk for obstructive sleep apnea syndrome (OSAHS) were randomly selected to detect the blood routine, C reactive protein (CRP) and interleukin-1β (IL-1β) levels. Results: Fifty-six cases (19.6%) of snoring children were diagnosed OSAHS by PSG. Logistic regression analysis showed that tonsil and adenoid hypertrophy, habitual snoring, obesity, mouth breathing, enuresis, hyperactivity and irascibility were the main risk factors. PSG study showed that TST, sleep effciency, deep sleep (stage III and IV) and REM sleep time decreased, light sleep (stage I and II), arousal index (AI), OAI, AHI and RDI increased in OSAHS children. IL-1β and CRP levels increased in OSAHS children. Pearson correlation analysis showed there was positive correlation between AI and RDI (r=7.56, P<0.01). Furthermore, AI correlated with the level of IL-1β (r=6.85, P<0.01). Conclusion: Tonsil and adenoid hypertrophy, habitual snoring, obesity, mouth breathing, enuresis, hyperactivity and irascibility are the main risk factors ofOSAHS children. AI increases in accord with RDI and this phenomenon may correlate with systematic mild infamation reponse.
obstructive sleep apnea and hypopnea syndrome; polysommongraphy; arousal; infammation; risk factors; children
R725.6
ADOI: 10.3969/j.issn.2095-9400.2015.03.006
2014-09-30
浙江省医药卫生平台骨干人才计划项目(2013RCA037);国家重点临床专科开放课题(20130211,20130209);浙江省科技厅科研基金资助项目(2013C33174);浙江省自然科学基金资助项目(Y2110277);浙江省卫生厅科研基金资助项目(2014ZDA014)。
苏苗赏(1979-),男,浙江温州人,副主任医师,硕士。

