利用NMR技术研究极性二肽与金属离子间的相互作用
刘 絮 , 彭苗苗 , 郭艳春, 曹书霞, 赵玉芬,2
(1.郑州大学 化学与分子工程学院 河南 郑州 450001; 2.厦门大学 化学化工学院 福建 厦门 361005)
利用NMR技术研究极性二肽与金属离子间的相互作用
刘 絮1, 彭苗苗1, 郭艳春1, 曹书霞1, 赵玉芬1,2
(1.郑州大学 化学与分子工程学院 河南 郑州 450001; 2.厦门大学 化学化工学院 福建 厦门 361005)
利用核磁滴定法研究了极性链状二肽(均为LL构型)与金属离子之间的相互作用.极性二肽在与一价金属离子相互作用时,两者间的化学计量比为1∶1,并求得Li+与10种极性二肽结合常数的大小,其中与L-Glu-L-Glu的结合常数最大,这可能与L-Glu-L-Glu含有较多的富电子原子有关.在此基础上又研究了Cu2+,Zn2+,Co2+3种二价金属离子与极性二肽间的相互作用,结果表明,二价金属离子与二肽间的相互作用是通过两步完成的.
核磁共振; 极性二肽; 金属离子; 结合常数
0 引言
分子识别是生物体系的基本特征,是一种有目的、有选择的过程,此过程可能引起体系的电学、光学性质及构象的变化,也可能引起化学性质的变化,从而引起化学信息的存储、传递及处理.因此,分子识别在信息处理及传递、分子及超分子器件制备过程中起着重要作用[1].分子识别属于超分子化学范畴,是研究一个给定的受体或主体分子与底物或客体分子的相互作用.在生物体内,各类氨基酸以及肽类化合物经常与不同的金属离子结合形成超分子化合物,此类化合物在生物体的生命活动中起着重要的作用[2-3].
核磁共振法是一种比较直观地反映主、客体之间相互作用的方法,此方法的多种参数使它成为研究溶液中分子结构的有力工具.通过测定1H,13C,15N,31P及各种二维谱,可以得到有关化学位移、耦合常数、化学交换和扩散系数等方面的信息[4-6].化学位移是最直观反映分子间相互作用的参数,核的化学位移的变化反映了核周围的磁场变化,由此可以推断是否有分子间相互作用的存在以及分子构象是否发生改变等.随着NMR技术解析得到的蛋白质和核酸的数量越来越多,化学位移数据库不断完善,使化学位移成为除耦合常数和NOE以外的大分子结构计算的重要参数[7-8].文[9]利用核磁共振和紫外光谱研究了水溶性的纤维低聚糖与CBDN1间的相互作用,并根据NMR-1H,15N化学位移和紫外吸收的变化,计算出不同低聚糖与CBDN1作用的结合常数.文[10]运用核磁共振技术研究了金属钙离子与蛋白之间的相互作用,并进行了三级结构的解析,为蛋白与金属间相互作用的研究提供了很好的参考数据.肽是指氨基酸之间以酰胺键连接的一类化合物,可以由两个氨基酸或多个氨基酸脱水缩合得到,是蛋白的主要组成成分.二肽是其中最简单的分子,通常根据构成二肽的氨基酸的极性特征,将二肽分为极性二肽和非极性二肽.即连有极性侧链的氨基酸构成的二肽,称为极性二肽;反之,连有非极性侧链的氨基酸构成的二肽,称为非极性二肽.作者通过核磁共振技术,利用核磁滴定法测定了10种极性二肽分子与Li+间的结合常数,并探讨了这10种极性二肽与3种二价金属离子间的相互作用,为完善金属离子与二肽之间相互作用的理论研究以及揭示超分子识别作用的机制奠定了良好的实验基础.
1 实验仪器与试剂
Bruker DPX 400 MHz核磁共振仪,Sartorius BP211D分析天平,TGL-16台式离心机,XW-80A漩涡混合器.
LiCl和CsCl购自上海市新华化工厂;NaCl购自天津市德恩化学试剂有限公司;KCl购自北京市双环化学试剂厂;Cu(NO3)2·3H2O购自天津市化学试剂三厂;Zn(NO3)2·6H2O购自上海市振欣试剂厂;Co(NO3)2·6H2O购自天津市科密欧化学试剂公司;d6-DMSO由北京市崇熙科技孵化器有限公司提供;L-Asp-L-Asp,L-Glu-L-Glu,L-Thr-L-Thr,L-Arg-L-Arg,L-His-L-Lys,L-Tyr-L-Arg,L-Asp-L-Tyr,L-Gln-L-Gly,L-Asp-L-Pro和Gly-Gly二肽均购于吉尔生化(上海)有限公司,其化学结构如图1所示.

图1 极性二肽的化学结构Fig.1 Chemical structures of polar dipeptides
2 实验方法
2.1 溶液的配制

图2 L-Glu-L-Glu与Li+的NMR Job plot曲线Fig.2 NMR Job plot of L-Glu-L-Glu toward Li+
以氘代的DMSO为溶剂,配制0.2 mol/L的极性链状二肽溶液和一系列不同浓度的金属离子溶液,将二者等体积混合,使得极性链状二肽的最终浓度均为0.1 mol/L,同时极性链状二肽的浓度与金属离子的浓度比分别为1∶0,1∶1,1∶2,1∶3,1∶4,1∶5,1∶6,1∶7,1∶8,1∶9,1∶10,1∶15和1∶20.对各组样品进行1H-NMR检测.
2.2 结合常数的计算
首先利用核磁滴定法测定二肽与一价金属离子的化学计量比,图2为L-Glu-L-Glu与Li+的NMR Job plot曲线.不断改变L-Glu-L-Glu浓度(ca)与金属离子浓度(cb),而保持二者的总浓度为0.1 mmol/L.随着二者浓度比例的改变,L-Glu-L-Glu氨基上N—H的化学位移也会随之变化,根据离子浓度与氨基上N—H化学位移的变化值,利用 Job plot 方程拟合[11],可知L-Glu-L-Glu与Li+的化学计量比为1∶1.
当两者结合比为1∶1时,极性链状二肽与一价金属离子相互作用的结合常数,是由极性链状二肽氨基上N—H的化学位移值对加入的金属离子的浓度进行非线性最小二乘法拟合得到的.在滴定过程中,随着金属离子浓度的不断增加,直链二肽N—H的化学位移随之改变.根据化学位移的变化可以计算两者的结合常数,相应的计算公式如下[9]:
Ka=fci/(0.1fci2-fci[Lt]i-0.1fci+[Lt]i),
(1)
其中,fci=(δi- δf)/( δc- δi),δf为未加金属离子时二肽N—H的化学位移值;δc为金属离子与二肽完全结合时二肽N—H的化学位移值;δi为核磁滴定时任一状态下二肽N—H的化学位移值;[Lt]i为任一时刻金属离子的浓度.
对于二价金属离子,由于离子势、离子半径等不尽相同并且其本身具有顺反磁性,可以采用固定金属离子浓度的方法,逐渐滴加二肽,根据N—H化学位移的变化来定性比较它们之间相互作用的强弱.
3 结果与讨论
3.1 极性链状二肽与一价金属离子的相互作用
分别研究了10种极性链状二肽与4种一价金属离子(Li+,Na+,K+和Cs+)的相互作用.现主要以L-Glu-L-Glu在加入Li+后氨基N—H化学位移的变化来说明它们之间的相互作用.
3.1.1 L-Glu-L-Glu与Li+的结合常数 L-Glu-L-Glu与Li+以不同的浓度配比1∶0,1∶1,1∶2,1∶3,1∶4,1∶5,1∶6,1∶7,1∶8,1∶9,1∶10,1∶15,1∶20对其进行1H-NMR的测定,相应N—H的化学位移值δi分别为8.188 4,8.415 1,8.488 2,8.527 4,8.548 9,8.564 6,8.575 8,8.583 3,8.589 5,8.593 7,8.597 9,8.615 2,8.618 4.当二肽与金属离子的浓度比ca∶cb=1∶0时,δi即为δf.
为了更直观地观察L-Glu-L-Glu氨基N—H化学位移变化规律,以ca∶cb为横坐标,δi(N—H)为纵坐标作图.如图4所示,当Li+的浓度配比不断增加时,N—H的化学位移也会随之增大,但其增大的幅度在不断减小.当二肽与金属离子的浓度比为1∶15时,随着金属离子浓度的增大,N—H的化学位移值变化不再明显,此时可认为两者之间的结合已经达到饱和状态,即使再增大金属离子浓度也不会引起化学位移值明显的变化,此时的N—H化学位移值即为δc.

图3 L-Glu-L-Glu中的N—H化学位移随Li+的 加入其核磁堆积图Fig.3 The stack 1H-NMR spectra of N—H chemical shifts in L-Glu-L-Glu with adding Li+
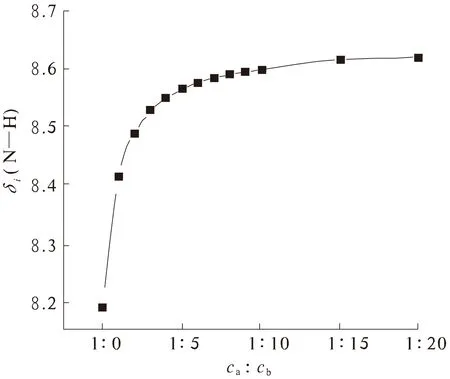
图4 N—H化学位移变化规律Fig.4 The change rule of N—H chemical shifts
将不同浓度比下L-Glu-L-Glu中N—H的化学位移值代入公式(1),即可计算出两者之间相互作用的结合常数Ka=36.4 L/mol.
3.1.2 极性链状二肽与Li+的结合常数 根据以上计算方法,运用公式(1)可以求出Gly-Gly,L-Asp-L-Asp,L-Arg-L-Arg,L-Thr-L-Thr,L-Glu-L-Glu,L-His-L-Lys,L-Tyr-L-Arg,L-Gln-L-Gly,L-Asp-L-Tyr,L-Asp-L-Pro与Li+相互作用的结合常数Ka,结果分别为7.4,11.6,29.5,34.3,36.4,31.1,22.8,16.3,14.8,10.0 L/mol.
由于不同的极性链状二肽含有不同的侧链基团,当它们与金属离子作用时,其结合能力也各不相同.L-Glu-L-Glu与L-Asp-L-Asp相比,前者侧链比后者多两个碳原子,更易于折叠弯曲,能更好地与金属离子结合,因此前者与Li+的结合常数较后者大.L-Glu-L-Glu,L-Thr-L-Thr,L-His-L-Lys以及L-Arg-L-Arg这4种二肽因为含有较多的富电子原子,如N,O等,能够更好地向缺电子的Li+提供电子,因而其结合常数比其他二肽大.尤其是L-Glu-L-Glu,因其含有较多的氧原子以及更长的碳链,更易于折叠扭曲,其与Li+的结合常数为最大.与之相反,Gly-Gly不仅没有侧链基团,而且其在氘代试剂中溶解度很小,所以与Li+的结合能力最弱.由于Na+,K+和Cs+形成的盐在各种氘代试剂中的溶解性极小,导致利用NMR法测定它们与二肽的结合常数均很小,且重现性不好,不能真实反映二者间相互作用的能力,故未列出.
3.2 极性链状二肽与二价金属离子的相互作用


图5 L-Gln-L-Gly与Cu2+之间相互作用的线性关系图Fig.5 The linear graph of the interaction between L-Gln-L-Gly and Cu2+

图6 L-Gln-L-Gly与Zn2+之间相互作用的线性关系图Fig.6 The linear graph of the interaction between L-Gln-L-Gly and Zn2+
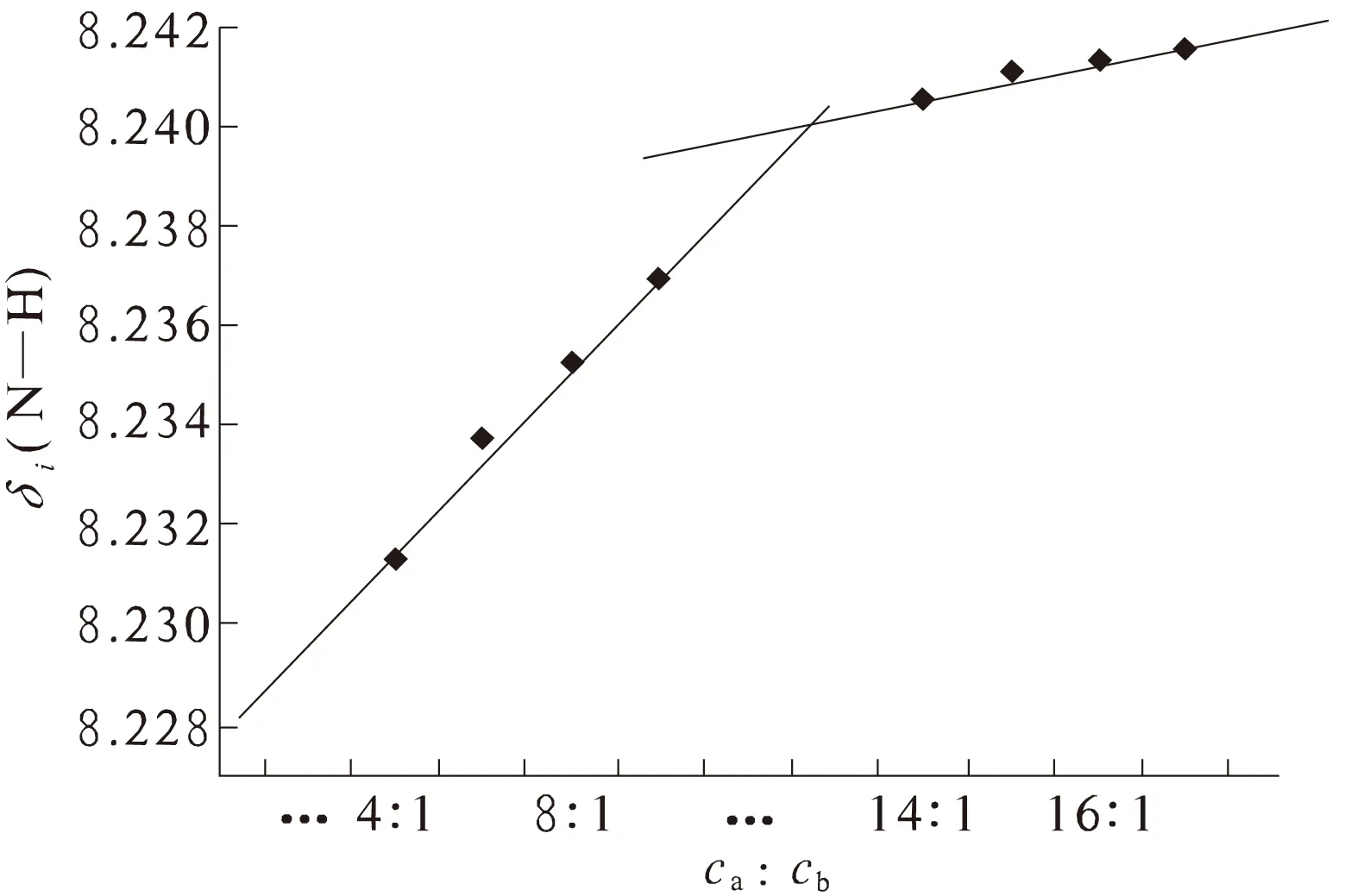
图7 L-Gln-L-Gly与Co2+之间 相互作用的线性关系图Fig.7 The linear graph of the interaction between L-Gln-L-Gly and Co2+
从3个关系图中可以看出,固定某种金属离子的含量不变,当不断向体系中滴加二肽时,N—H的化学位移并不像一价金属离子那样呈规律性增加,而是出现随着二肽的滴加,N—H的化学位移值不断减小或者不断增大的现象,并且在减小和增大的过程中有拐点出现,即在作图时会出现两条斜率不同的直线.这种现象的产生可能与金属离子本身具有一定的磁性(Cu2+,Zn2+为抗磁性,Co2+为顺磁性)以及由于电荷离域化而诱导出接触位移有关.研究[14-15]表明,在金属离子和有机分子相互作用的过程中,所呈现出来的线性关系图的斜率跟结合常数直接相关.由此可以判定,二价金属离子与二肽的相互作用是通过两步进行的.根据线性关系图的斜率,可以定性地判断极性链状二肽与Co2+的结合能力稍强于与Zn2+的结合能力.
[1] 刘育, 尤长城, 张衡益. 超分子化学:合成受体的分子识别与组装 [M]. 天津:南开大学出版社,2001: 1-5.
[2] Grese R P, Cerny R L, Gross M L. Metal ion-peptide interactions in the gas phase: a tandem mass spectrometry study of alkali metal cationized peptides [J]. J Am Chem Soc, 1989, 111(8): 2835-2842.
[3] Teesch L M, Adams J. Intrinsic interactions between alkaline earth metal ions and peptides: a gas-phase study [J]. J Am Chem Soc, 1990, 112(11): 4110-4120.
[4] 姜凌. ATP与某些金属离子相互作用的NMR研究 [D]. 武汉: 中国科学院研究生院, 2002.
[5] Case D A, Dyson H J, Wright P E. Use of chemical shifts and coupling constants in nuclear magnetic resonance structural studies on peptides and proteins [J]. Methods Enzymol, 1994, 239: 392-416.
[7] Wishart D S, Sykes B D. Chemical shifts as a tool for structure determination [J]. Methods Enzymol, 1994, 239: 363-392.
[8] Wijmenga S S, Kruithof M, Hilbers C W. Analysis of1H chemical shifts in DNA: assessment of the reliability of1H chemical shift calculations for use in structure refinement [J]. J Biomol NMR, 1997, 10(4): 337-350.
[9] Johnson P E, Tomme P, Joshi M D, et al. Interaction of soluble cellooligosaccharides with the N-terminal cellulose-binding domain of cellulomonas fimi CenC:2. NMR and ultraviolet absorption spectroscopy [J]. Biochemistry,1996, 35(44):13895-13906.
[10]洪晶, 郭晨云, 刘华, 等. 八肋游仆虫中心蛋白的核磁共振研究 [J]. 福州大学学报:自然科学版, 2012, 40(6): 823-827.
[11]Huang C Y. Determination of binding stoichiometry by the continuous variation method: the Job plot[J]. Methods Enzymol, 1982, 87: 509-525.
[12]Gooding J, Hibbert D B, Yang W R. Electrochemical metal ion sensors: exploiting amino acids and peptides as recognition elements [J]. Sensors, 2001, 1: 75-90.
[13]Nakon R, Angelici R J. Copper (Ⅱ) and zinc (Ⅱ) binding of optically active dipeptides [J]. J Am Chem Soc, 1974, 96(13): 4178-4182.
[14]Perlmutter-Hayman B. Cooperative binding to macromolecules: a formal approach [J]. Acc Chem Res, 1986, 19(3):90-96.
[15]Thordarson P. Determining association constants from titration experiments in supramolecular chemistry [J]. Chem Soc Rev, 2011, 40(3): 1305-1323.
(责任编辑:孔 薇)
Study of the Interaction Between Polar Dipeptides and Metal Ions by NMR
LIU Xu1, PENG Miao-miao1, GUO Yan-chun1, CAO Shu-xia1, ZHAO Yu-fen1,2
(1.CollegeofChemistryandMolecularEngineering,ZhengzhouUniversity,Zhengzhou450001,China;2.CollegeofChemistryandChemicalEngineering,XiamenUniversity,Xiamen361005,China)
The interactions of 10 polar chain dipeptides(L-L configuration) with metal ions were examined by NMR. These polar chain dipeptides exhibited a tremendous selectivity toward monovalent mental ion, showing a stoichiometric binding with 1∶1, and the association constants of dipeptides with Li+were acquired. The results showed that L-Glu-L-Glu had stronger binding ability toward Li+ions than other dipeptides, and suggested the electron-rich atoms in L-Glu-L-Glu molecular were favorable for the interaction with metal ions. Furthermore, the interactions of divalent metal ions(Cu2+, Zn2+, Co2+) with 10 polar chain dipetieds were studied, which implied the interaction between them was carried out in two stages.
NMR; polar dipeptide; metal ion; association constant
2015-03-11
国家自然科学青年基金资助项目,编号21105091.
刘絮(1983-),女,河南驻马店人,助理实验师,硕士,主要从事生物化学研究,E-mail:lxcod@zzu.edu.cn;通讯作者:郭艳春(1972-),女,河南郑州人,讲师,博士,主要从事有机磷化学研究,E-mail:ycguo@zzu.edu.cn.
刘絮,彭苗苗,郭艳春,等.利用NMR技术研究极性二肽与金属离子间的相互作用[J].郑州大学学报:理学版,2015,47(3):82-86.
O482.53
A
1671-6841(2015)03-0082-05
10.3969/j.issn.1671-6841.2015.03.016

