碳青霉烯类抗生素亲水作用色谱方法研究及其应用
朱银芳, 纪顺利, 李绍辉, 李 成, 章飞芳* , 梁鑫淼,2
(1. 华东理工大学,上海200237;2. 中国科学院大连化学物理研究所,辽宁 大连116023)
碳青霉烯类抗生素属于非典型β-内酰胺类抗生素,对大多数革兰氏阳性和革兰氏阴性细菌具有广谱抗菌活性[1-3]。该类抗生素通过与青霉素结合蛋白(PBPs)结合而抑制细菌细胞壁的合成,从而发挥抗菌作用。在临床上,被广泛用于各种严重细菌感染的治疗,如腹内、泌尿道、下呼吸道或皮肤感染等,市场前景良好[1-3]。然而抗生素类药物的大量使用,不仅会使细菌耐药性增强,还会对环境生态和人类健康产生影响。有必要发展该类抗生素的快速、灵敏的分析方法。
目前国内外已有很多关于碳青霉烯类抗生素的分析研究,主要包括生物基质和药物制剂中该类抗生素的含量测定及其质量控制[4-7]。文献报道的碳青霉烯类抗生素的分析方法包括反相色谱法(RPHPLC)[8-12]、液相色谱-质谱法(LC-MS)[13-15]、毛细管电泳法(CE)[16,17]和微生物学测定法[18]等。其中,RP-HPLC 是碳青霉烯类抗生素最常用的分析方法,但该模式常常需要使用高浓度磷酸盐或醋酸钠缓冲液作为流动相添加剂,这些不挥发性无机盐与质谱不兼容,故所发展方法无法与质谱联用。这就难以满足某些痕量抗生素残留检测的需求。
1990 年Alpert 首次提出的亲水作用色谱(HILIC)特别适合用来分离极性或碱性化合物[19]。随着HILIC 的发展,它已被广泛应用于许多领域,如代谢组学研究[20,21]、药品及其杂质分析[22]和二维液相色谱分析[23,24]等。尽管如此,亲水作用色谱法应用于碳青霉烯类抗生素分析的文献报道非常有限[25,26]。因此,本文系统考察了乙腈比例、缓冲盐浓度和pH对4 种碳青霉烯类抗生素(比阿培南、美罗培南、多利培南、厄他培南)在XAmide 色谱柱上保留的影响,建立了测定尿液和自来水中4 种碳青霉烯类抗生素的HILIC 分析方法。
1 实验部分
1.1 仪器与试剂
Waters Alliance 高效液相色谱仪(美国Waters公司),包括e2695 分离单元(自动进样器、在线脱气器和四元泵)、2489 紫外检测器;Milli-Q 纯水净化系统(美国Millipore 公司);KH5200B 型超声波清洗器(昆山禾创超声仪器有限公司);pH 计(美国Mettler Toledo 公司)。
比阿培南、多利培南、美罗培南和厄他培南标准品(沈阳东北制药总厂),于-70 ℃避光保存,其结构如图1 所示;乙腈(ACN)(HPLC 级,北京百灵威科技有限公司);甲酸铵(HCOONH4)和甲酸(HCOOH)(纯度分别为99% 和98%,美国Acros 公司)。实验中所用试剂至少为分析纯。实验用水为Milli-Q 纯水净化系统制备的超纯水(电阻率18.2 MΩ·cm)。
1.2 标准溶液的配制
分别准确称取4 种碳青霉烯类抗生素标准品适量,用水溶解并配制成1 g/L 的标准储备液,分装在冷冻管中,于-70 ℃冰箱中避光保存备用。使用时待室温融化后稀释至所需浓度。准确移取适量的4种抗生素标准储备液,用起始流动相配制成10 mg/L 的混合标准工作液,于4 ℃下避光保存。用起始流动相逐级稀释标准储备液,配制0.1、0.25、0.5、1、2.5、5、10、25、50、100 和250 mg/L 系列混合标准溶液,于4 ℃避光保存。根据文献[4]报道,该类抗生素由于其结构中含有一个β-内酰胺环,在水溶液中不稳定,且对光照和温度敏感,易发生降解,故将其低温避光保存。
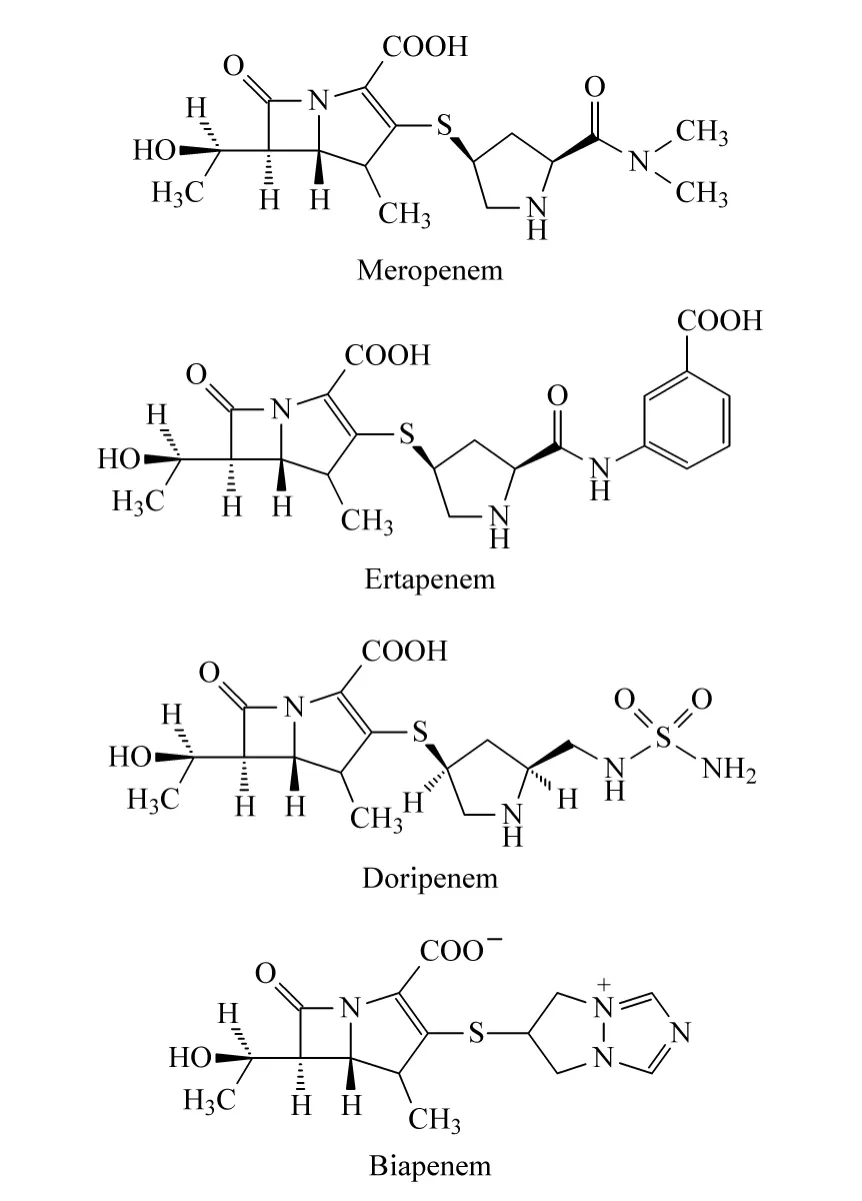
图1 4 种碳青霉烯类抗生素的化学结构Fig.1 Chemical structures of the four carbapenems
1.3 色谱条件
色谱柱:XAmide 色谱柱(150 mm×4.6 mm,5 μm,华谱新创科技有限公司),柱温:25 ℃;流速:1 mL/min;进样量:10 μL;检测波长:293 nm;分离条件:流动相A 为水,B 为乙腈,C 为0.1 mol/L 甲酸铵(pH=5.4);梯度洗脱程序:0 ~15 min,90% B ~60% B,10% C;15 ~17 min,60% B ~90% B,10% C。
1.4 加标回收率试验及空白试验
选用不含有上述4 种抗生素的健康志愿者尿液及自来水样品,分别添加两个含量水平(5 mg/L 和25 mg/L)的各抗生素标准物质,进行回收率试验,每个浓度设5 个平行样品。其中尿液样品在3 500 r/min 转速下离心10 min 后,取上清液进行HPLC分析。实验中选取超纯水为试样,进行空白试验。
2 结果与讨论
2.1 色谱条件的优化
主要考察了乙腈比例、缓冲盐浓度和pH 对4种碳青霉烯类抗生素保留的影响。
2.1.1 乙腈比例的影响
在HILIC 中,乙腈通常为弱洗脱溶剂,而水则是强洗脱溶剂。因此,流动相中乙腈比例是影响目标组分保留的重要因素之一。通过保持流动相中甲酸铵浓度和pH 不变,考察了流动相中乙腈比例对抗生素保留的影响。如图2 所示,随着乙腈浓度的增加4 种组分的保留均不断增加,这与RPLC 模式下正好相反,表明4 种抗生素在XAmide 色谱柱上的保留属于典型的HILIC 保留机理。综合分析时间、保留强度和对称因子,选择乙腈比例为0 ~5 min,80% ~65% ACN;5 ~12 min,65% ACN;12~14 min,65% ~80% ACN 以进行后续研究。
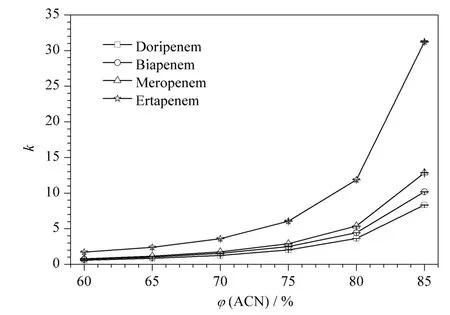
图2 乙腈体积分数对保留的影响Fig.2 Effect of ACN volume percentage on the retention
为深入理解碳青霉烯类抗生素在XAmide 色谱柱上的亲水保留行为,特考察如下:根据色谱分离中描述分配机理的理论方程(1)[27]和描述吸附机理的理论方程(2)[28,29]以及卢佩章等提出的液-固色谱保留值方程(3)[30,31],对流动相中不同水含量条件下各个抗生素的保留因子(k)和水含量进行线性回归,结果见表1。

方程(1)中,k 为溶质保留因子,CB为流动相中水相的体积分数,kw是弱洗脱溶剂为流动相时的溶质保留因子,S 是一个依赖于溶质和实验条件的常数;方程(2)中,k 为溶质保留因子,kB是流动相采用强洗脱溶剂时的溶质保留因子,AS和nB的比值为一常数,CB为流动相中水相体积分数;方程(3)中,k 为溶质保留因子,CB为流动相中水相的体积分数,a、b 和c 是常数。从表1 中数据可见,4 种抗生素采用方程(3)得到的线性相关系数更高,这表明吸附机理在分离中起主导作用。
2.1.2 盐浓度的影响
HILIC 流动相中通常加入一些挥发性缓冲盐(甲酸铵或乙酸铵)以改善保留和峰形。保持乙腈比例和pH 不变,考察流动相中甲酸铵浓度的影响,如图3 所示。随着甲酸铵浓度的升高,美罗培南的保留先减弱后增加,多利培南和比阿培南的保留有增强的趋势,总的来说,上述3 种抗生素的保留基本不变;而厄他培南随着盐浓度的升高保留减弱。缓冲盐浓度的升高对保留主要有两方面的影响:一是溶质和固定相表面酰胺基和残余的硅醇基之间的离子相互作用会受到干扰,导致离子交换对保留行为的影响降低,保留减弱;二是使固定相表面的富水层的亲水作用(极性)增强,因而对溶质的保留增强。因此,多利培南和比阿培南主要受第二种作用的影响,美罗培南受两方面的综合影响,而厄他培南主要受第一种作用的影响。此外,比阿培南、多利培南和美罗培南的保留随盐浓度的升高变化趋势不明显,这可能是因为甲酸铵对离子交换作用的干扰减弱了甲酸铵对溶质保留的影响。甲酸铵的存在可有效改善峰形,特别是美罗培南的峰形(美罗培南拖尾比较严重)。综合考虑对称因子和分离度,选择在流动相中加入10% (v/v)的0.1 mol/L 甲酸铵。

图3 盐浓度对保留的影响Fig.3 Effect of salt concentration on the retention

表1 4 种抗生素在XAmide 色谱柱上基于不同回归方程的回归参数Table 1 Regression parameters of the four carbapenems on XAmide column based on different equations
2.1.3 缓冲盐pH 的影响
图4 是缓冲盐pH 值对4 种抗生素在XAmide色谱柱上保留的影响。新配制的甲酸铵(0.1 mol/L)的pH 值约为6.25,使用甲酸调节pH 值从3.0 到6.0。可以看出,缓冲盐pH 对4 种抗生素的保留影响较大。随着缓冲盐pH 的升高,4 种抗生素的保留呈现出先增强后减弱的趋势,尤其是厄他培南趋势最明显。这可能是由于随着pH 逐渐升高,填料表面由于酰胺基和残余硅醇基存在而使净的负电荷增多,与目标样品之间的静电吸引作用加强最终导致分析物的保留增强。但与此同时,pH 升高也会抑制抗生素的解离。一方面,物质的离子状态比分子状态更有利于保留;另一方面,抑制抗生素的解离也会减弱与固定相之间的静电作用。而低pH 条件下,这种作用对抗生素解离的影响不大,在图中表现为保留增强;较高pH 条件下,对抗生素的解离影响较大,在图中呈现出保留减弱的趋势。综合考虑选择pH 5.4 的缓冲盐溶液。

图4 缓冲液pH 对保留的影响Fig.4 Effect of buffer pH on the retention
2.2 方法的线性范围、定量限和精密度
在优化条件下的典型色谱图如图5 所示。4 种抗生素的出峰顺序与其极性顺序相匹配,进一步印证了HILIC 的保留机理。在优化条件下考察了4 种抗生素的线性范围和定量限,具体数据见表2。可以看出,4 种抗生素的峰面积y 与其质量浓度x(mg/L)存在良好的线性关系,线性相关系数(R2)均在0.999 以上。4 种抗生素的定量限范围为0.1~0.5 mg/L。同一天内连续进样6 次,测得日内精密度(RSD)小于3.5%。
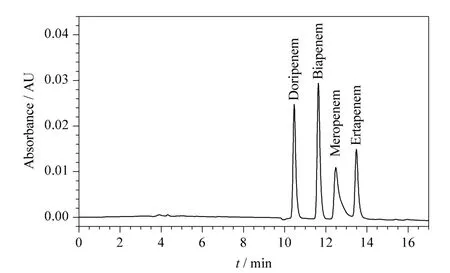
图5 4 种碳青霉烯类抗生素的典型色谱图Fig.5 Typical chromatogram of the four carbapenems
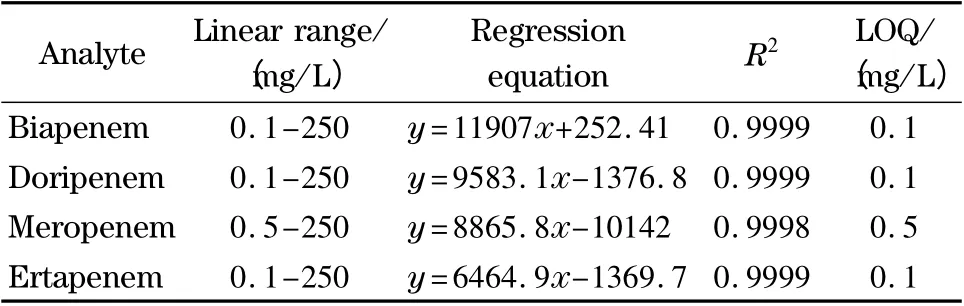
表2 4 种抗生素的线性范围、回归方程、相关系数和定量限(n=3)Table 2 Linear ranges,regression equations,correlation coefficients and limits of quantitation (LOQs)of the four carbapenems (n=3)
2.3 加标回收率试验
为验证所发展方法的实用性,进行了尿液和自来水中4 种抗生素的加标回收率试验。对于尿液样品,在5 mg/L 和25 mg/L 两个加标水平进行加标回收试验,所得回收率为100.4% ~111.9%,RSD<1%。对于自来水样品,在5 mg/L 和25 mg/L 两个加标水平所得回收率为79.6% ~107.4%,RSD <5%。
3 结论
本文建立了同时测定人尿液和自来水中4 种碳青霉烯类抗生素的HILIC 分析方法。通过优化分离条件,4 种抗生素均得到了基线分离,且可在15 min 内完成分离;结果表明4 种抗生素在XAmide色谱柱上的保留以吸附为主,符合典型HILIC 机理。本方法所使用的流动相与质谱兼容,因此可拓展用于HILIC-MS 联用技术实现对痕量抗生素的测定。这方面的工作尚在进行中。
[1] Zhanel G G,Wiebe R,Dilay L,et al. Drugs,2007,67(7):1027
[2] Li M Y,Wu H W. Herald of Medicine (李明艳,吴洪文. 医药导报),2014,33(3):352
[3] Xie Q E,Lin F L,Pang S Q. Journal of North Pharmacy(谢奇恩,林福林,庞素秋. 北方药学),2011,8(2):51
[4] Cielecka-Piontek J,Michalska K,Zalewski P,et al. Curr Pharm Anal,2011,7(4):213
[5] Cielecka-Piontek J,Michalska K,Zalewski P,et al. Curr Anal Chem,2012,8(1):91
[6] Jia Y H,Xing W W. Chinese Journal of New Drugs(贾燕花,邢维伟. 中国新药杂志),2013,22(11):1285
[7] Lara F J,del Olmo-Iruela M,Cruces-Blanco C,et al. TrACTrends Anal Chem,2012,38:52
[8] Qin Y P,Mei Y J,Zhang L,et al. China Measurement &Test (秦永平,梅亚君,章丽,等. 中国测试),2015,41(5):54
[9] Yang Y,Li X,Xu B,et al. Central South Pharmacy (杨阳,李昕,徐兵,等. 中南药学),2014,12(8):761
[10] Kong W H,Ju H S,Wang X X,et al. Chinese Pharmaceutical Journal (孔维华,鞠浩爽,王晓雪,等. 中国药学杂志),2014,49(14):1247
[11] Legrand T,Chhun S,Rey E,et al. J Chromatogr B,2008,875(2):551
[12] Dailly E,Bouquié R,Deslandes G,et al. J Chromatogr B,2011,879(15/16):1137
[13] Xia M,Hang T J,Zhang F,et al. J Pharm Biomed Anal,2009,49(4):937
[14] Wang X X,He J,Cui G,et al. China Pharmacy (王晓雪,赫军,崔刚,等. 中国药房),2014,25(45):4294
[15] Wang X X,Zhao T,He J,et al. China Pharmacy (王晓雪,赵铁,赫军,等. 中国药房),2014,25(25):2354
[16] Michalska K,Pajchel G,Tyski S. J Sep Sci,2011,34(4):475
[17] Xia D Y,Guo T,Wu Y H,et al. Chinese Pharmaceutical Journal (夏东亚,郭涛,吴云红,等. 中国药学杂志),2003,38(5):375
[18] Mendez A S L,Weisheimer V,Oppe T P,et al. J Pharm Biomed Anal,2005,37(4):649
[19] Alpert A J. J Chromatogr,1990,499(2):177
[20] Kok M G M,Somsen G W,de Jong G J. Talanta,2015:1
[21] Wang X Y,Gao P,Xu G W. Chinese Journal of Chromatography (王希越,高鹏,许国旺. 色谱),2014,32(10):1084
[22] El-Enany N,El-Sherbiny D,Abdelal A,et al. J Liq Chromatogr R T,2012,35(6):819
[23] Zhang H,Guo Z M,Zhang F F,et al. J Sep Sci,2008,31(9):1623
[24] Xing Q Q,Fu Q,Jin Y,et al. Chinese Journal of Chromatography (邢倩倩,傅青,金郁,等. 色谱),2014,32(7):767
[25] Guo H Y,Liu R H,Yang J J,et al. J Chromatogr A,2012,1223:47
[26] Xu Y,Xie W,Miller-Stein C M,et al. Rapid Commun Mass Spectrom,2009,23(14):2195
[27] Dolan J W,Lommen D C,Snyder L R. J Chromatogr A,1990:55
[28] Snyder L R,Poppe H. J Chromatogr A,1980,184(4):363
[29] Nikitas P,Pappa-Louisi A,Agrafiotou P. J Chromatogr A,2002,946:33
[30] Lu P Z,Lu X M,Li X Z,et al. Chinese Science Bulletin(卢佩章,卢小明,李秀珍,等. 科学通报),1982(19):1175
[31] Lu P Z,Lu X M,Li X Z,et al. Chinese Science Bulletin(卢佩章,卢小明,李秀珍,等. 科学通报),1982(21):1307

