液相色谱-串联质谱法测定牛奶中35 种四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类抗生素残留
王 浩, 赵 丽 , 杨红梅, 潘红艳, 史海良, 钱 聪, 张 杉
(国家食品质量安全监督检验中心,海淀区产品质量监督检验所,北京100094)
抗生素是由细菌、放线菌、真菌等微生物经过培养而得到的次级代谢产物,它可有效地抑制病原微生物的生长、繁殖或直接杀灭病原微生物。广义的抗生素还包括一些用化学方法合成的、有类似作用的人工合成抗菌药物(如磺胺等)。抗生素的研制、筛选、合成对保障人类健康、促进畜牧生产水平提高、满足人类对动物性食品需求等方面做出了巨大贡献。但过量使用抗生素会降低畜牧产品的品质,影响乳品发酵;而且残留有抗生素的动物性产品进入人类食物链,会使体内菌株产生抗生素抗性,扰乱机体内环境平衡,导致菌群失调;也会使易感人群产生过敏反应、激素障碍变态反应。面对抗生素滥用对公众健康的威胁,美国食品和药物管理局(FAO)及世界卫生组织(WHO)早在1969 年就规定了各种动物性食品中抗生素的残留允许标准,WHO 于1979 年规定原料奶及消毒牛奶中不得有抗生素。美国FDA 调查表明,泌乳期乳牛用药不当或不注意安全时间是牛乳中抗生素残留的主要原因。一些不法乳品生产商户在高温季节为防止乳的酸败,往往向牛乳中掺杂各种抗生素,通过抑制细菌生长以达到防止牛奶酸败的目的,这也是牛乳中抗生素残留的一个来源。
目前,检测抗生素的方法有微生物法[1]、酶联免疫法[2]、气相色谱-质谱联用法[3]、液相色谱-串联质谱法等[4-8]。微生物法简单、费用少、速度快,但特异性差,易受其他抗生素影响,且灵敏度不高,检出限较高。酶联免疫法虽有灵敏度高、前处理简单、测定速度快等优点,但检测结果存在假阳性;目前,国际上常用的抗生素确证方法为液相色谱-质谱联用法和气相色谱-质谱联用法,但是气相色谱-质谱联用法存在前处理步骤繁琐、有机试剂消耗量大、测定周期长等缺点。目前,牛奶中四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类等5 类抗生素残留虽然都有标准检测方法,但都存在着操作复杂、溶剂毒性大、费时,不适于大量样品的快速筛查等问题。针对上述问题,本研究采用液相色谱-串联质谱(LCMS/MS)技术快速测定和确证牛奶中35 种四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类等5 类抗生素残留,具有操作简单、灵敏度高、回收率稳定、测定周期短等优点。
1 实验部分
1.1 仪器与试剂
Agilent 6410 型串联三重四极杆质谱(美国Agilent公司),配Agilent 1200 型液相色谱仪;GL-88b 型涡旋混合器(海门市其林贝尔仪器制造有限公司);KQ-5200 型超声波清洗仪(昆山市超声仪器有限公司);RE-2000 型旋转蒸发器(上海市亚荣生化仪器厂);Milli-Q 去离子水发生器(美国Millipore 公司)。
乙腈、甲醇、甲酸(色谱纯);乙酸铵(优级纯);乙二胺四乙酸二钠、柠檬酸、磷酸氢二钠(分析纯);二甲胺四环素、四环素、金霉素、土霉素、强力霉素、甲烯土霉素、磺胺醋酰、磺胺嘧啶、磺胺索嘧啶、磺胺噻唑、磺胺吡啶、磺胺甲基嘧啶、磺胺二甲基嘧啶、磺胺甲氧哒嗪、磺胺对甲氧嘧啶、磺胺间甲氧嘧啶、磺胺氯哒嗪、磺胺甲基异恶唑、磺胺多辛、磺胺地索辛、甲氧苄啶、磺胺甲二唑、磺胺喹沙啉、邻氯青霉素、双氯青霉素、乙氧萘胺青霉素、苯唑青霉素、苄青霉素、苯咪青霉素、甲氧苯青霉素、苯氧乙基青霉素、红霉素、氯霉素、甲砜霉素、氟甲砜霉素等35 种抗生素标准品均购自德国Dr. Ehrenstorfer 公司,纯度为98% ~99%。
1.2 分析条件
1.2.1 色谱条件
条件一(适用于四环素类、磺胺类、青霉素类、大环内酯类抗生素) Eclipse XDB-C8色谱柱(150 mm×2.1 mm,3.5 μm);流速:0.25 mL/min;柱温:30 ℃;进样量:10 μL;流动相:A 为10.0 mmol/L 乙酸铵(含0.35% 甲酸),B 为甲醇;梯度洗脱程序:0 ~3 min,5% B;3 ~20 min,5% B ~25% B;20 ~25 min,25% B ~50% B;25 ~30 min,50% B ~100% B;30 ~35 min,100% B。
条件二(适用于氯霉素类抗生素) Eclipse XDB-C8色谱柱(150 mm×2.1 mm,3.5 μm);流速:0.25 mL/min;柱温:30 ℃;进样量:10 μL;流动相:A 为0.05% 氨水溶液,B 为甲醇;梯度洗脱程序:0 ~3 min,5% B;3 ~5 min,5% B ~100% B;5~12 min,100% B。
1.2.2 质谱条件
离子源:电喷雾离子(ESI)源;扫描方式:四环素类、磺胺类、青霉素类、大环内酯类抗生素为正离子模式,氯霉素类抗生素为负离子模式;检测方式:多反应监测(MRM);干燥气:N2;雾化气压力:275.8 kPa;干燥气温度:340 ℃;干燥气流速:10 L/min。
1.3 样品处理
称取5.00 g 样品(精确至0.01 g),置于25 mL比色管中,先加入3 mL 0.1 mol/L Na2EDTAMcllvaine 缓冲液,涡旋1 min,再用含1% (v/v)氨水的乙腈溶液定容。超声波提取20 min,上清液经滤纸过滤,吸取10.0 mL 滤液至100 mL 鸡心瓶内,并将其接至旋转蒸发仪上,于50 ℃水浴中减压浓缩至近干,加入2.0 mL 含1% (v/v)氨水的30% 甲醇水溶液充分溶解后过0.22 μm 滤膜,滤液用于LCMS/MS 测定。
2 结果与讨论
2.1 样品前处理方法的优化
在质谱MRM 模式下,样品基质对测定的干扰较小,且色谱柱具备一定的分离净化功能,确保极性较强的杂质在4 min 之前被洗脱在质谱仪之外,这样能大大地减轻对质谱仪的污染。故在实验设计时考虑采用较为简单和经济的液-液分配方法进行样品前处理。
2.1.1 提取溶剂的选择
四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类等5 类抗生素的化学性质差异较大。本实验分别以乙腈、Mcllvaine 缓冲液-乙腈、Mcllvaine 缓冲液-碱性乙腈和Mcllvaine 缓冲液-酸性乙腈作为提取剂进行比较,发现乙腈作提取剂时,多数目标化合物的回收率在50% 与90% 之间,而四环素类的回收率不足20%。以Mcllvaine 缓冲液-乙腈为提取剂时红霉素的回收率不足40%。Mcllvaine 缓冲液-酸性乙腈作为提取剂时氯霉素类抗生素回收率下降了15%,同时检测灵敏度降低1 ~2 倍。Mcllvaine 缓冲液-碱性乙腈作为提取剂时各类化合物的平均回收率为60% ~105%,可以满足检测要求。
2.1.2 定容溶剂的选择
本实验发现以流动相作为定容溶剂时,各目标化合物的峰形良好,但红霉素的灵敏度偏低,因此本实验选择甲醇-水为定容溶剂并对两者的比例(9 ∶1、7 ∶3、5 ∶5、3 ∶7、1 ∶9,v/v)进行考察。结果表明,当甲醇比例较低时,目标物的峰形和灵敏度较好,但对旋蒸浓缩后的样品提取物进行复溶时,不能完全溶解残留在旋转蒸发瓶壁上的目标物,导致部分目标物回收率偏低;提高甲醇比例,其对目标物的溶解性增加但峰形变差,最终本实验选择甲醇-水(3 ∶7,v/v)为定容溶剂,同时考虑到红霉素和氯霉素类抗生素的特性,在其中加入1% (v/v)氨水。
2.2 质谱条件的优化
采用直接进样方式将35 种质量浓度为100 μg/L 的四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类等5 类抗生素标准工作溶液分别注入离子源中,在正离子或负离子检测方式下进行母离子全扫描,得到目标化合物的分子离子峰。根据欧盟2002/657/EC 指令规定对于质谱确证方法必须达到4 个确证点的要求,低分辨液相色谱-质谱联用仪检测应在确定母离子的基础上选择两个以上的子离子。以分子离子为母离子进行二级质谱扫描,最后采集全扫描的二级质谱图,得到碎片离子信息,然后再对得到的二级质谱参数如碎裂电压、碰撞能量等进行优化,使定性离子与定量离子产生的离子对强度达到最大。得到的四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类等5 类35 种抗生素的最佳质谱参数见表1。
2.3 色谱条件的优化
2.3.1 色谱柱的选择
为了有利于色谱峰的分离及峰形的改善,本方法分别采用资生堂MGⅢ-C18色谱柱(150 mm×2.1 mm,5 μm)、XDB C18色谱柱(50 mm×4.6 mm,1.8 μm)、ZORBAX SB-Aq 色谱柱(150 mm×2.1 mm,3.5 μm)、Eclipse XDB-C8色谱柱,(150 mm×2.1 mm,3.5 μm)进行分离试验,发现Eclipse XDB-C8色谱柱(150 mm×2.1 mm,3.5 μm)对于全部目标化合物分离效果较好,其他色谱柱对四环素类物质都存在分离效果不理想的问题。
2.3.2 色谱分离条件的选择
选择流动相时应兼顾分离效果及各分离组分的离子化效率,以获得最佳的分辨率和最高的灵敏度。由于抗生素易溶于甲醇或乙腈,试验分别选择甲醇和乙腈作为强洗脱流动相。用乙腈作为流动相时目标化合物的分离效果明显低于甲醇作为流动相时的效果,因此最终选择甲醇作为强洗脱流动相。在水相中加入乙酸铵后,磺胺类和青霉素类抗生素加氢离子峰强度离子化效率明显提高。在水相中加入0.35% 的甲酸是为了提高待测物在电喷雾离子源中的正离子化效率,以提高灵敏度,同时四环素类能形成较好的色谱峰。因此,最终选用10.0 mmoL/L 乙酸铵(含0.35% 甲酸)-甲醇作为流动相。
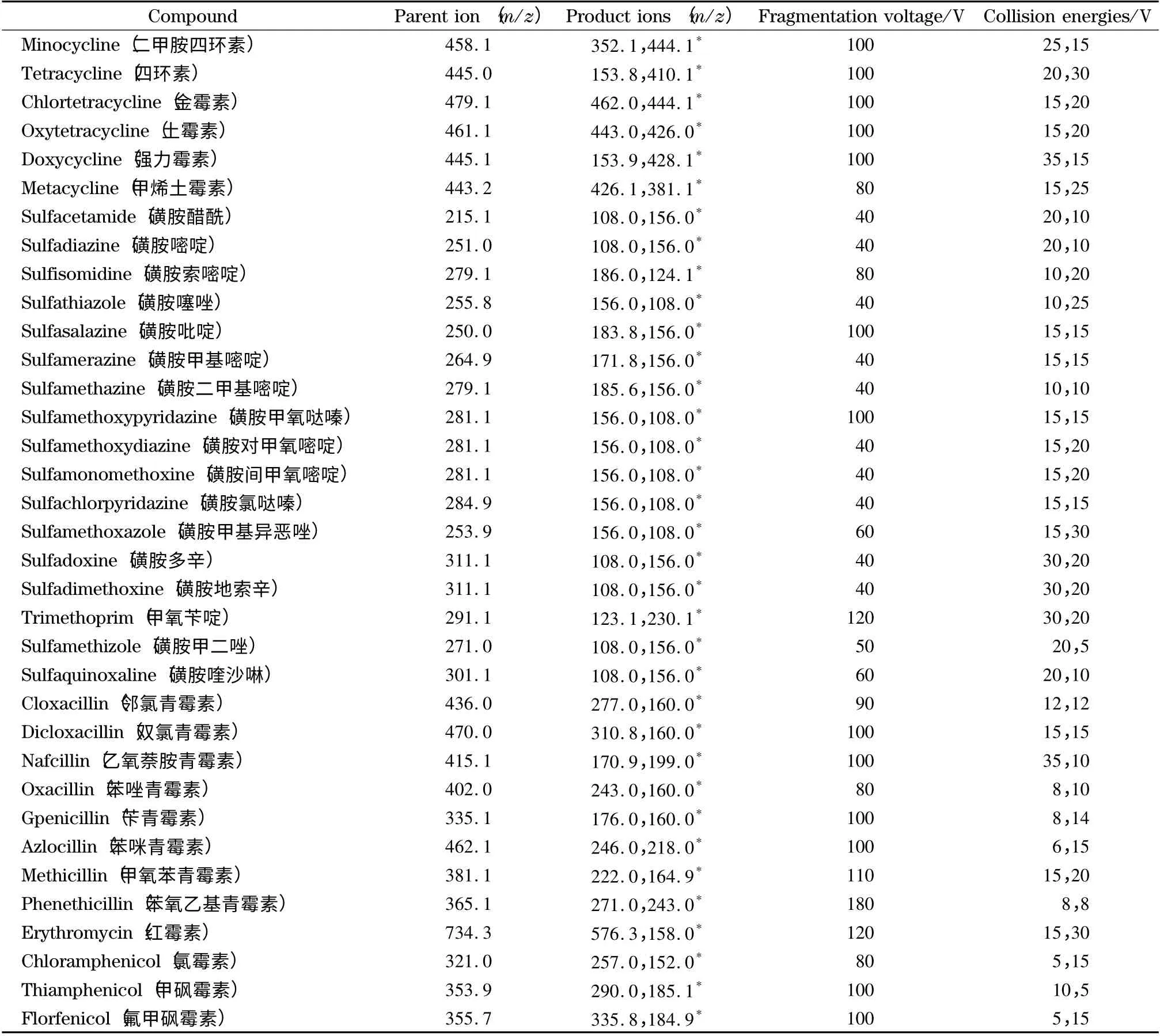
表1 35 种抗生素的质谱参数Table 1 Instrumental parameters for mass spectrometric analysis of the 35 antibiotics
四环素类、磺胺类、青霉素类、大环内酯类等4类抗生素结构差异较大,本方法在色谱条件一中利用梯度洗脱的方法提高分离及检测效果,测试开始时,流动相中10.0 mmoL/L 乙酸铵(含0.35% 甲酸)-甲醇的比例为95 ∶5,然后在0 ~3 min 内保持此比例,目的是洗脱待测液中极性较强的杂质;3 ~20 min 内将二者的比例逐步变为75 ∶25,目的是分离待测液中极性较强的磺胺类抗生素;20 ~25 min 内将二者的比例逐步变为50 ∶50,目的是分离待测液中中等极性的磺胺类抗生素;25 ~30 min 内将二者的比例逐步变为0 ∶100,30 ~35 min 内保持此比例,目的是分离待测液中极性较弱的磺胺类抗生素以及四环素类、青霉素类和大环内酯类抗生素。通过上述3 步梯度洗脱,在35 min 内,可以较好地分离待测液中四环素类、磺胺类、青霉素类和大环内酯类等4 类抗生素。在色谱条件二中也采用梯度洗脱,将3 种氯霉素类抗生素有效分离。
2.3.3 进样量的选择
进样量大可提高测定的灵敏度,但容易污染色谱柱。实验发现,当进样量达到10 μL 时,灵敏度能达到要求,且对色谱柱影响不大。
2.4 线性范围与检出限
用空白样品提取液逐级稀释标准工作液,分别进样10 μL,测定结果经线性回归(y 为峰面积;x 为含量,μg/kg);同时用空白样品进行加标实验,将信噪比为3 条件下对应的被测物含量定为检出限。结果见表2。
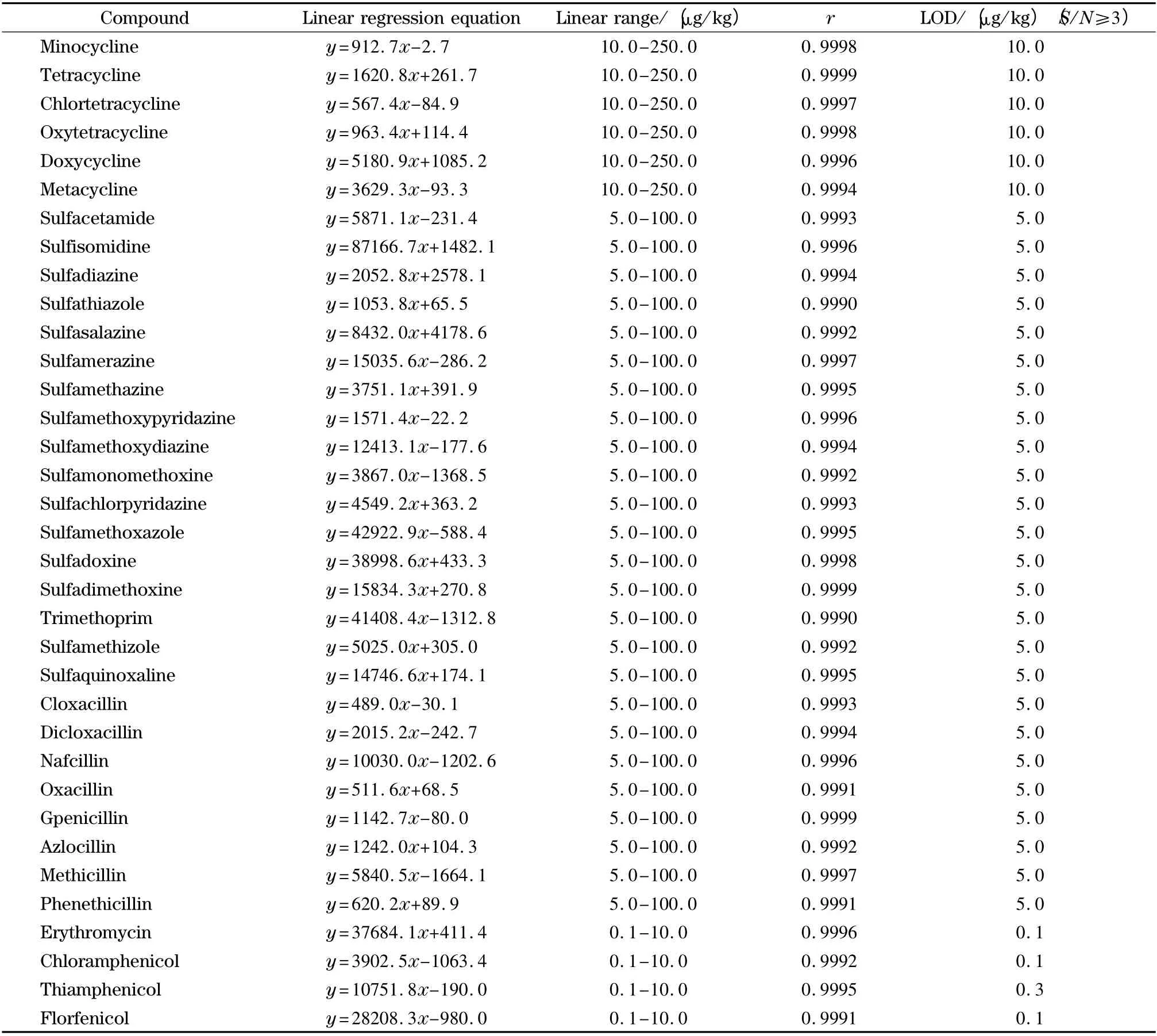
表2 35 种抗生素的线性回归方程、线性范围、线性相关系数和检出限Table 2 Linear regression equations,linear ranges,correlation coefficients (r)and limits of detection (LOD)of the 35 antibiotics
2.5 方法的回收率和精密度
每组准确称取空白样品6 份,每份5.00 g,共3组,分别定量加入目标对照品,第一组添加水平:四环素类、磺胺类、青霉素类抗生素均为10.0 μg/kg,氯霉素类和大环内酯类抗生素均为1.0 μg/kg;第二组添加水平:四环素类、磺胺类、青霉素类抗生素均为25.0 μg/kg,氯霉素类和大环内酯类抗生素均为2.5 μg/kg;第三组添加水平:四环素类、磺胺类、青霉素类抗生素均为50.0 μg/kg,氯霉素类和大环内酯类抗生素均为5.0 μg/kg。按供试品溶液制备方法制备后进行测定,结果见表3。
从表3 可见,平均加标回收率为70.1% ~109.9%,平均相对标准偏差为2.89% ~9.99% (n =6)。
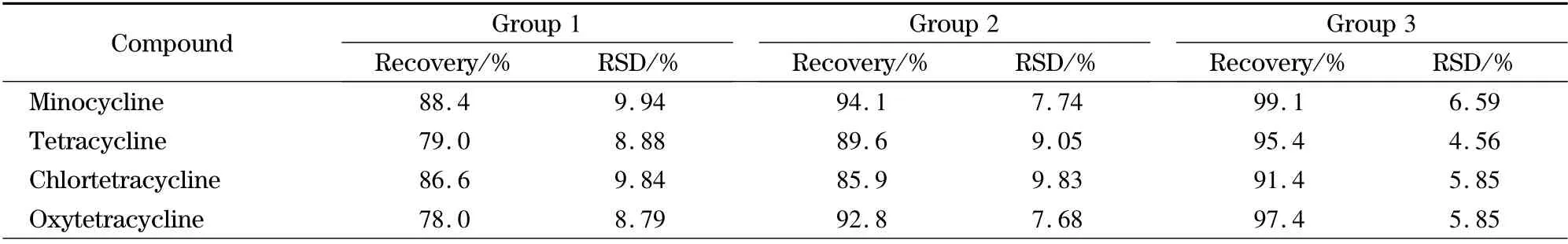
表3 目标物在空白样品中的加标回收率和精密度(n=6)Table 3 Recoveries and relative standard deviations (RSDs)of the targets spiked in samples (n=6)
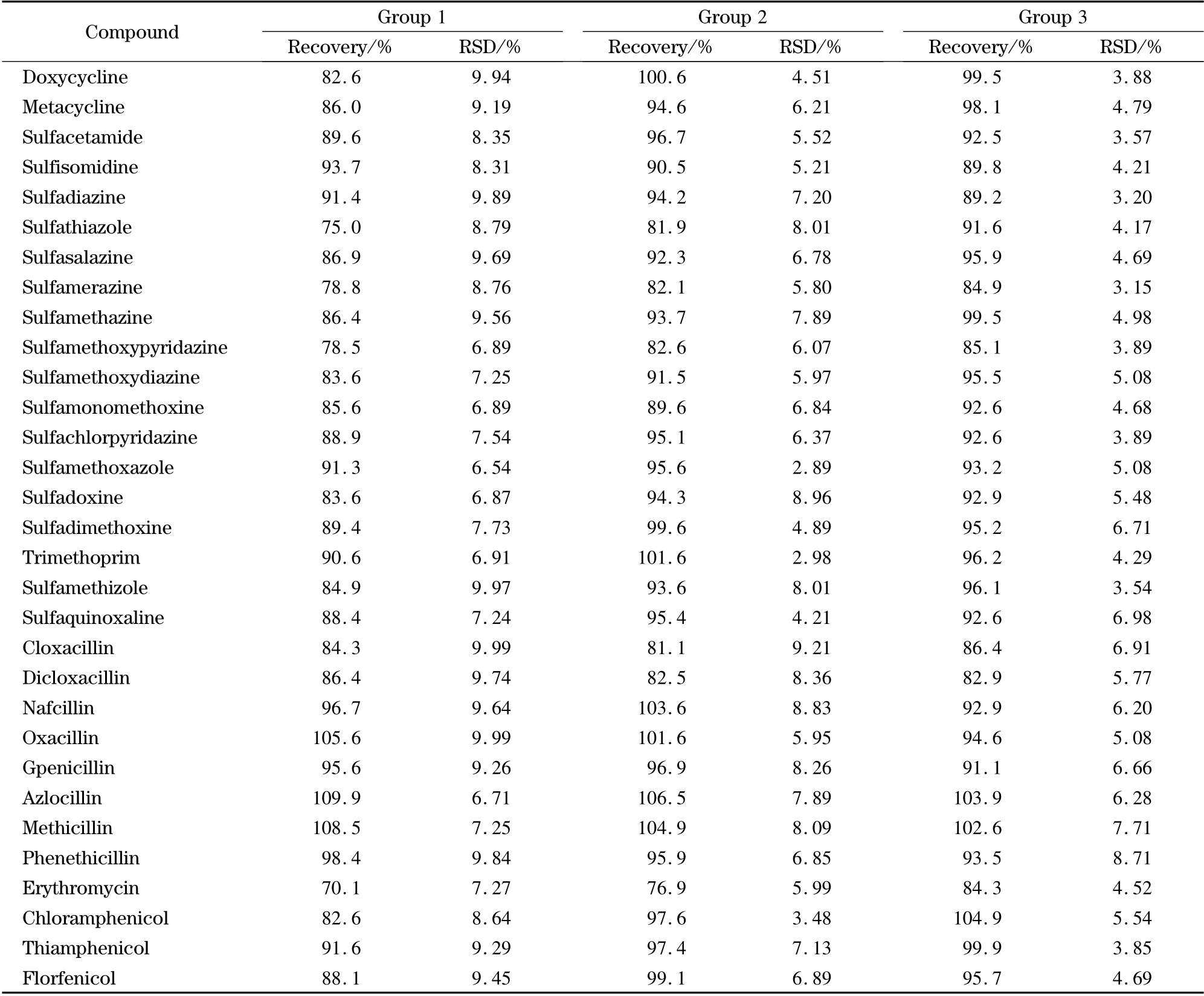
表3 (续)Table 3 (Continued)
2.6 实际样品检测
为了解我国市场上乳品中抗生素残留情况,采用本研究建立的检测方法对市售的50 种不同乳品进行了检测,并对数据结果进行系统分析。50 个样品中,其中一个样品检出氯霉素(如图1 所示),含量为0.48 μg/kg。1999 年9 月13 日中华人民共和国农业部发布了《动物性食品中兽药最高残留限量》[9]的通知,规定了氯霉素在所有食品动物的可食用组织中不得检出,但检测结果表明,中国市场上销售的乳品氯霉素污染的风险仍然存在。
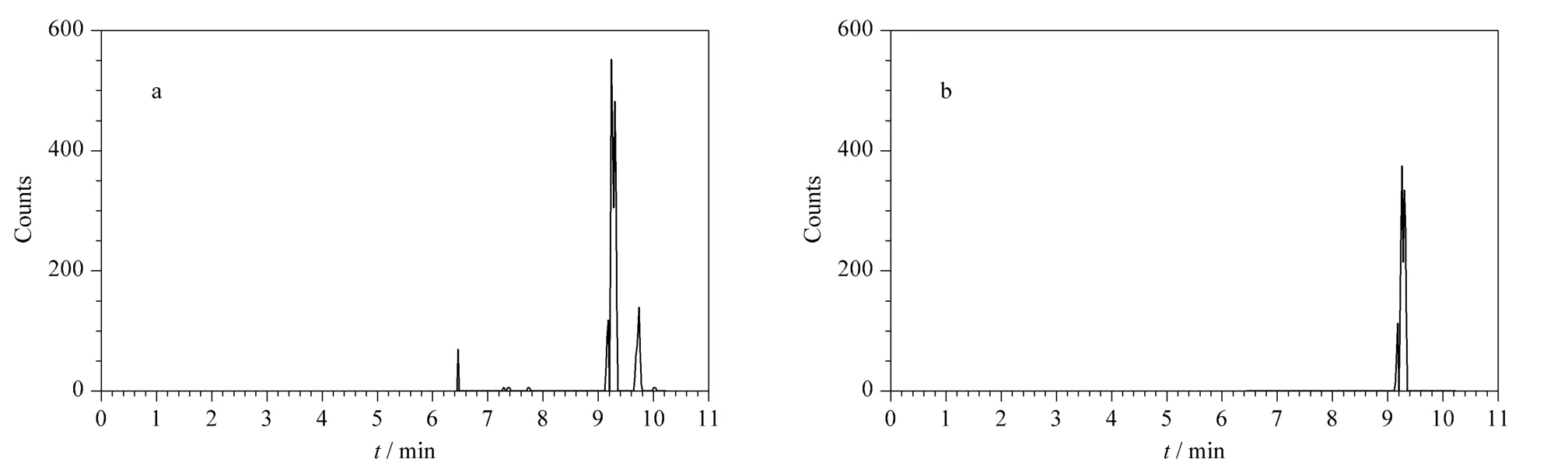
图1 某氯霉素(0.48 μg/kg)阳性样品的质量色谱图Fig.1 MRM chromatograms of a positive sample containing chloramphenicol (0.48 μg/kg)
3 结论
本研究建立的液相色谱-串联质谱方法实现了牛奶中35 种四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类等5 类抗生素残留的测定。该方法简单、快捷、经济,可实现多种抗生素残留的快速测定,为我国执法部门对乳品市场的监管和质量控制提供了有利的技术支持,该方法的推广将为乳品质量安全的监督检验工作节省大量的人力物力资源和时间。
[1] Takagi R,Fukuda J,Nagata K,et al. Analyst,2013,138(4):1000
[2] Huet A C,Charlier C,Tittlemier S A,et al. J Agric Food Chem,2006,54(8):2822
[3] Luzardo O P,Ruiz-Suarez N,Almeida-Gonzalez M,et al.Anal Bioanal Chem,2013,405(29):9523
[4] Wang H,Zhao L,Yang H,et al. Anal Methods,2014,6(5):1545
[5] Wang H,Zhou X J,Liu Y Q,et al. J Agric Food Chem,2011,59(8):3532
[6] Du J,Zhao H X,Chen J W. Chinese Journal of Chromatography (杜鹃,赵洪霞,陈景文. 色谱),2015,33(4):348
[7] Zhang X Y,Cai X X. Chinese Journal of Chromatography(张秀尧,蔡欣欣. 色谱),2014,32(7):693
[8] Li A M,Huang Z,Lu W P,et al. Chinese Journal of Chromatography (李爱梅,黄茁,卢文平,等. 色谱),2014,32(8):897
[9] Bulletin No. 235,Ministry of Agriculture of the People’s Republic China (中华人民共和国公告第235 号). (2002-12-24). http:// www. moa. gov. cn/zwllm/tzgg/gg/200302/t20030226_59300.htm

