超高效液相色谱-四极杆飞行时间质谱法测定大鼠血浆中的N6 -羟苄腺苷
唐春兰, 王 莉, 程孟春, 刘欣欣, 肖红斌*
(1. 中国科学院大连化学物理研究所,中国科学院分离分析化学重点实验室,辽宁 大连116023;2. 中国科学院大学,北京100049)
天麻是一种名贵的中药,主治头痛眩晕、肢体麻木、癫痫抽搐等症[1]。现代药理证实天麻有明显的神经保护作用[2,3],且神经保护作用对于脑卒中、癫痫等多种脑血管疾病有治疗意义[4]。目前,从天麻中已经分离得到60 多种化合物[5-7],但是对天麻神经保护物质基础的认识仍局限于已知活性成分天麻素及其苷元等单芳环化合物[8,9],而对天麻中的其他成分研究较少。N6-羟苄腺苷是一种从天麻药材中分离的痕量成分,被认为有明显的神经保护作用,是治疗神经退行性疾病及预防神经细胞凋亡的候选药物。而且其神经保护效果明显优于天麻中的主要活性成分天麻素[10]。另外,Zhang 等[11]报道了N6-羟苄腺苷具有镇静催眠作用,其主要是通过激活腺苷A(1)/A(2A)受体和睡眠中心——脑侧室前视核(VLPO)。因此测定给药后血浆、尿液等生物样本中的N6-羟苄腺苷含量,对于获取天麻相关制剂的药代动力学参数以及指导合理用药具有重要意义。Lei 等[12]报道了N6-羟苄腺苷在血中及尿中原型成分及代谢产物的定性研究。对于N6-羟苄腺苷的血药浓度检测及其药代动力学研究尚未见报道。
目前,生物样品检测的方法主要有高效液相色谱法(HPLC)[13,14]、气相色谱-质谱法(GCMS)[15,16]和液相色谱-串联质谱法(LC-MS/MS)[17,18]。实际应用中,多采用LC-MS/MS 方法。因为LC-MS/MS 可以对生物样中的待测物同时进行定性和定量分析,而且方法灵敏度高,准确度好,分析速度快。本研究建立了测定大鼠血浆中N6-羟苄腺苷的超高效液相色谱-四极杆飞行时间质谱(UPLC-MS/MS)分析方法,并应用于N6-羟苄腺苷的血药浓度检测及药代动力学研究。
1 实验部分
1.1 药品与试剂
N6-羟苄腺苷(见图1)对照品(纯度大于98%)和N6-二羟乙基腺苷由本实验室合成分离得到;6-苄氨基嘌呤和6-氯嘌呤核苷购自大连美仑生物科技有限公司;乙腈、甲醇、乙酸和甲酸皆为色谱纯,购自美国Sigma 公司;肝素钠购自美国Sigma 公司。实验用水为去离子纯化水。

图1 N6-羟苄腺苷的结构式Fig.1 Chemical structure of N6-(4-hydroxybenzyl)adenine riboside
1.2 仪器
Agilent 1290 高效液相色谱仪,配Agilent 6520四极杆飞行时间质谱仪(德国Agilent 公司);Sigma-16K 高速离心机(美国Sigma 公司);Mettler AE 240 天平(梅特勒托利多仪器有限公司);Milli-Q 纯水机(美国Millipore 公司)。
1.3 溶液的配制
N6-羟苄腺苷标准储备液:精密称取N6-羟苄腺苷对照品10 mg 于10 mL 容量瓶中,用50% (v/v)甲醇水溶液溶解、定容,得1 mg/mL 标准储备液。
内标溶液:精密量取6-苄氨基嘌呤适量,用甲醇溶解并稀释至200 ng/mL,备用。
1.4 实验动物及样品采集
SD 大鼠,体重(200±20)g,购自大连医科大学实验动物中心,合格证号为SCXX(辽)2008-0002。实验动物给药前禁食24 h,自由给水。大鼠灌胃200 mg/kg 的N6-羟苄腺苷混悬液前及后0.42、0.75、1、2、4、8、12、24 h 分别于眼底静脉取血并置于含有抗凝剂肝素钠的离心管中,于3 000 r/min 离心10 min,取上清液于-80 ℃低温冰箱保存。
1.5 样品处理
取100 μL 血浆样品,加入4 倍体积的含1%(v/v)乙酸的乙腈沉淀蛋白质,涡旋1 min,于12 000 r/min 离心10 min,取上清液至离心管中,50℃下氮气吹干,残渣用100 μL 50% (v/v)甲醇水溶液复溶,供UPLC-MS/MS 测定。
1.6 UPLC-MS/MS 条件
UPLC 条件:色谱柱为Agilent ZORBAX SBC18(150 mm×3 mm,1.8 μm);柱温为60 ℃;流动相为0.2% (v/v)甲酸水溶液(A)和乙腈(B);梯度洗脱程序为0 ~5 min,15% B ~40% B;流速为0.35 mL/min;进样量为20 μL。
MS/MS 条件:电喷雾离子(ESI)源,正离子模式;干燥气温度为350 ℃,干燥气流速为9 L/min;采集范围为m/z 50 ~750;采集频率为1.02 spectra/s;雾化气压力为0.31 MPa;毛细管电压为3 500 V;碎裂电压为150 V;二级碎裂能量为25 eV。
2 结果与讨论
2.1 色谱-质谱条件的优化
比较了水-乙腈、0.2% (v/v)甲酸水溶液-乙腈、水-甲醇、0.2% (v/v)甲酸水溶液-甲醇流动相体系。结果表明,0.2% (v/v)甲酸水溶液-乙腈体系下待测物的峰形好且灵敏度高。对10 ng/mL 的N6-羟苄腺苷标准溶液分别进行正、负离子扫描,结果表明待测物在正离子模式下的响应明显高于负离子模式。最后对干燥气温度、流速、毛细管电压、采集频率进行了优化,使待测物的响应最大。另外,对内标进行了考察,分别以N6-二羟乙基腺苷、6-氯嘌呤核苷和6-苄氨基嘌呤为内标进行考察,结果显示6-苄氨基嘌呤与待测物得到很好的分离,且回收率高。因此选择6-苄氨基嘌呤作为内标。
2.2 定量分析
图2 为空白大鼠血浆、血浆加标准品和大鼠灌胃N6-羟苄腺苷1 h 后的血浆样品的提取离子流图(提取质量窗口为10 ppm),图3 为N6-羟苄腺苷的质谱图。从图2 中可看出N6-羟苄腺苷和内标的保留时间为3.47 和4.62 min,峰形良好,血浆中的内源性物质不干扰N6-羟苄腺苷和内标的测定。N6-羟苄腺苷及内标的相关质谱数据见表1。

图2 (a)空白血浆、(b)空白血浆加标(添加25 ng/mL N6-羟苄腺苷和20 ng/mL 内标)及(c)给药1 h 后血浆样品(添加20 ng/mL 内标)的提取离子流图Fig.2 Extracted ion chromatograms of (a)a blank plasma sample,(b)a blank plasma sample spiked with N6-(4-hydroxybenzyl ) adenine riboside (25 ng/mL)and IS (20 ng/mL)and (c)a plasma sample after dosing 1 h (spiked with IS (20 ng/mL))
2.3 标准曲线与定量限
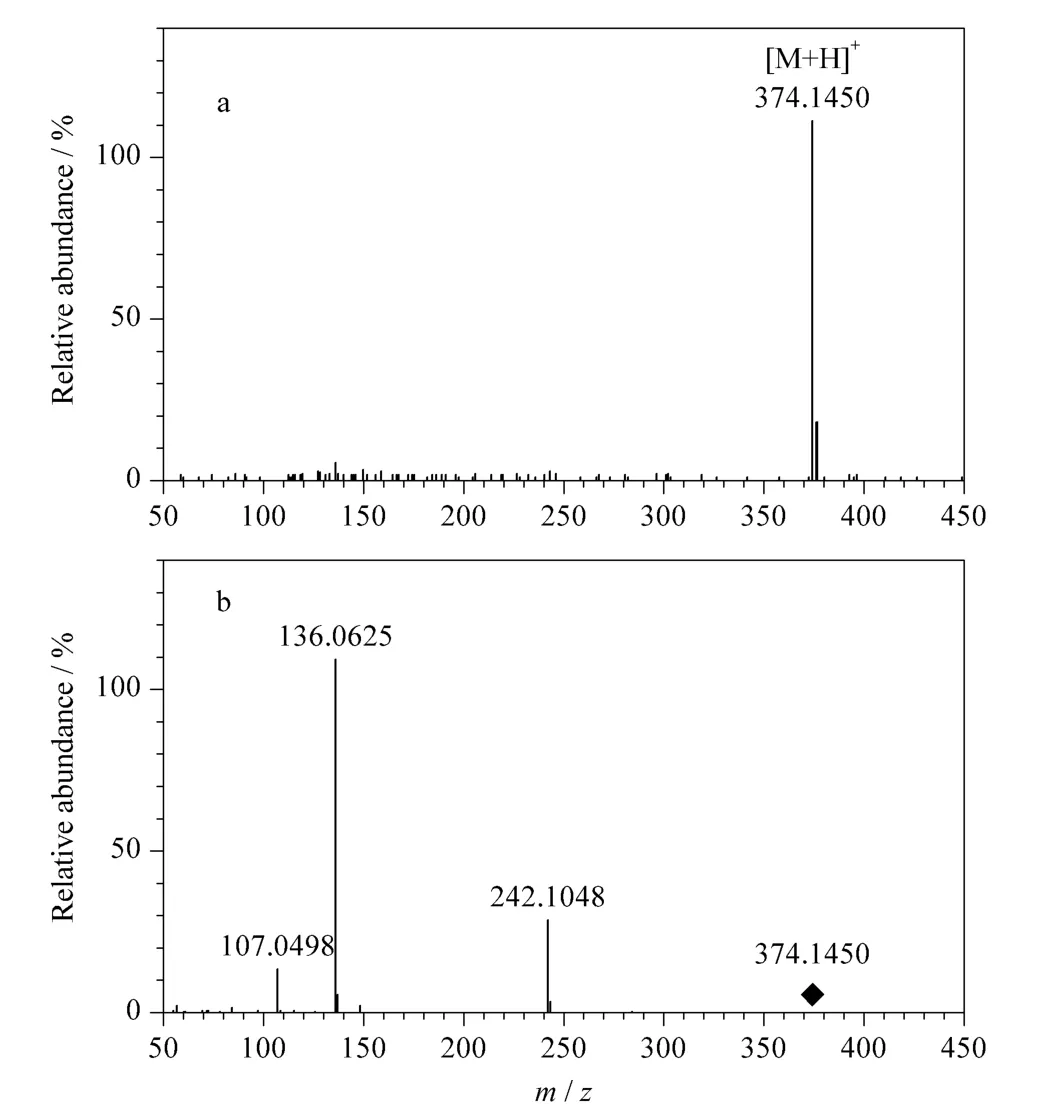
图3 N6-羟苄腺苷的(a)一级质谱图和(b)碎裂质谱图Fig.3 (a)MS and (b)MS/MS spectra of N6-(4-hydroxybenzyl)adenine riboside
用50% (v/v)甲醇水溶液将N6-羟苄腺苷储备液稀释成质量浓度分别为2.5、5、10、20、40、80、160、320 和640 ng/mL 的系列标准溶液。离心管中加入25 μL 标准溶液和10 μL 内标溶液,50 ℃下氮气吹干,加入100 μL 空白大鼠血浆,涡旋混匀30 s,其他操作同1.5 节所述,制备成0.625 ~160 ng/mL的加标样品,并进行UPLC-QTOF-MS 测定。质控样品的制备、处理及测定同上,质控样品的质量浓度分别为5、25、100 ng/mL(低、中、高3 个浓度)。以N6-羟苄腺苷和内标的峰面积比值的平均值(n =6)为Y,N6-羟苄腺苷的质量浓度为X,得到回归曲线Y =0.011 8X+0.017 45,相关系数r>0.99。检出限(S/N=3)为0.1 ng/mL。
2.4 准确度和精密度
用空白大鼠血浆配制低、中、高3 个质量浓度(同质控样品)的样品各5 份,连续测定5 天,考察日内与日间精密度(以RSD 计)和准确度(以RE 计,RE =(测定浓度-加标浓度)/加标浓度×100% )。结果表明,3 个质量浓度的日内与日间的RSD 均小于6%,RE 低于±15% (见表2),满足生物样品分析要求。

表1 N6-羟苄腺苷及内标的UPLC-MS/MS 参数Table 1 UPLC-MS/MS information of N6-(4-hydroxybenzyl)adenine riboside and IS

表2 空白大鼠血浆中N6-羟苄腺苷的日内、日间精密度和准确度Table 2 Intra-and inter-day precisions and accuracies of N6-(4-hydroxybenzyl)adenine riboside in a blank rat plasma sample
2.5 回收率和基质效应
回收率为空白血浆中加入药物经提取后的药物响应值与空白血浆处理后加入相同量药物后药物响应值的比值;基质效应为具有基质的标准品与纯标准品的药物响应值的比值。用空白大鼠血浆配制低、中、高3 个质量浓度(同质控样品,n =5)的大鼠血浆样品进行测定。N6-羟苄腺苷在低、中、高3 个质量浓度的回收率为88.41% ~108.26%,符合生物样品分析的要求;基质效应为95.54% ~109.48%,因此可忽略基质效应的影响。结果见表3。
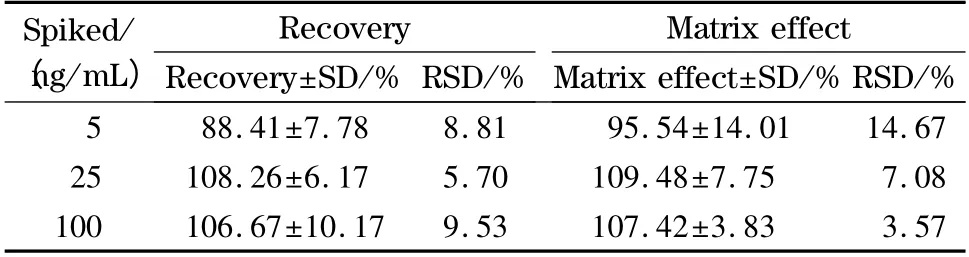
表3 空白大鼠血浆中N6-羟苄腺苷的加标回收率和基质效应(n=5)Table 3 Recoveries and matrix effect of N6-(4-hydroxybenzyl ) adenine riboside spiked in blank rat plasma (n=5)
2.6 稳定性考察
用空白大鼠血浆配制低、中、高3 个浓度(同质控样品,n =5)的大鼠血浆样品,分别考察不同条件下样品的稳定性:在-80 ℃冰箱中保存30 天(长期稳定性)、室温放置6 h(短期稳定性)、反复冻融3次(冻融稳定性)及处理后的样品在进样器中放置24 h(制备后稳定性)。结果(见表4)表明,样品中N6-羟苄腺苷在上述条件下稳定性良好。

表4 不同条件下大鼠血浆中N6-羟苄腺苷的稳定性Table 4 Stabilities of N6-(4-hydroxybenzyl)adenine riboside in rat plasma under different conditions
2.7 N6-羟苄腺苷的药代动力学研究
应用本文建立的UPLC-QTOF-MS 方法测定了大鼠灌胃N6-羟苄腺苷后血浆中N6-羟苄腺苷的含量。其平均血药浓度-时间曲线见图4,相应的药代动力学参数见表5。可以看出,大鼠灌胃N6-羟苄腺苷后1.15 h 达到峰值(107.53 ng/mL),且N6-羟苄腺苷的半衰期为7.75 h。

图4 大鼠灌胃200 mg/kg N6-羟苄腺苷后的平均血药浓度-时间曲线(n=6)Fig.4 Mean plasma concentration-time profile for N6-(4-hydroxybenzyl)adenine riboside after intragastric administration of 200 mg/kg N6-(4-hydroxybenzyl)adenine riboside in rats (n=6)
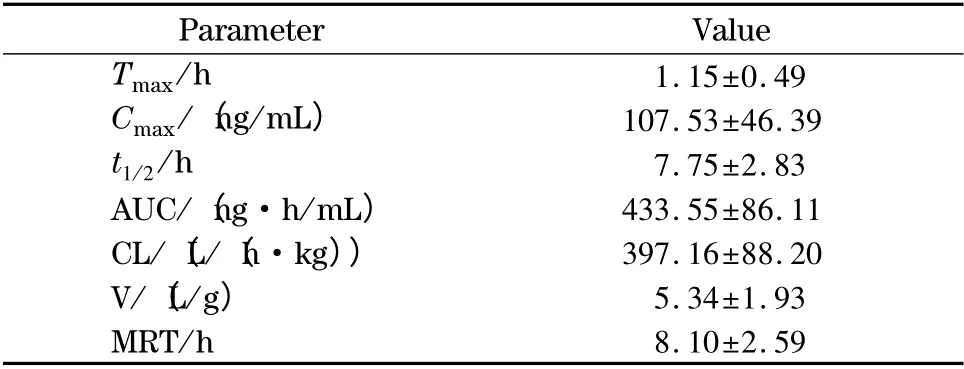
表5 大鼠血浆中N6-羟苄腺苷的药代动力学参数Table 5 Pharmacokinetic parameters of N6-(4-hydroxybenzyl)adenine riboside in rat plasma
3 结论
本实验建立了测定大鼠血浆样品中N6-羟苄腺苷的超高效液相色谱-四极杆飞行时间质谱分析方法。通过方法学验证和实际应用,证明该方法灵敏度高、重复性好、快速简便,适用于N6-羟苄腺苷血药浓度的测定及其药代动力学研究,为其临床药代动力学、药效学研究提供参考。
[1] Zheng H Z,Dong Z H,She J. Research and Application in Modernization of Chinese Medicine,Volume 1. Beijing:Academy Press (郑虎占,董泽宏,佘靖. 中草药现代研究与应用,第1 卷. 北京:学苑出版社),1997
[2] Sun X F,Wang W,Wang D Q,et al. China Journal of Chinese Materia Medica (孙晓芳,王巍,王丹巧,等. 中国中药杂志),2004,29(4):292
[3] Ramachandran U,Manavalan A,Sundaramurthi H,et al.Neurochem Int,2012,60(8):827
[4] Zhang T,Cao X L. Chinese Journal of Integrative Medicine on Cardio-/Cerebrovascular Disease (张涛,曹晓岚. 中西医结合心脑血管病杂志),2007,5(6):515
[5] Wang L,Xiao H B,Liang X M,et al. J Sep Sci,2007,30(10):1488
[6] Wang L,Xiao H B,Yang L,et al. J Asian Nat Prod Res,2012,14(5):457
[7] Wang L,Xiao H B,Liang X M. Chinese Traditional and Herbal Drugs (王莉,肖红斌,梁鑫淼. 中草药),2009,40(8):1186
[8] Wang Q Z. Chinese Journal of Trauma and Disability Medicine (王乾忠. 中国伤残医学),2013,21(11):223
[9] Hu Y K,Li C Y,Shen W. Neuropathology,2014,34(4):370
[10] Huang N K,Chern Y J,Fang J M,et al. J Nat Prod,2007,70(4):571
[11] Zhang Y,Li M,Kang R X,et al. Pharmacol Biochem Be,2012,102:450
[12] Lei Y J,Wang L,Cheng M C,et al. Biomed Chromatogr,2011,25(3):344
[13] Chen X Z,Chen W Q,Wang J,et al. Chinese Journal of Chromatography (陈小珍,陈万勤,王瑾,等. 色谱),2013,31(9):875
[14] Tang C L,Wang L,Cheng M C,et al. J Chromatogr B,2014,973:104
[15] Huang H Q,Huang X,Yu J S. Chinese Journal of Chromatography (黄会秋,黄逊,余惊笋. 色谱),2015,33(3):323
[16] Qiu Z L,Lin Y,Xiong Z L,et al. Chinese Journal of Chromatography (丘忠丽,林缨,熊志立,等. 色谱),2014,32(7):779
[17] Xiong S,Li J L,Zhu X Q,et al. Chinese Journal of Chromatography (熊山,李敬来,朱秀清,等. 色谱),2014,32(3):290
[18] Li Y J,Zhang C L,Zhang H,et al. Chinese Journal of Chromatography (李艳杰,张春兰,张晗,等. 色谱),2014,32(5):464

