液相色谱法分析烟叶酸性洗涤纤维素的碱性氧化铜降解产物
郝卫强 , 王磊君, 吴 顺, 岳邦毅, 陈 强, 张培培
(1. 上海烟草集团有限责任公司,烟草行业卷烟烟气重点实验室,上海200082;2. 常州南京大学高新技术研究院,江苏 常州213164)
木质素以及纤维素、半纤维素、果胶等是构成烟叶细胞壁物质的主要成分[1,2]。由于这些细胞壁物质与烟叶的吸味品质密不可分,因此准确掌握和了解烟叶中木质素的组成及其含量,可为烟叶的生产、加工以及质量评价等提供参考。木质素是由苯丙烷类化合物组成的一种天然高分子聚合物。通常认为它的形成起始于3 种木质醇:对-香豆醇、松柏醇和芥子醇(分子结构见图1)。这些木质醇可进一步脱氢聚合形成对羟基苯基结构单元、愈创木基丙烷结构单元以及紫丁香基丙烷结构单元[3,4]。木质素结构具有复杂和多样的特点。另外,木质素不溶于水、稀酸或稀碱,分子结构中含有抑制酶解或者化学水解的碳-碳键和联苯醚键,因此对其进行化学分析存在一定的难度[5]。

图1 对-香豆醇、松柏醇和芥子醇的分子结构式[4]Fig.1 Molecular structures of p-coumaryl alcohol,coniferyl alcohol and sinapyl alcohol[4]
目前重量法在木质素检测中的应用最为广泛,其代表方法是Klason 法和Van Soest 法[6-8]。Klason 法是将样品依次用72% 和3% 硫酸进行处理,剩余残渣即为Klason 木质素(Klason lignin,KL)。Van Soest 法是将样品依次用中性洗涤剂、酸性洗涤剂以及72% 硫酸进行处理,分别得到中性洗涤纤维素(neutral detergent fiber,NDF)、酸性洗涤纤维素(acid detergent fiber,ADF)以及酸性洗涤木质素(acid detergent lignin,ADL)。需要指出,部分木质素会溶解于浓酸之中,因此浓酸处理的方法往往仅适用于硬木木质素,而不适用于含量较低的软木木质素和草本木质素[5,9]。另外,一些不易降解的内源性物质,如角质、聚合鞣酸以及与木质素以共价键结合的蛋白质、纤维素、淀粉等,又会使重量法的测定结果偏高[9]。当样品中木质素的含量不高时,这种因内源性物质或者实验操作引入的误差往往就会更为显著。另有研究[6]报道,即使对于同一样品,用Klason 法和Van Soest 法测得的木质素含量也存在显著差异,其中KL 量要高于ADL 量。这一结果意味着需要建立一种更为可靠的方法以准确测定样品中木质素的含量。
与重量法相比,色谱法的优点是具有良好的分离选择性。目前气相色谱(GC)和液相色谱(LC)均已应用于木质素降解产物的研究中[10-12]。碱性氧化铜降解法是研究复杂样品,如土壤、湖泊沉积物、植物、腐殖质等中木质素组成的一种常用方法[13-17]。通过该方法,大分子的木质素被氧化降解成低相对分子质量的酚类化合物,然后再通过GC 或LC 对这些降解产物进行测定,可获得木质素结构组成的相关信息,如香草基(V)、丁香基(S)、肉桂基(C)等单体化合物之间的比例关系[11,16]。有研究[17]表明,应用GC 法和LC 法测得的结果之间具有良好的可比性。在GC 法中,得到的木质素降解产物需要通过硅烷衍生化反应以增强其挥发性。而LC 法则可避免该操作,从而有助于简化操作的步骤,并克服衍生化不完全等缺点。另外,由于木质素的结构中含有苯环,通过将LC 的紫外检测波长设在254 nm 甚至更高,还可有效避免纤维素、半纤维素等内源性物质的干扰,因此在木质素的检测中具有良好的应用前景。需要指出,不同植物之间的木质素组成往往存在很大差异[4],而目前基于LC 法对烟叶木质素展开研究的报道还很少。本文以烟叶ADF 为研究对象,对其碱性氧化铜降解产物的LC 分离条件进行了探讨。通过寻找特征的降解产物色谱峰,为研究不同烟叶样品木质素组成的差异,以及其与烟叶吸味品质的关系提供了一种新的分析手段。
1 实验部分
1.1 仪器及材料
日本岛津公司的Prominence 液相色谱系统,包括2 个LC-20AT 输液泵、1 个SIL-20A 自动进样器、1 个SPD-20A 紫外检测器、1 个CTO-20AC 柱温箱以及LabSolutions 色谱工作站等;烘箱(DZF-6020,上海慧泰仪器制造有限公司);聚四氟反应罐(KH-50,巩义市予华仪器有限责任公司);分析天平(BS124S,感量0.1 mg,赛多利斯科学仪器(北京)有限公司);离心机(XYJ-A,金坛市杰瑞尔电器有限公司);pH 计(PHS-3E,上海精密科学仪器有限公司);超声仪(KX-1990QT,北京科玺世纪科技有限公司)。
石油醚(沸程60 ~90 ℃)、乙二醇乙醚、葡萄糖、甲醇(分析纯,江苏强盛功能化学股份有限公司);98% 浓硫酸(分析纯,江苏永丰化学试剂厂);乙醇(分析纯,国药集团化学试剂有限公司);氢氧化钠(分析纯,上海试四赫维化工有限公司);乙二胺四乙酸二钠(分析纯,上海申博化工有限公司);十水合四硼酸钠、磷酸氢二钠(分析纯,宜兴第二化学试剂厂);十二烷基硫酸钠、十六烷基三甲基溴化铵(分析纯,上海强顺化学试剂有限公司);氧化铜粉(分析纯,上海龙昕科技发展有限公司);二氯甲烷、六水合硫酸亚铁铵(分析纯,上海凌峰化学试剂有限公司);甲醇(色谱纯,Adamas 公司);芥子酸(纯度98%)、咖啡酸(纯度≥98%)、对羟基肉桂酸(纯度≥98%)(上海泰坦科技股份有限公司);阿魏酸(纯度≥98%,上海诗丹得生物技术有限公司);试验用水为超纯水。
样品:6 种烟叶样品(编号为03#、04#、06#、10#、12#、22#)由上海烟草集团有限责任公司提供。样品在使用前均经风干、磨碎、过40 目筛。
1.2 试剂的配制
1.2.1 中性洗涤剂的配制[7,18]
将18.6 g 乙二胺四乙酸二钠和6.8 g 十水合四硼酸钠置于烧杯中,加水约100 mL,加热使之溶解;将30 g 十二烷基硫酸钠和10 mL 乙二醇乙醚溶于约650 mL 热水中;合并上述两种溶液;再将4.56 g磷酸氢二钠溶于150 mL 热水中,并入上述溶液中,用磷酸调节上述混合液至pH 6.9 ~7.1,转移至1 000 mL 容量瓶中,加水定容至刻度。
1.2.2 酸性洗涤剂的配制[7]
用50 mL 量筒量取约27.2 mL 98% 浓硫酸,缓慢加入已装有500 mL 蒸馏水的烧杯中,冷却后转移至1 000 mL 容量瓶中,加水定容至刻度,配制成0.5 mol/L 硫酸溶液。另称取约20 g 十六烷基三甲基溴化铵于1 000 mL 烧杯中,加入配制好的0.5 mol/L 硫酸溶液,搅拌溶解,转移至1 000 mL 容量瓶中,加水定容至刻度。
1.3 实验方法
1.3.1 酸性洗涤纤维素的制备
酸性洗涤纤维素的制备参考文献[7]。取烟叶粉末5 g 置于250 mL 圆底烧瓶中,加入60 mL 石油醚和40 mL 乙醇,维持微沸状态4 h,冷却至室温后过滤,用乙醇冲洗至滤出液无色。再将滤渣转移至250 mL 圆底烧瓶中,加入100 mL 中性洗涤剂,维持微沸状态1 h,冷却至室温后以1 000 g 离心10 min,弃去上清液,残渣用90 ~100 ℃水反复清洗至上清液无泡沫。然后将残渣转移至250 mL 圆底烧瓶中,加入100 mL 酸性洗涤剂,维持微沸状态1 h,过滤,冷却至室温后以1 000 g 离心10 min,弃去上清液,残渣用90 ~100 ℃水反复清洗至上清液无泡沫且pH 中性,干燥,得到ADF。
1.3.2 酸性洗涤木质素的制备
将1.3.1 节中制备得到的ADF 加入25 mL 72% 硫酸中,搅拌3 h 后过滤,依次用水和乙醇充分洗涤滤渣,干燥,得到ADL[7]。
1.3.3 碱性氧化铜降解[11,16]
取0.1 g ADF 或ADL、0.5 g 经二氯甲烷萃取过的氧化铜粉末、0.1 g 六水合硫酸亚铁铵和0.05 g葡萄糖于聚四氟反应罐内,加入15 mL 2 mol/L 氢氧化钠溶液,旋紧上盖后置于烘箱中,于200 ℃加热5 h,冷却至室温后加入5 mL 甲醇,混匀,转移至50 mL 离心管中,再用4 mL 20% (v/v)甲醇洗涤聚四氟反应罐,并入离心管中,超声15 min,于1 000 g离心15 min,移取上清液。用4 mL 20% (v/v)甲醇清洗沉淀2 次,离心,合并上清液,用6 mol/L H3PO4酸化至pH 1.8 ~2.2,静置1 h,于1 000 g 离心10 min,移取上清液至50 mL 容量瓶中。用5 mL 20% (v/v)甲醇洗涤沉淀,洗涤液并入容量瓶中。再用20% (v/v)甲醇定容至刻度,混匀,过0.45 μm 滤膜,滤液供LC 测定。
1.3.4 LC 条件
色谱柱:Ultimate XB C18 色谱柱(150 mm×4.6 mm,5 μm,月旭材料科技(上海)有限公司);流动相:甲醇(A)和水(B),梯度洗脱程序:0 ~5 min,10% A;5 ~25 min,10% A ~35% A;25 ~35 min,35% A ~90% A;35 ~45 min,90% A;45 ~57 min,10% A。柱温:35 ℃;流速:0.8 mL/min;检测波长:280 nm 和320 nm;进样量:20 μL。
2 结果与讨论
2.1 烟叶木质素样品的制备
本文采用Van Soest 法制备烟叶的木质素样品。在用中性洗涤剂处理样品之前,首先用石油醚/乙醇(60 ∶40,v/v)溶液提取以除去样品中的色素及其他脂溶性成分。在Van Soest 法中,中性洗涤剂用于除去糖、淀粉、蛋白质、果胶等可溶性物质,酸性洗涤剂用于除去半纤维素等物质,而72% 硫酸则用于除去样品中的纤维素等物质[7,18]。应用该方法制得的22#烟叶样品ADF 和ADL 的平均得率分别为10.0%(RSD=6.14%,n =7)和1.59% (RSD =14.1%,n =7),该结果与文献[7,8]报道基本一致。另外,由于烟叶ADL 的得率偏低,实验操作误差对测定结果的影响较之ADF 更为显著(即RSD 偏高)。
由图2 所示的LC 结果可以看到,由ADF 和ADL 得到的碱性氧化铜降解产物的色谱图较为类似,均包含所标注的A、B、C、D 4 个峰。由于ADF主要由纤维素和木质素构成,而ADL 主要由木质素构成,因此A、B、C、D 4 个峰可看作是烟叶木质素的特征降解产物峰。另外,图2 中ADF 和ADL 的取样量均为100 mg,而两者谱图中A、B 两个色谱峰的峰高并没有发生明显的变化。结合ADL 的得率约为ADF 的1/6 这个结果可以发现,部分木质素在72% 硫酸处理的过程中发生了溶解,类似的结果在文献[9]中也有报道。因此,对于烟叶等草本样品,由于木质素的含量本身就低,在样品处理过程中应尽可能地避免浓酸消化的步骤,从而降低其对木质素检测的影响。在本文后面的研究中,我们选择ADF 作为烟叶木质素研究的对象。
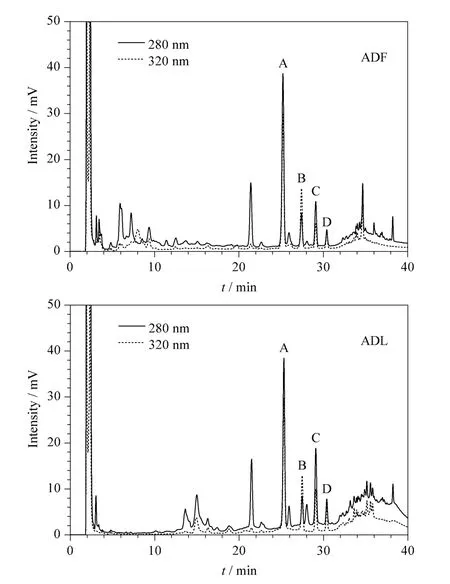
图2 不同检测波长下22#烟叶的ADF 和ADL 碱性氧化铜降解产物的LC 谱图Fig.2 Chromatograms of alkaline CuO degradation products of acid detergent fiber (ADF)and acid detergent lignin (ADL)from 22# tobacco leaves
2.2 液相色谱条件的建立
本文应用反相液相色谱对烟叶ADF 的碱性氧化铜降解产物进行了分离。由于纤维素等多糖类物质的分子结构中不含有苯环,因此可将紫外检测波长设在254 nm 甚至更高,从而避免这些内源性物质对木质素测定的影响。实验考察了降解产物在检测波长分别为254、280 以及320 nm 时的出峰情况,典型谱图见图3。
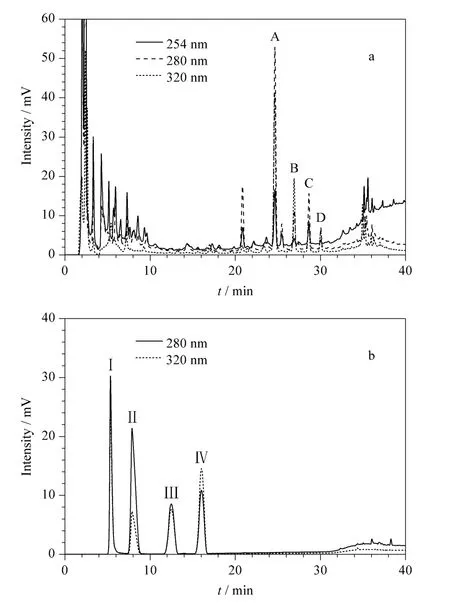
图3 (a)10#烟叶的ADF 碱性氧化铜降解产物以及(b)咖啡酸、对羟基肉桂酸、阿魏酸、芥子酸混合标准溶液在不同波长下的色谱图Fig.3 Chromatograms of (a)alkaline CuO degradation products of ADF from 10# tobacco leaves and (b)the mixed standard solution of caffeic acid,pcoumaric acid, ferulic acid and sinapic acid under different detection wavelengths
从图3a 可以看到,标号为A、B、C、D 的4 个峰在280 nm 和320 nm 时的响应值均高于254 nm 时的响应值。在图3b 中,对羟基肉桂酸、阿魏酸、芥子酸分别对应于图1 中对-香豆醇、松柏醇、芥子醇的羟甲基氧化产物,是研究木质素结构组成的重要特征化合物[11,19]。另外,A、B、C、D 4 个峰与咖啡酸、对羟基肉桂酸、阿魏酸、芥子酸的紫外响应非常类似(在280 nm 和320 nm 均有明显吸收),这说明这些色谱峰与烟叶木质素之间存在密切的联系。同时,这4 个色谱峰的保留时间均远大于芥子酸等单体化合物的保留时间,色谱峰形也更为对称,说明这些色谱峰所对应的化合物的分子结构中含有更多的疏水单元,因此可能具有更大的分子结构。在以往关于木质素的研究中,van der Hage 等[20]建立了一种可用于木质素分析的在线高温裂解(curie-point pyrolysis)LC-MS 方法。该工作的研究结果表明,裂解得到的木质素降解产物中含有多种木质素单体的低聚物。类似的低聚物可能也存在于木质素的碱性氧化铜降解产物中,尽管这一结果还尚未见文献报道。另外,图3b 中在35 ~38 min 区间内出现了一组在280 nm 和320 nm 均有明显吸收的色谱峰。这些色谱峰可能也对应于疏水性更强、相对分子质量更大的木质素降解产物。对于这些色谱峰所对应的化合物结构可通过MS、NMR 等技术进行解析,本文作者也正在开展相关的研究工作。
在本文建立的LC 体系中,以320 nm 为检测波长还可避免蛋白质、鞣质等内源性物质对木质素测定的干扰,而前者的最大吸收波长在280 nm 附近。在320 nm 波长下,A、B、C、D 4 个峰均与其他色谱峰有着良好的分离度。这些色谱峰在所测试的所有烟叶样品中均有出现(编号03#、04#、06#和12#的烟叶样品色谱图见图4),因此A、B、C、D 4 个峰可作为烟叶木质素降解产物研究的特征色谱峰。通过比较烟叶样品中这些色谱峰的差异,将有助于了解不同烟叶样品之间的差异,进而为研究这些差异与烟叶吸味品质的关系提供参考。

图4 (a)03#、(b)04#、(c)06#和(d)12#烟叶样品的ADF 碱性氧化铜降解产物的色谱图Fig.4 Chromatograms of alkaline CuO degradation products of ADF obtained from(a)03#,(b)04#,(c)06# and (d)12# tobacco leaf samples
2.3 碱性氧化铜氧化降解时间及溶液稳定性的考察
实验中运用LC 方法,对烟叶ADF 碱性氧化铜氧化降解的最佳时间进行了考察。以22#烟叶ADF样品为研究对象,2.2 节中确定的4 个特征色谱峰的峰面积随降解时间的变化情况见图5。从图5 中可以看到,随着降解时间的延长,4 个特征峰的峰面积也随之增加,并在4 ~5 h 趋于平衡。实验还发现,当降解时间少于4 h 时,反应罐中会存在较多的固体残渣,这一现象与LC 结果一致。本文最终选择5 h 作为烟叶ADF 碱性氧化铜氧化降解的最佳时间。
实验还对氧化降解得到的样品溶液的稳定性进行了考察。表1 比较了由06#和12#烟叶ADF 制得的样品溶液在第1 天和第7 天的峰面积。从表1 数据可见样品溶液在7 天内保持稳定。

图5 22#烟叶ADF 碱性氧化铜降解产物特征色谱峰的峰面积随降解时间的变化(n=3)Fig.5 Variation of the peak areas of characteristic peaks of alkaline CuO degradation products of ADF from 22# tobacco leaves with degradation time (n=3)
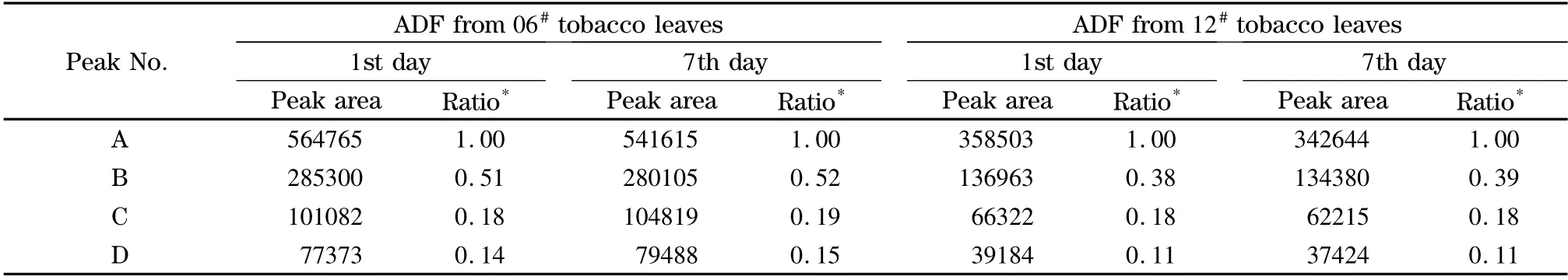
表1 不同时间测得的06#和12#烟叶ADF 降解产物特征色谱峰的峰面积Table 1 Peak areas of characteristic peaks of the degradation products of ADF from 06# and 12#tobacco leaves at different times
3 结论
应用Van Soest 法制备得到烟叶酸性洗涤纤维素,并作为烟叶木质素研究所关注的对象。建立了酸性洗涤纤维素碱性氧化铜氧化降解产物的LC 分析方法。在LC 分析中分离得到4 个可看作是烟叶木质素的特征降解产物峰。以这4 个特征色谱峰为考察对象,可研究不同烟叶木质素组成的差异及其与烟叶吸味品质的关系。
[1] Liu C K,Cai J,Yang J,et al. Guangdong Agricultural Sciences (刘春奎,蔡佳,杨靖,等. 广东农业科学),2012(12):33
[2] Zhang Q,Dong G F,Huang W,et al. Tobacco Science &Technology (张强,董高峰,黄韡,等. 烟草科技),2014(3):76
[3] Cao S Y,Hu W R,Fan L. Polymer Bulletin (曹双瑜,胡文冉,范玲. 高分子通报),2012(3):8
[4] Vanholme R,Morreel K,Ralph J,et al. Curr Opin Plant Biol,2008,11(3):278
[5] Li H T,Yao K,Jia D Y,et al. Leather Science and Engineering (李海涛,姚开,贾冬英,等. 皮革科学与工程),2011,21(2):31
[6] Goff B M,Murphy P T,Moore K J. J Sci Food Agric,2012,92(4):751
[7] Yang B,Yin Y,Zhang H B,et al. Acta Tabacaria Sinica (杨斌,殷引,张浩博,等. 中国烟草学报),2012,18(3):10
[8] Guo X Y,Dai Y H,Guo Z M,et al. Tobacco Science &Technology (郭小义,戴云辉,郭紫明,等. 烟草科技),2009(1):43
[9] Fukushima R S,Hatfield R D. J Agric Food Chem,2004,52(12):3713
[10] Cui P,Fang H X,Wu Q L,et al. Chinese Journal of Chromatography (崔朋,方红霞,吴强林,等. 色谱),2015,33(3):314
[11] Goni M A,Montgomery S. Anal Chem,2000,72(14):3116
[12] Yu Y C,Li K L,Ma Y C,et al. Chinese Journal of Chromatography (于雅晨,李坤兰,马英冲,等. 色谱),2013,31(2):143
[13] Hedges J I,Ertel J R. Anal Chem,1982,54(2):174
[14] Bahri H,Dignac M F,Rumpel C,et al. Soil Biol Biochem,2006,38(7):1977
[15] Hautala K,Peuravuori J,Pihlaja K. Chemosphere,1997,35(4):809
[16] Liu N,Zhang W,He H B,et al. Analytical Instrumentation(刘宁,张威,何红波,等. 分析仪器),2010(6):30
[17] Steinberg S,Venkatesan M I,Kaplan I R. J Chromatogr,1984,298:427
[18] GB 54136-2010
[19] Sun R,Lawther J M,Banks W B. Ind Crop Prod,1995,4(4):241
[20] van der Hage E R E,Boon J J. J Chromatogr A,1996,736:61

