大足黑山羊宰后成熟过程中肌原纤维蛋白功能性质的变化
王晓君,王晓香,林 静,李 林,尚永彪,2,*
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
大足黑山羊宰后成熟过程中肌原纤维蛋白功能性质的变化
王晓君1,王晓香1,林 静1,李 林1,尚永彪1,2,*
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
以大足黑山羊后腿肉为原料,研究羊肉宰后成熟过程中肌原纤维蛋白(myofibrillar protein,MP)功能性质的变化。结果表明:随着宰后成熟时间的延长,羊肉MP的溶解度、乳化活性指数和乳化稳定性均呈先下降后上升的趋势,且在宰后24 h达到最小值;表面疏水性、凝胶硬度和弹性及凝胶蒸煮损失均呈先增加后下降的变化趋势,且在宰后24 h达到最大值。综合各项指标的变化规律,从羊肉加工性能的角度考虑,大足黑山羊羊肉的最佳成熟时间为72 h。
大足黑山羊肉;宰后成熟;肌原纤维蛋白;功能性质
羊肉是世界各国人民主要的动物蛋白质来源之一,也是我国传统的食药两用型、营养丰富的肉制品。据《神农本草经》记载:羊肉堪比人参、黄芪,人参、黄芪补气,而羊肉则补形[1]。与普通猪肉、牛肉相比,黑山羊皮下和肌内脂肪都较少,具有高瘦肉、低脂肪、低胆固醇、肉质细嫩、易消化等特点,其味甘性温,益气补虚,强壮筋骨,具有独特的保健功能,近年来随着人们生活水平的提高和健康理念的增强,黑山羊肉深受消费者喜爱,发展潜力巨大[2-7]。
肉的成熟是指动物屠宰后由肌肉到肉的转变过程[8],经宰后成熟嫩化的肉,其肉质柔软具有弹性、色泽良好、风味较佳,大大提高了肉制品的食用品质。目前,关于宰后成熟的研究主要集中在牛肉、猪肉和鸡肉等肉制品,而关于羊肉的研究主要集中在羊肉制品的研制、羊肉营养价值、羊肉肉用品质及肌球蛋白热诱导凝胶等方面,对不同品种、不同性别、不同畜龄、不同饲养方式等羊肉宰后成熟工艺还缺乏全面、系统的研究。大足黑山羊原产于重庆市大足县,是国家畜禽遗传资源委员会审定的国家级畜禽遗传资源品种,目前正在西南等地区大面积推广,有关大足黑山羊加工的研究鲜见报道,本实验以大足黑山羊后腿肉为原料,考察羊肉宰后成熟过程中肌原纤维蛋白功能性质的变化规律,旨在为羊肉成熟时间的确定提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜大足黑山羊后腿肉,18 月龄,购于重庆北碚。
二硫苏糖醇(DL-dithiothreitol,DTT) 上海研卉生物技术有限公司;叠氮化钠 重庆北碚化学试剂厂;溴酚蓝(bromine phenol blue,BPB) 北京鼎国生物技术有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 苏州通都晟精细化工有限公司。以上试剂均为分析纯。
1.2 仪器与设备
pHS-4C+酸度计 成都世纪方舟科技有限公司;4K-15SIGMA冷冻离心机 德国Sigma公司;5810型台式高速离心机 德国Eppendorf公司;HH-6数显恒温水浴锅 国华电器有限公司;XHF-D内切式匀浆机 宁波新芝生物科技股份有限公司;CT-3质构仪 美国Brookfield公司;HR-1流变仪 美国TA公司;FA2004 B电子天平 上海精天电子仪器有限公司;DF8517超低温冰箱 韩国Ilshin公司;BCD-217VCZ冰箱 河南新飞电器有限公司。
1.3 方法
1.3.1 原料处理
将现宰的黑山羊后腿肉用保鲜膜包裹,放入事先准备好的保温冰盒中,10 min内运回实验室,立即将其放在-18 ℃冰箱中快速冷却至中心温度低于4 ℃后,用已消过毒的砧板和手术刀将后腿肉分割成30 g左右的小块,装入自封袋,包装后立即将肉样放置在0~4 ℃环境下进行成熟。自封袋规格:120 mm×80 mm,自封袋材料:聚乙烯。
1.3.2 肌原纤维蛋白(myofibrillar protein,MP)的提取
取一定量剔除脂肪和结缔组织的肉样,用绞肉机绞成肉粒(小于2 mm×2 mm×2 mm),参照Xiong Youling L.等[9]的方法进行提取。整个肌原纤维蛋白提取过程都在0~4 ℃条件下进行,并将提取的MP在4 ℃条件下冷藏贮存,相应指标的测定应在48 h之内完成,否则MP会变质,影响测定结果。
1.3.3 肌原纤维蛋白溶解度的测定
溶解度的测定在Agyare等[10]的方法上进行适当修改。取一定量的肌原纤维蛋白沉淀,加入一定体积磷酸盐缓冲液(phosphate buffer solution,PBS,0.6 mol/L NaCl,50 mmol/L Na2HPO4,pH 6.25),0~4 ℃条件下,2 000 r/min分散均匀,分散过程中尽量避免气泡产生,将其制成蛋白质质量浓度为2.5 mg/mL的溶液,然后将其置于4 ℃冰箱放置1 h后,在冷冻离心机(4 ℃)中以5 000 r/min离心15 min,取上清液,用双缩脲法测定上清液中蛋白质的质量浓度,空白为未加MP的PBS。MP溶解度的计算公式如下。

1.3.4 肌原纤维蛋白乳化性的测定
参照Agyare等[11]的方法并进行调整。将一定量的肌原纤维蛋白溶解在0.1 mol/L PBS(pH 6.5)中,0~4 ℃条件,2 000 r/min分散均匀,分散过程中尽量避免气泡的产生,制成蛋白质质量浓度为1 mg/mL的溶液。吸取20.0 mL蛋白质溶液和5.0 mL大豆油于直径2.5 cm的塑料离心管中,高速匀浆(10 000 r/min,1 min),匀浆后移取乳浊液50 μL(剩余乳浊液备用)加入到5 mL、质量分数0.1% SDS溶液中,振荡混匀,静置10 min,以0.1% SDS溶液作为空白,用紫外分光光度计测定其在500 nm波长处的吸光度(A0)。待备用的乳浊液静置10 min后,再次在相同位置取50 μL乳浊液,同上述操作,测定其吸光度(A10)。MP乳浊液的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)分别由下式计算。

式中:ρ为乳化之前的蛋白质质量浓度/(g/mL);φ为油相体积分数(油的体积/乳浊液的体积)/%。
1.3.5 肌原纤维蛋白表面疏水性的测定
参照Chelh等[12]的方法进行。将一定量的肌原纤维蛋白溶解在PBS(0.02 mol/L、pH 7.0)中,0~4 ℃条件,2 000 r/min分散均匀,分散过程中尽量避免气泡的产生,制成蛋白质质量浓度为5 mg/mL的溶液。移取1 mL样液和200 μL 1 mg/mL溴酚蓝(bromine phenol blue,BPB)于离心管中,对照为1 mL 0.02 mol/L PBS和200 μL 1 mg/mL BPB,在室温下振摇10 min,高速离心(8 000 r/min,10 min),取上清液稀释10倍后在595 nm波长处测定吸光度(A),空白为PBS缓冲液,表面疏水性用与溴酚蓝结合量表示,计算公式如下。

参考Chin等[13]的方法并作适当修改,取适量肌原纤维蛋白加入PBS(0.02 mol/L、pH 7.0),0~4 ℃条件,2 000 r/min分散均匀,分散过程中尽量避免气泡的产生,制成蛋白质质量浓度为15 mg/mL的溶液。取适量样品置于样品台上,设定平板和样品台之间的间隙是0.5 mm,暴露在外面的样品擦干并用凡士林密封,以免样品在加热过程中蒸发。采用40 mm的夹具,频率1 Hz,应变0.002 5,样品加热温度范围为20~85 ℃,加热速率为1 ℃/min,并在85 ℃保持3 min,然后以5 ℃/min的速率从85 ℃冷却到5 ℃,狭缝:0.5 mm,对样品进行温度扫描。随着温度的升高,在凝胶形成的这个过程中得出弹性模量的变化趋势图。
1.3.7 肌原纤维蛋白质热诱导凝胶的制备
热诱导凝胶的制备参照Doerscher等[14]的方法并稍作调整。取适量的肌原纤维蛋白加入PBS(0.02 mol/L、pH 7.0),0~4 ℃条件,2 000 r/min分散均匀,分散过程中尽量避免气泡的产生,制成蛋白质质量浓度为40 mg/mL的溶液。取6 mL样液置于10 mL的塑料离心管中,置于水浴锅中,以1 ℃/min的升温速率从20 ℃升至70 ℃(通过开、关水浴锅来控制),并保持20 min,将蛋白取出,在4 ℃冰箱放置12 h。
1.3.7.1 肌原纤维蛋白质热诱导凝胶强度的测定
利用质构仪质地剖面分析(texture profile analysis,TPA)测定肌原纤维蛋白热诱导凝胶强度,TPA测定条件:测试前速率:2.0 mm/s;测试速率:1.0 mm/s;返回速率:2.0 mm/s;压缩比:50%;触发类型:Auto;触发点负载:5.0 g;探头:TA5;夹具:TA-BT-KI;数据频率:100 point/s;等待时间:5.0 s。
1.3.7.2 肌原纤维蛋白质热诱导凝胶蒸煮损失的测定
凝胶强度测定完后,倾倒出玻璃管中的明水,称取凝胶的质量,并与蒸煮前的净质量相比较,按下式计算蒸煮损失。

1.4 数据处理
1)滚筒体。为了实现填料同穴盘窝穴对应,需要结合穴盘的尺寸参数对滚筒体进行设计。目前市场上72孔穴盘在蔬菜生产中应用最普遍,本文采用6列12行72孔穴盘作为育苗容器。穴盘的尺寸为长540mm,宽280mm,高45mm。
每次实验3 个平行样,重复测定3 次,结果取平均值。用Microsoft Office 2007的Excel软件计算出平均数和标准偏差,用Origin pro 8.6软件作图,再用SPSS Statistics 17.0统计软件对数据进行差异显著性分析和相关性分析,显著性差异值为P<0.05,实验所得数据结果表示为±s。
2 结果与分析
2.1 宰后成熟过程中黑山羊肉肌原纤维蛋白溶解度的变化

图1 宰后成熟过程中黑山羊肉肌原纤维蛋白平均溶解度的变化Fig.1 Change in myofibrillar protein solubility in goat rear legs during postmortem aging
由图1可知,随着宰后成熟时间的增加,MP平均溶解度的变化趋势为先下降后上升,并在24 h时达到最低值(65.40±3.41)%,之后随着成熟时间的增加,平均溶解度开始回升,在24~48 h和72~96 h溶解度变化差异显著(P<0.05)。该结果与宋玉[15]对鸡肉成熟过程中MP溶解度变化的研究结果相一致。
羊肉MP的溶解度在宰后24 h时达到最小值,是由于在宰后成熟初期肌原纤维蛋白发生变性凝聚,蛋白质天然构象发生改变,暴露出原分子内的疏水基团,疏水相互作用使蛋白质分子间发生聚集,造成MP溶解度降低,加工性能变差[16-17]。之后随着成熟时间的增加,羊肉MP的溶解度又回升,其原因可能是蛋白质被一定程度地温和氧化而交联形成的聚合物为可溶性的低聚体导致的[18]。从溶解度的变化趋势看,羊肉的宰后成熟时间以72 h为宜。
2.2 宰后成熟过程中黑山羊肉肌原纤维蛋白乳化性的变化

图2 宰后成熟过程中羊肉肌原纤维蛋白乳化活性(a)和乳化稳定性(b)的变化Fig.2 Changes in myofibrillar protein emulsifying activity (a) and emulsifying stability (b) in goat rear legs during postmortem aging
由图2可知,随着宰后成熟时间的延长,羊肉MP的EAI和ESI均呈先下降后上升的趋势,在宰后0~24 h期间均显著降低(P<0.05),并分别达到最小值(20.43±0.74)%和(21.30±3.26)%,随着成熟时间的延长,两者都呈上升变化,EAI在成熟时间72 h以后变化显著(P<0.05),ESI变化在成熟时间48 h以后差异不显著(P>0.05)。
研究表明,蛋白质的乳化性与其溶解度成正相关关系[19]。0~24 h,随着成熟时间的延长,蛋白质氧化变性,肌球蛋白交联程度变大,导致蛋白质失去了表面吸附脂肪颗粒的能力,乳化性下降[20],成熟后期,溶解度增加,蛋白质快速扩散并在表面吸附,故乳化性增加;另外,在解僵成熟过程中,蛋白质经酶的作用降解生成新的小分子蛋白质片段,这些片段富集在表面减少了表面张力,从而使得乳化稳定性增加。通过对MP乳化性变化分析,羊肉MP的乳化活性和乳化稳定性在72 h后变化平稳,差异不显著,最佳成熟时间确定为72 h为宜。
2.3 宰后成熟过程中黑山羊肉肌原纤维蛋白表面疏水性的变化
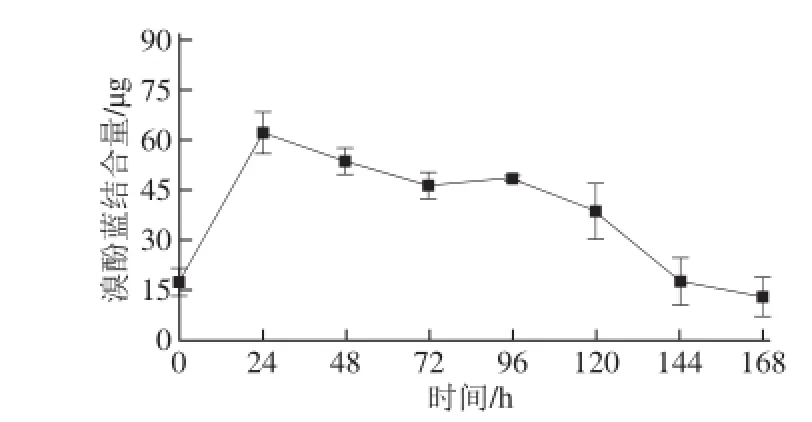
图3 宰后成熟过程中羊肉肌原纤维蛋白表面疏水性的变化Fig.3 Change in myofibrillar protein hydrophobicity in goat rear legs during postmortem aging
由图3可知,随着宰后成熟时间的延长,羊肉MP表面疏水性先上升后下降。羊肉MP的表面疏水性在宰后0~24 h显著增加(P<0.05),并达到溴酚蓝结合量最大值,为(62.50±6.96)μg,之后随着成熟时间的延长,羊肉MP的疏水性逐渐下降,在48~72 h内变化差异显著(P<0.05),在72~96 h变化差异不显著(P>0.05)。
表面疏水性是由蛋白质分子表面疏水性氨基酸的相对含量决定的。MP螯合溴酚蓝的量越大,表明其表面疏水性越好。羊肉MP的表面疏水性在宰后0~24 h迅速升高,是由于宰后24 h蛋白质的溶解性较差,有研究发现蛋白质的溶解性与表面疏水性成负相关关系,故其疏水性较好;另外,宰后肌肉僵直收缩引起蛋白质分子结构发生改变,蛋白质内部的疏水基团露出,使得蛋白质的疏水性增大。MP的疏水性达到最大值后又下降是肌肉解僵成熟时MP的溶解性增加和肌肉伸展疏水性基团减少的结果。在72~168 h期间表面疏水性缓慢上升后又下降,是由于随着成熟的进行,MP被降解,蛋白质内部的疏水基团暴露,导致表面疏水性增加;MP进一步降解,更多的疏水性基团的暴露,体系中的肽键可能通过疏水相互作用结合,导致表面疏水性下降。结合溶解度变化趋势,羊肉宰后成熟时间以72 h为宜。
2.4 宰后成熟过程中山羊肉肌原纤维蛋白流变学性质的变化
羊肉宰后成熟过程中肌原纤维蛋白贮能模量(G’,反映网状结构弹性要素的改变)和耗能模量(G”,反映黏性要素的改变)变化分别如图4、5所示。肌原纤维蛋白凝胶的流变学特性与蛋白质结构密切相关,G’是衡量蛋白凝胶能力的一个重要指标,G’值高意味着凝胶能力强。由图4可知,在不同的成熟时间点,羊肉肌原纤维蛋白G’的变化趋势基本一致。升温初始阶段G’变化平稳,随着温度的升高G’降至最低点,之后逐步回升,当温度超过45 ℃以后,G’增加迅速,变化差异显著(P<0.05)。在加工温度85 ℃时,羊肉MP的G’在24 h达到最大,与最大凝胶强度的成熟时间点一致。羊肉宰后成熟过程中MP的耗能模量(G”)随温度的变化趋势与G’相似。
宰后成熟过程中羊肉MP的G’经历了先升高后降低再升高的变化趋势,有研究[21-22]认为,初始升温阶段G’的上升是由于肌球蛋白头部开始接合;随着温度的继续升高,肌球蛋白尾部开始逐渐展开,头部接合又瓦解,使得G’开始降至最小值;温度持续升高超过45 ℃后,MP开始变性,形成了复杂的凝胶网络,使得G’再次回升。在宰后成熟过程中,羊肉MP的G’在24 h整体处于较高水平,表明在此成熟点MP形成凝胶的能力最强。此研究结果与李兴艳[23]在研究兔肉成熟过程中其盐溶蛋白流变学特性的变化趋势基本一致。

图4 宰后成熟过程中羊肉肌原纤维蛋白贮能模量的变化Fig.4 Change in myofibrillar protein storage modulus (G’) in goat rear legs during postmortem aging

图5 宰后成熟过程中羊肉肌原纤维蛋白耗能模量的变化Fig.5 Change in myofibrillar protein loss modulus (G”) in goat rear legs during postmortem aging
2.5 宰后成熟过程中山羊肉肌原纤维蛋白凝胶特性的变化
由表1可知,随着宰后成熟时间的增加,羊肉肌原纤维蛋白热诱导凝胶的硬度和弹性的变化趋势相一致,均为先增加后降低,并在宰后24 h时达到最大值,分别为(88.00±6.86) N和(0.84±0.07) mm,之后随着成熟时间的延长,均呈下降趋势,并在24~48 h变化差异显著(P<0.05)。其他特性指标(内聚性、胶着性和咀嚼性)都随成熟时间的延长而减小,表明在加热过程中形成了较弱的凝胶网络。

表1 宰后成熟过程中羊肉肌原纤维蛋白凝胶特性的变化Table 1 Change in myofibrillar protein gel properties in goat rear legs during postmortem aging
肌原纤维蛋白凝胶的质构特性,如硬度、弹性、内聚性和胶着性等都能反映凝胶蛋白的口感和质地,也是反映产品质量和出品率的重要指标。其中硬度是蛋白质凝胶最重要的功能特性之一。肌原纤维蛋白中,肌球蛋白对凝胶的形成发挥关键作用,想得到较大强度的凝胶就要保持肌球蛋白重链的完整性。其原因是肌球蛋白轻链经加热后会发生分离进而被溶解,而溶解后细小的轻链形成的凝胶比重链产生的凝胶要弱[24-25]。根据蛋白质凝胶特性变化规律,结合羊肉的加工性能,羊肉宰后成熟时间以72~96 h为宜。
2.6 宰后成熟过程中山羊肉肌原纤维蛋白凝胶蒸煮损失的变化

图6 宰后成熟过程中羊肉肌原纤维蛋白凝胶蒸煮损失的变化Fig.6 Change in myofibrillar protein gel cooking loss in goat rear legs during postmortem aging
由图6可知,羊肉肌原纤维蛋白凝胶蒸煮损失随着宰后成熟时间的延长呈先升高后降低的变化趋势。羊肉MP的凝胶蒸煮损失在宰后前24 h显著增加(P<0.05),并达最大值(20.32±1.01)%,凝胶保水性最差,此后随着成熟时间的延长其蒸煮损失逐渐降低,且在时间点72~168 h内变化差异不显著(P>0.05),即凝胶保水性增大。因此羊肉最佳成熟时间以72 h为宜。
持水力是肉和肉制品重要的物性指标,不仅关系到肉本身的品质特性(如色、香、味、形、营养、多汁性和嫩度),还与肉制品的出品率和经济效益相关。有研究表明,蛋白质分子间的静电相互作用、氢键作用和毛细管作用是维系肉及肉制品中水分保留的主要作用力[26]。羊肉MP热诱导凝胶是蛋白质之间相互作用形成空间三维网络结构的结果。在受热过程中,MP中的肌球蛋白和肌动蛋白相互作用,缠绕重组,形成较为均一的网络结构,这些网络结构较稳定时会将游离水封闭在其中,使得凝胶保水性增强[27]。随着成熟时间的延长,蛋白质变性引起蛋白质构象发生改变,损失了大量肌球蛋白和肌动蛋白,热诱导凝胶的空间三维结构不稳定,保水性下降[27]。
3 结 论
大足黑山羊在宰后成熟过程中,肌原纤维蛋白的溶解度、乳化性、疏水性、流变学性质、凝胶特性和凝胶蒸煮损失等均有显著变化。羊肉MP的溶解度、EAI和ESI均呈先下降后上升的变化趋势,且在宰后24 h达到最小值。相反羊肉MP的表面疏水性、凝胶硬度和弹性及凝胶蒸煮损失都呈先增加后降低的变化趋势,且在宰后24 h达到最大值。羊肉宰后成熟过程中MP的G’和G”都呈现出先升高后降低再上升的变化趋势,在85 ℃时,羊肉中MP的G’在24 h时最大,与最大凝胶强度的成熟时间点一致。综合考虑羊肉成熟过程中MP的溶解度、乳化性和凝胶等功能性质的变化以及羊肉的加工特性,最终确定大足黑山羊宰后最佳成熟时间为72 h。
[1] 毛文星, 苏效良, 张兴文. 黑山羊产业化开发的对策与相关问题的研究[J]. 中国草食动物, 2008, 28(6): 53-57.
[2] EKIZ B, YILMAZ A, OZCAN M, et al. Carcass measurements and meat quality of Turkish Merino, Ramlic, Kivircik, Chios and Imroz lambs raised under an intensive production system[J]. Meat Science, 2009, 82(1): 64-70.
[3] SANTOS V A, SILVA S R, AZEVEDO J M. Carcass composition and meat quality of equally mature kids and lambs[J]. Journal of Animal Science, 2008, 86(8): 1943-1950.
[4] STANISZ M, ŚLÓSARZ P, ADAM G. Slaughter value and meat quality of goat kids with various share of Boer blood[J]. Animal Science Papers and Reports, 2009, 27(3): 189-197.
[5] FAJT Z, DRABEK J, STEINHAUSER L, et al. The significance of pork as a source of dietary selenium-an evaluation of the situation in the Czech Republic[J]. Neuroendocrinology Letters, 2009, 30(Suppl 1): 17-21.
[6] 汪水平, 王文娟, 汪学荣, 等. 舍饲大足黑山羊羔羊肉品理化性状及食用品质的研究[J]. 安徽农业科学, 2010, 38(33): 18874-18876.
[7] 赵中权, 张家骅, 李周权, 等. 大足黑山羊种质特性[J]. 中国畜牧杂志, 2008, 44(15): 9-10.
[8] HERRERA-MENDEZ C H, BECILA S, BOUDJELLAL A, et al. Meat ageing: reconsideration of the current concept[J]. Trends in Food Science & Technology, 2006, 17(8): 394-405.
[9] XIONG Youling L., LOU Xingqiu, WANG Changzheng, et al. Protein extraction from chicken myofibrils irrigated with various polyphosphate and nacl solutions[J]. Journal of Food Science, 2000, 65(1): 96-100.
[10] AGYARE K K, XIONG Youling L., ADDO K. Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J]. Food Chemistry, 2008, 107(3): 1131-1137.
[11] AGYARE K K, ADDO K, XIONG Youling L.. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[12] CHELH L, GATELLIER P, SANTE-LHOUTELLIER V. Technical note: a simplified procedurefor myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[13] CHIN K B, GO M Y, XIONG Youling L.. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.
[14] DOERSCHER D R, BRIGGS J L, LONERGAN S M. Effects of pork collagen on thermal and viscoelastic properties of purified porcine myofibrillar protein gels[J]. Meat Science, 2003, 66(1): 181-188.
[15] 宋玉. 不同品种鸡肉成熟过程中品质特性比较研究[D]. 南京: 南京农业大学, 2011.
[16] DECKER E A, XIONG Youling L., CALVERT J T, et al. Chemical, physical, and functional properties of oxidized turkey white muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(2): 186-189.
[17] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry, 1997, 45(2): 310-320.
[18] SNIDER D W, COTTERILL O J. Hydrogen peroxide oxidation and coagulation of egg white[J]. Journal of Food Science, 1972, 37(4): 558-561.
[19] LAWAL O S, ADEBOWALE K O, OGUNSANWO B M, et al. On the functional properties of globulin and albumin protein fractions and flours of African locust bean (Parkia biglobossa)[J]. Food Chemistry, 2005, 92(4): 681-691.
[20] OOIZUMI T, XIONG Youling L.. Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J]. Journal of Agricultural and Food Chemistry, 2004, 52(13): 4303-4307.
[21] EGELANDSDAL B, FRETHEIM K, SAMEJIMA K. Dynamic rheological measurements on heat-induced myosin gels: effect of ionic strength, protein concentration and addition of adenosine triphosphate or pyrophosphate[J]. Journal of the Science of Food and Agriculture, 1986, 37(9): 915-926.
[22] CHEN Lin, FENG Xianchao, LU Feng, et al. Effects of camptothecin, etoposide and Ca2+on caspase-3 activity and myofibrillar disruption of chicken during postmortem ageing[J]. Meat Science, 2011, 87(3): 165-174.
[23] 李兴艳. 兔肉成熟过程中理化及蛋白质功能性质的变化[D]. 重庆:西南大学, 2014.
[24] 王苑. 不同处理方式对肌原纤维蛋白好大豆分离蛋白混合凝胶特性的影响[D]. 南京: 南京农业大学, 2007.
[25] 李亚楠. 鸭肉中肌原纤维蛋白的提取及凝胶特性的研究[D]. 天津:天津商业大学, 2012.
[26] SAME R L, GALBREATH J W. Effect of heat proecssing on extraebility of salt soluble protein issure binding strength and cooking loss in poultry meat loaves[J]. Journal of Food Science, 1972, 37: 244-226.
[27] PARK D, XIONG Youling L., ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2006, 101(3): 1239-1246.
Changes in Functional Properties of Myofibrillar Proteins during Postmortem Aging of Dazu Black Goat Meat
WANG Xiaojun1, WANG Xiaoxiang1, LIN Jing1, LI Lin1, SHANG Yongbiao1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Quality and Safety Risk Assessment Laboratory of Products Preservation (Chongqing), Ministry of Agriculture, Chongqing Engineering Research Center of Regional Food, Chongqing 400715, China)
In this study, we examined changes in functional properties of myofibrillar proteins (MP) from the hind leg muscle of Dazu black goat during postmortem aging. Results showed that with the extension of postmortem time, the solubility, emulsifying activity index and emulsion stability of MPs rose initially and then fell, reaching minimum values at 24 h postmortem. In contrast, the opposite trend was observed for surface hydrophobicity, gel hardness and elasticity and cooking loss, with maximum values observed at 24 h postmortem. Based on these observations, the best postmortem aging time for improved processing characteristics of Dazu black goat meat is 72 h.
Dazu black goat meat; postmortem aging; myofibrillar protein; functional properties
TS251
A
1002-6630(2015)21-0079-06
10.7506/spkx1002-6630-201521016
2015-05-28
重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
王晓君(1991—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:1105008987@qq.com
*通信作者:尚永彪(1964—),男,教授,博士,研究方向为农产品加工。E-mail:shangyb64@sina.com

