胰岛素类似物对妊娠安全性的影响:系统评价和荟萃分析
吕诗诗 徐勇 王吉英
荟萃分析
胰岛素类似物对妊娠安全性的影响:系统评价和荟萃分析
吕诗诗 徐勇 王吉英
目的 探讨胰岛素类似物门冬胰岛素(aspart)、赖脯胰岛素(lispro)、甘精胰岛素(glargine)、地特胰岛素(detemir)对妊娠糖尿病结局的影响。方法 分别在Embase、Pubmed、Cochrane数据库中检索不同胰岛素类似物治疗妊娠糖尿病的回顾性研究、前瞻性研究及随机对照研究的文献,所有数据库均检索至2014年3月31日。相关数据使用Revman5.2软件进行分析。结果 共检索文献3 519篇,其中24篇符合纳入标准,共纳入研究对象3 734例。Lispro与常规胰岛素相比,可以减少新生儿黄疸[风险比(RR=0.63,95%CI:0.44~0.90,P=0.01)]、孕妇严重低血糖(RR=0.33,95%CI:0.12~0.89,P=0.03)的发生,但可增加新生儿体重(WMD=116.44,95%CI:28.78~204.11,P=0.009)和大于胎龄儿(RR=1.42,95%CI:1.20~1.69,P<0.000 1)的发生。Aspart与常规胰岛素相比,剖宫产及巨大儿的发生率无显著差别。Glargine与NPH相比,不增加新生儿体重、严重低血糖等不良结局的发生。Detemir与NPH相比,不增加大于胎龄儿、巨大儿及新生儿低血糖的发生。结论 在妊娠糖尿病患者中使用aspart、glargine、detemir不会增加母亲和胎儿不良后果,有较好的安全性,但lispro的安全性需要进一步研究。
胰岛素类似物;妊娠;糖尿病;不良结局
大量证据表明,高血糖对孕妇及胎儿的结局均存在不良影响。而胰岛素是妊娠糖尿病的首选药物。有文献证实,在妊娠期间应用赖脯胰岛素(lispro)对胎儿及孕妇均有良好的安全性[1]。但也有研究提示使用lispro可能会增加巨大儿及大于胎龄儿的发生率[2-3]。目前研究多是观察性小样本研究且结果并不一致。本文拟对临床上常用的速效胰岛素类似物[门冬胰岛素(aspart)、lispro]和长效胰岛素类似物[甘精胰岛素(glargine)、地特胰岛素(detemir)]治疗妊娠糖尿病的研究进行荟萃分析,探讨其是否会增加妊娠不良结局的发生,为妊娠糖尿病的治疗提供证据支持。
1 对象与方法
1.1 检索策略 在数据库Embase、Pubmed、Cochrane中进行检索,使用的检索词包括:aspart、lispro、glargine、lantus、hoe-901、optisulin、humalog、detemir、levemir、long-acting insulin analogues、short-acting insulin analogues 与 insulin analogues、pregnancy、gestation。所有数据库均检索至2014年3月31日。
收集文献相关数据包括:作者、发表时间、胰岛素及胰岛素类似物的使用情况、患者患病情况(包括妊娠前糖尿病及妊娠糖尿病)及妊娠结局。文章中搜集孕妇的一般情况包括年龄、体重指数、患糖尿病时间、HbA1c。孕妇不良结局包括:妊娠相关高血压、先兆子痫、严重低血糖、剖宫产、肩难产。胎儿不良结局包括:新生儿体重增加、早产(小于37周)、新生儿呼吸功能障碍、新生儿低血糖、大于胎龄儿(LGA,新生儿体重>同胎龄出生新生儿体重的90%)、新生儿监护室、巨大儿(体重>4000g)、新生儿黄疸、新生儿死亡、先天畸形等。
1.2 纳入及排除标准 纳入标准:(1)研究对象为妊娠的1型、2型糖尿病患者,或妊娠糖尿病患者。(2)在同一研究中存在胰岛素类似物与NPH或普通胰岛素的对比使用。(3)在研究中有相关研究结果的比较。(4)文章为回顾性研究、前瞻性研究及随机、对照研究。
排除标准:(1)缺乏研究对象的相关数据。(2)没有明确说明开始使用胰岛素类似物治疗的时间或者使用胰岛素类似物治疗的持续时间。(3)非英文文献。
1.3 数据提取及质量评价 文献的质量评价由两名研究员独立进行,对文献质量存在异议的,经过第三方决定文献是否纳入。对队列及病例对照研究采用cochrane协作网推荐的NOS标准进行评价,对随机对照试验采用cochrane协作网推荐的偏移风险评价工具进行评价。
1.4 统计学处理 采用cochrane协作网推荐的Reviman5.2软件进行统计分析。对连续变量采用加权均数差(WMD)及95%可信区间(95%CI),对分类变量采用风险比(RR)及95%CI。异质性的检验使用卡方检验及I2检验,认为I2值为25%、50%、75%,分别为异质性低、中、高。本研究中定义异质性小于50%,为异质性可以接受,采用固定效应模型分析。当异质性大于50%时,分析异质性来源,若原因不明,采用随机效应模型进行分析。
2 结果
2.1 检索文献结果 总共检索文献3 519篇,排除重复文献2 753篇,经阅读标题及摘要排除文献662篇,阅读全文排除综述、信件、会议文献、非英文文献及无相关对照研究文献80篇,最终纳入文献24篇。其中 lispro、aspart、glargine、detemir分别为 9、5、8、2篇。总共纳入研究对象3 734例。纳入研究文献的特征见表1。
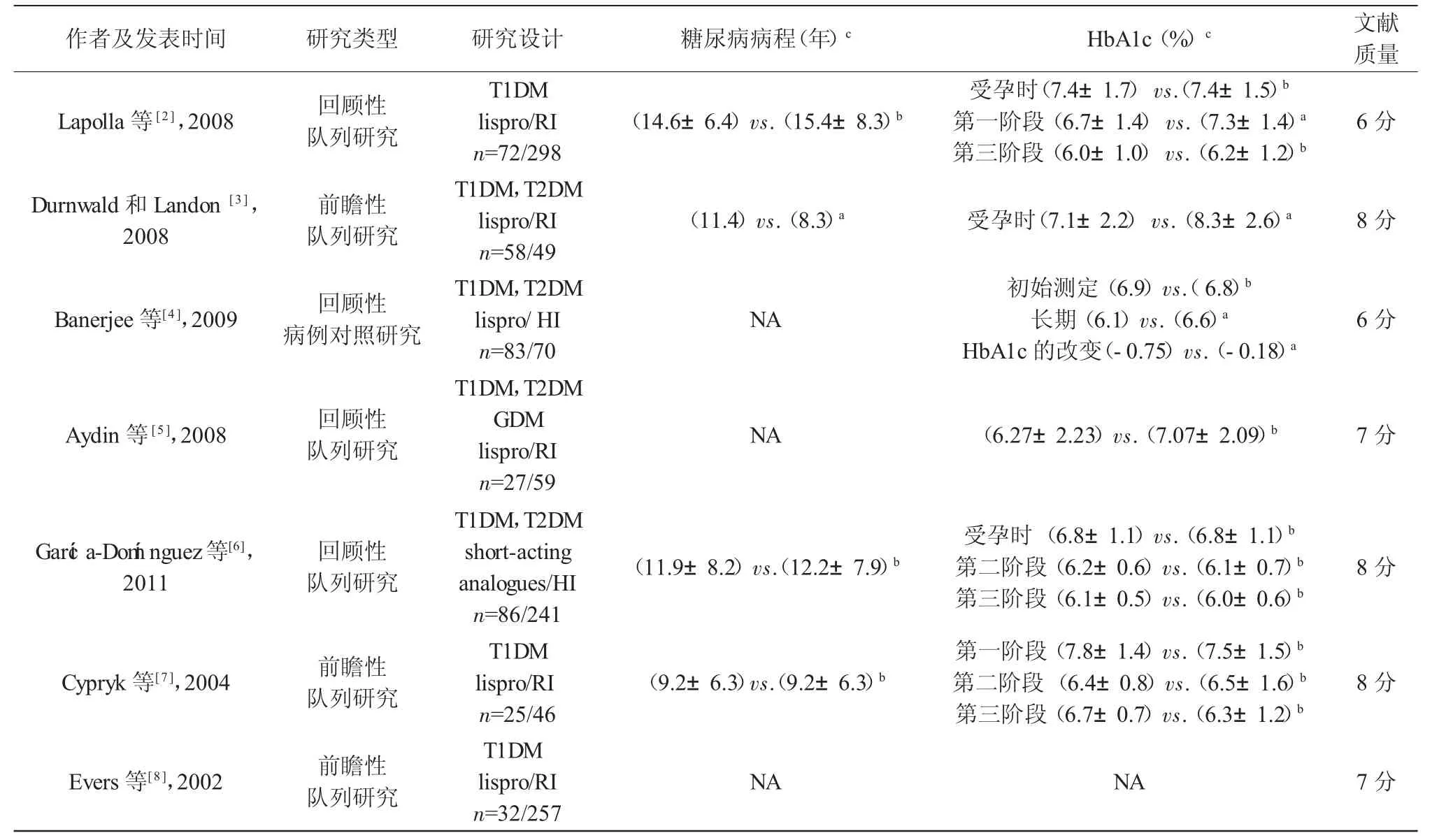
表1 纳入文献的特征
2.2 Lispro研究的荟萃分析 Lispro研究文献共纳入9篇,研究对象1 561例,其中452例使用lispro,1 089例使用常规胰岛素。使用Lispro与常规胰岛素两组研究对象基本条件的对比:年龄、妊娠前患糖尿病的时间及糖化血红蛋白无明显差别,使用lispro组的孕妇体重指数更低。
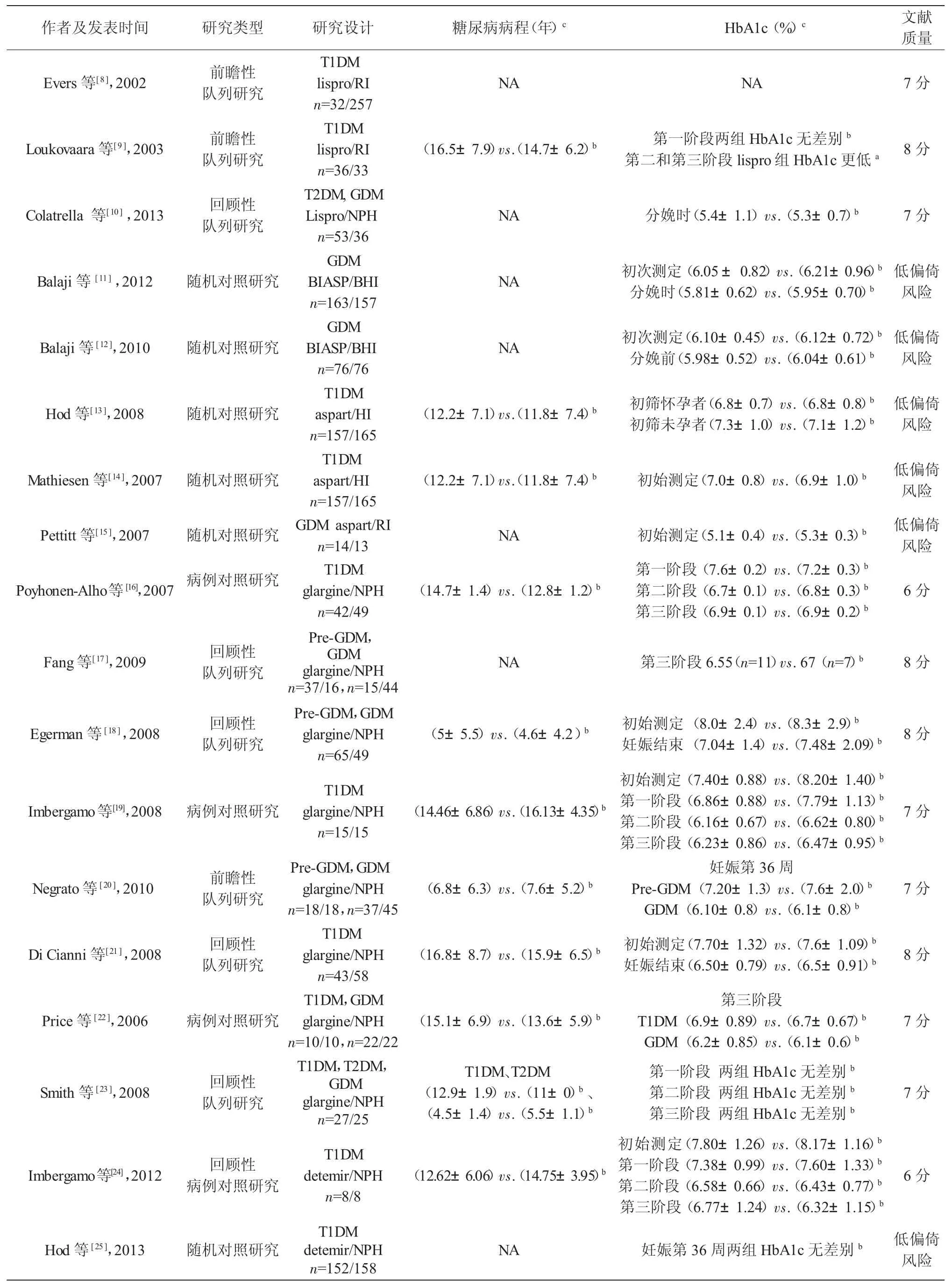
续表1
2.2.1 新生儿结局 4篇文献报道了新生儿黄疸,分析结果显示妊娠期使用lispro控制血糖可减少新生儿黄疸的发生(RR=0.63,95%CI:0.44~0.90),见图1。5篇文献报道了新生儿LGA的发生(RR=1.42,95%CI:1.20~1.69,),见图2。5 篇文献分析结果显示,与常规胰岛素相比,应用lispro会增加新生儿的体重(WMD=116.44,95%CI:28.78~204.11),见图3。笔者研究显示,lispro对新生儿低血糖、新生儿畸形、新生儿监护室、剖宫产率、新生儿呼吸窘迫综合征、巨大儿、早产及死产结果与常规胰岛素相比差异无统计学意义,分析结果见表2。
2.2.2 孕妇结局 2篇文献报道了孕妇发生严重低血糖事件[2,6]。结果显示,与常规胰岛素相比,应用lispro可减少孕妇严重低血糖的发生(RR=0.33,95%CI:0.12~0.89),见图4。不增加妊娠相关高血压及先兆子痫的发生(表2)。
2.3 Aspart研究的荟萃分析 纳入的有关aspart的5篇研究文献全部为随机、对照试验,纳入研究对象1 143例,其中567例使用aspart,516例使用常规胰岛素。纳入研究文献研究对象年龄、体重指数、HbA1c均无明显差别。两篇文献报道了巨大儿,结果显示使用aspart与常规胰岛素比较无明显差别(RR=0.81,95%CI:0.42~1.58,P=0.54)[11-12]。2篇文献提及剖宫产率亦无明显差别(RR=1.00,95%CI:0.92~1.08,P=0.95)[12-13]。
2.4 Glargine研究的荟萃分析 共纳入glargine相关文献8篇,研究对象702例,其中331例使用glargine,371例使用NPH。与应用NPH相比:使用glargine的孕妇年龄更小,两组孕妇的体重指数及HbA1c无明显差别。
2.4.1 新生儿结局 6篇文献报道了新生儿的体重,分析结果显示glargine与NPH相比,新生儿体重无差别(WMD=9.98,95%CI:-22.62~42.58)。在妊娠前患有糖尿病(WMD=8.29,95%CI:-24.75~41.33)及妊娠糖尿病(WMD=72.25,95%CI:-128.23~272.73)的孕妇中亦不存在区别[16-19,22-23],见图5。6 篇文献报道了新生儿呼吸窘迫综合征的发生,结果提示使用glargine与NPH比较不增加新生儿呼吸窘迫综合征的发生(RR=2.03,95%CI:0.99~4.19),见表3。本研究对相关数据进行合并后发现,glargine、NPH两组中,新生儿低血糖、新生儿黄疸、LGA、早产、巨大儿的发生率均无显著差别(表3)。
2.4.2 孕妇结局 3篇纳入文献报道了孕妇严重低血糖的发生,结果显示使用glargine有减少孕妇严重低血糖发生的趋势,但没有统计学意义(RR=0.39,95%CI:0.11~1.40),见图6。对比 glargine和 NPH,孕妇的妊娠期高血压、先兆子痫及肩难产的结果无显著差别,见表3。
2.5 Detemir研究的荟萃分析 共纳入2篇detemir相关文献,均报道了LGA的发生(RR=0.85,95%CI:0.67~1.08,P=0.19)及新生儿低血糖的发生(RR=0.76,95%CI:0.43~1.34,P=0.34)[24-25]。
3 讨论
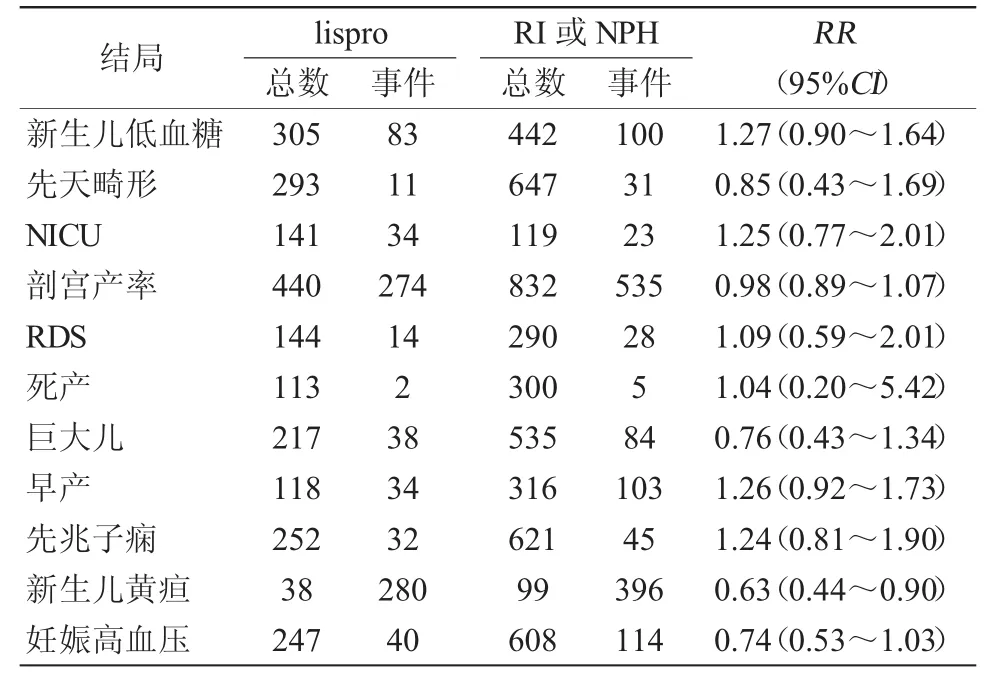
表2 Lispro治疗对孕妇及新生儿结局的影响
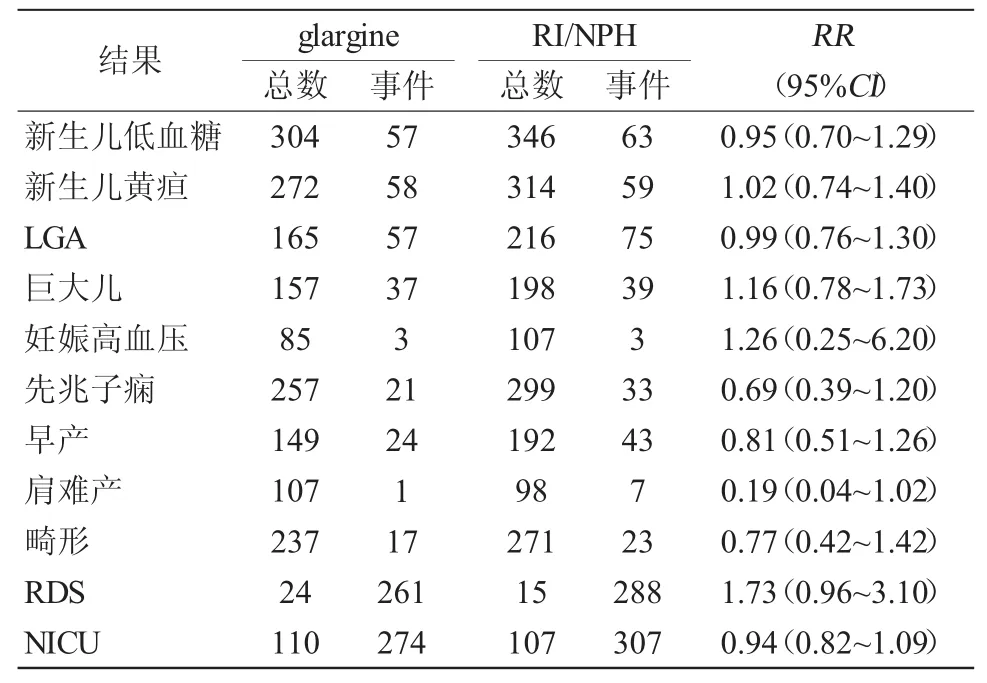
表3 Glargine治疗对孕妇及新生儿结局的影响
应用胰岛素类似物可更好地控制孕妇血糖,但其安全性成为人们关注的焦点。本研究搜集了4种胰岛素类似物 lispro、aspart、glargine及 detemir治疗妊娠糖尿病的文献,探讨胰岛素类似物的使用是否会增加妊娠的不良结局。
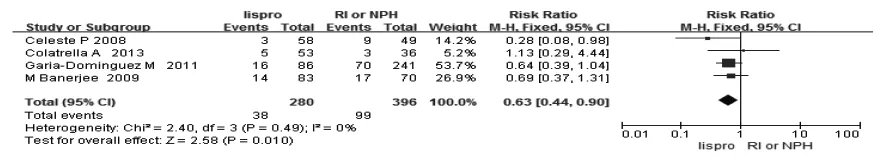
图1 lispro与RI/NPH治疗对新生儿黄疸发生率的影响
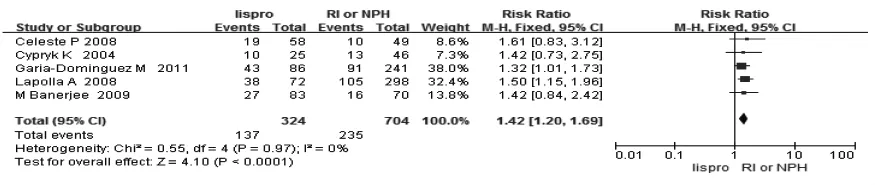
图2 lispro与RI/NPH治疗对大于胎龄儿发生率的影响
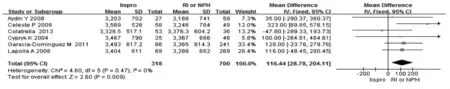
图3 lispro与RI/NPH治疗对新生儿体重增加发生率的影响
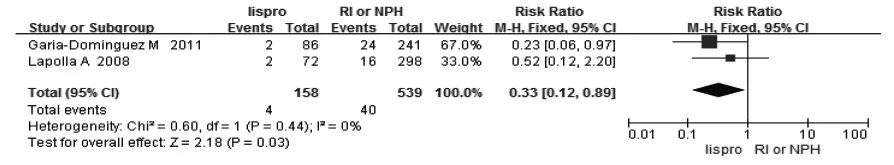
图4 lispro与RI/NPH治疗对孕妇严重低血糖发生率的影响
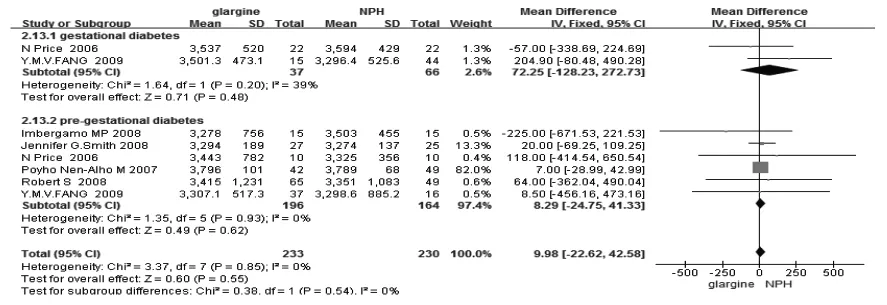
图5 glargine与NPH治疗对新生儿体重的影响
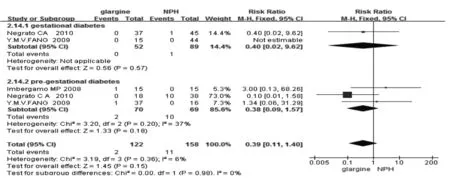
图6 glargine与NPH治疗对孕妇严重低血糖发生率的影响
Lispro与常规胰岛素相比可以减少孕妇严重低血糖的发生,笔者认为可能与lispro起效快、排泄快的特点有关。Edson等[26]荟萃分析研究认为孕妇使用lispro与人胰岛素相比并不增加新生儿畸形的发生率,与笔者的研究结果相符。GonzalezBlanco等[27]荟萃分析研究则认为妊娠期使用lispro可以增加新生儿LGA的发生,与笔者研究结果相同。与以前的荟萃分析比较,笔者纳入了更多的文献。本研究结果还提示lispro会增加新生儿体重,在两组中研究对象的年龄、患糖尿病时间及HbA1c水平均没有明显差别,甚至在lispro组孕妇的体重指数更低。因此,笔者认为这样的结果不能用患者血糖控制情况解释,可能与存在于孕妇胎盘中的胰岛素样生长因子(IGF)有关。研究证实,在LGA体内IGF-1及其受体的含量高于正常胎儿[28]。Lispro与IGF-1受体的结合率高于常规胰岛素,lispro与IGF-1有更好的同源性。但Boskovic等[29]研究证实安全剂量的lispro不会通过胎盘。笔者的荟萃分析结果显示,aspart和常规胰岛素两组在剖宫产率及巨大儿发生率方面无明显差别。Lispro与aspart均为速效胰岛素类似物,笔者的研究显示孕妇使用lispro(RR=0.76)及aspart(RR=0.81)巨大儿的发生率差异无统计学意义。笔者考虑lispro对妊娠结局的影响可能不能用类似物本身解释,可能与吸烟等因素有关,但笔者纳入的文献中并没有提及该指标[8]。
2008年英国的妊娠糖尿指南指出aspart和lispro是治疗妊娠糖尿病的安全用药[30]。2013年,美国内分泌协会推荐在妊娠期间使用短效胰岛素类似物控制血糖[31]。本研究结果中也没有证据证明使用aspart会增加严重的妊娠不良结局,但提示使用lispro会增加新生儿体重及LGA的发生率,这可能会增加分娩时对胎儿神经及肌肉的损伤,降低其在妊娠期间使用的安全性。
笔者共纳入8篇glargine相关研究文献。研究结果中没有证据表明glargine的使用会增加孕妇及新生儿的不良结局。Pollex等[32]研究证实,与NPH相比,使用glargine不会增加新生儿的不良结局,与本研究结果相同。Glargine可以持续作用24 h,且没有作用高峰,可以平稳降糖,能更好的控制孕妇血糖。研究结果显示使用detemir与NPH比较并不增加LGA、新生儿低血糖、巨大儿的发生。但该结果显示存在较大的异质性(I2=45%)。笔者考虑可能与文献数量过少等因素有关。Callesen等[33]对113例患1型糖尿病的妊娠妇女进行研究,其中67例使用glargine,46例使用detemir。研究结果显示除glargine组LGA的发生率更低外,两组的血糖控制及妊娠结局均无明显差别,提示detemir与glargine用于妊娠糖尿病治疗的安全性没有差异。2013年,美国内分泌协会推荐在妊娠前使用detemir或glargine可以将血糖控制满意的妇女,建议在妊娠前及妊娠期间可以继续使用这两种长效胰岛素类似物,但是glargine并没有被美国食品药品监督管理局批准用于妊娠糖尿病的治疗[31]。本研究没有证据证明使用glargine会增加妊娠不良结局。
本研究的局限在于纳入了小样本量的研究,且大部分为观察性研究。队列研究决定了研究的对象为非随机选择,可能存在选择偏倚风险。对观察性研究数据的收集可能存在受不同收集习惯的影响。患者是否使用及使用何种胰岛素类似物还取决于其家庭收入、是否参加了国家的医疗保险及受教育的程度等其他方面的影响,部分患者更愿意使用疗效明确的常规胰岛素,使用glargine的治疗费用较NPH更高。Shankardassk等[34]研究提示不良胎儿结局与低经济社会地位有关。孕妇的文化程度亦可影响妊娠结局[35]。Sciffres等[36]研究还证实在超重及肥胖孕妇中,LGA的发生率增加。而笔者纳入的文献缺少上述影响因素的数据,故不能进行更完整的分析。
综上,本研究分析了目前临床上采用的4种胰岛素类似物对妊娠不良结局的影响。结果显示aspart、glargine、detemir 3种胰岛素类似物的使用不会增加孕妇及新生儿的不良结局,说明其对妊娠糖尿病的治疗具有较好安全性。而lispro可减少新生儿黄疸、孕妇严重低血糖的发生,但增加LGA的发生率及新生儿体重。本研究纳入了小样本的队列或病例对照研究,故认为研究结果需要样本例数更大的高质量随机、对照试验来验证。
[1]Edson EJ,Bracco OL,Vambergue A,et al.Managing diabetes during pregnancy with insulin lispro:a safe alternative to human insulin[J].Endocrine Practice,2010,16(6):1020-1027.
[2]Lapolla A,Dalfrà MG,Spezia R,et al.Outcome of pregnancy in type 1 diabetic patients treated with insulin lispro or regular insulin:an Italian experience[J].Acta Diabetol,2008,45(1):61-66.
[3]Durnwald CP,Landon MB.A comparison of lispro and regular insulin for the management of type 1 and type 2 diabetes in pregnancy[J].J Matern Fetal Neonatal Med,2008,21(5):309-313.
[4]Banerjee M,Bhattacharya A,Hughes SM,et al.Efficacy of insulin lispro in pregnancies complicated with pregestational diabetes mellitus[J].Practical Diabetes Int,2009,26(9):366-370.
[5]Aydin Y,Berker D,Direktor N,et al.Is insulin lispro safe in pregnant women:does it cause any adverse outcomes on infants or mothers?[J].Diabetes Res Clin Pract,2008,80(3):444-448.
[6]García-Domínguez M,Herranz L,Hillman N,et al.Use of insulin lispro during pregnancy in women with pregestational diabetes mellitus[J].Med Clin(Barc),2011,137(13):581-586.
[7]Cypryk K,Sobczak M,Pertyńska-Marczewska M,et al.Pregnancy complications and perinatal outcome in diabetic women treated with Humalog(insulin lispro)or regular human insulin during pregnancy[J].Med Sci Monit,2004,10(2):PI29-PI32.
[8]Evers IM,de Valk HW,Mol BW,et al.Macrosomia despite good glycaemic control in type 1 diabetic pregnancy results of a nationalwide study in the Netherlands[J].Diabetologia,2002,45(11):1484-1489.
[9]Loukovaara S,Immonen I,Teramo KA,et al.Progression of retinopathy during pregnancy in type 1 diabetic women treated with insulin lispro[J].Diabetes Care,2003,26(4):1193-1198.
[10]Colatrella A,Visalli N,Abbruzzese S,et al.Comparison of insulin lispro protamine suspension with NPH insulin in pregnant women with type 2 and gestational diabetes mellitus:maternal and perinatal outcomes[J].Int J Endocrinol,2013,2013:151975.
[11]Balaji V,Balaji MS,Alexander C,et al.Premixed insulin aspart 30(BIAsp 30)versus premixed human insulin 30(BHI 30)in gestational diabetes mellitus:a randomized open-label controlled study[J].Gynecol Endocrinol,2012,28(7):529-532.
[12]Balaji V,Balaji MS,Alexander C,et al.Premixed insulin aspart 30(Bia sp 30)vs.premixed human insulin 30(Bhi 30)in gestational diabetes mellitus:a pilot study[J].J Assoc Physicians India,2010,58:99-101.
[13]Hod M,Damm P,Kaaja R,et al.Fetal and perinatal outcomes in type 1 diabetes pregnancy:a randomized study comparing insulin aspart with human insulin in 322 subjects[J].Am J Obstet Gynecol,2008,198(2):186.e1-e7.
[14]Mathiesen ER,Kinsley B,Amiei SA,et al.Maternal glycemic control and hypoglycemia in type 1 diabetic pregnancy:a randomized trial of insulin aspart versus human insulin in 322 pregnant women[J].Diabetes Care,2007,30(4):771-776.
[15]Pettitt DJ,Ospina P,Howard C,et al.Efficacy,safety and lack of immunogenicity of insulin aspart compared with regular human insulin for women with gestational diabetes mellitus[J].Diabet Med,2007,24(10):1129-1135.
[16]Poyhonen-Alho M,Ronnemaa T,Saltevo J,et al.Use of insulin glargine during pregnancy[J].Acta Obstet Gynecol Scand,2007,86(10):1171-1174.
[17]Fang YM,Mackeen D,Egan JF.Insulin glargine compared with Neutral Protamine Hagedorn insulin in the treatment of pregnant diabetics[J].J Matern Fetal Neonatal Med,2009,22(3):249-253.
[18]Egerman RS,Ramsey RD,Kao LW,et al.Perinatal outcomes in pregnancies managed with antenatal insulin glargine[J].Am J Perinatol,2009,26(8):591-595.
[19]Imbergamo MP,Amato MC,Sciortino G,et al.Use of glargine in pregnant women with type 1 diabetes mellitus:a case-control study[J].Clin Ther,2008,30(8):1476-1484.
[20]Negrato CA,Rafacho A,Negrato G,et al.Glargine vs.NPH insulin therapy in pregnancies complicated by diabetes:an observational cohort study[J].Diabetes Res Clin Pract,2010,89(1):46-51.
[21]Di Cianni G,Torlone E,Lencioni C,et al.Perinatal outcomes associated with the use of glargine during pregnancy[J].Diabet Med,2008,25(8):993-996.
[22]Price N,Bartlett C,Gillmer MD.Use of insulin glargine during pregnancy:a case-control pilot study[J].BJOG,2007,114(4):453-457.
[23]Smith JG,Manuck TA,White J,et al.Insulin glargine versus neutral protamine hagedorn insulin for treatment of diabetes in pregnancy[J].Am J Perinatol,2009,26(1):57-62.
[24]Imbergamo MP,Amato MC,Amodeo R,et al.Use of basal insulin analog detemir in pregnant women with type 1 diabetes:a casecontrol retrospective study[J].Giorn Ost Gin,2012,34:491-498.
[25]Hod M,Mathiesen ER,Jovanovic L,et al.A randomized trial comparing perinatal outcomes using insulin detemir or neutral protamine Hagedorn in type 1 diabetes[J].J Matern Fetal Neonatal Med,2014,27(1):7-13.
[26]Edson EJ,Bracco OL,Vambergue A,et al.Managing diabetes during pregnancy with insulin lispro:a safe alternative to human insulin[J].Endocr Pract,2010,16(6):1020-1027.
[27]Gonzalez Blanco C,Chico Ballesteros A,Gich Saladich I,et al.Glycemic control and pregnancy outcomes in women with type 1 diabetes mellitus using lispro versus regular insulin:a systematic review and meta-analysis[J].Diabetes Technol Ther,2011,13(9):907-911.
[28]Elhddad AS,Lashen H.Fetal growthin relation tomaternal and fetal IGF-axes:a systematic review and meta-analysis[J].Acta Obstet Gynecol Scand,2013,92(9):997-1006.
[29]Boskovic R,Feig DS,Derewlany L,et al.Transfer of insulin lispro across the human placenta:in vitro perfusion studies[J].Diabetes Care,2003,26(5):1390-1394.
[30]Guideline Development Group.Management of diabetes from preconception to the postnatal period:summary of NICE guidance[J].Br Med J,2008,336(7646):714-717.
[31]Blumer I,Hadar E,Hadden DR,et al.Diabetes and pregnancy:an endocrine society clinicalpractice guideline[J].J Clin Endocrinol Metab,2013,98(11):4227-4249.
[32]Pollex E,Moretti ME,Koren G,et al.Safety of insulin glargine use in pregnancy:a systematic review and meta-analysis[J].Ann Pharmacother,2011,45(1):9-16.
[33]Callesen NF,Damm J,Mathiesen JM,et al.Treatment with the long-acting insulin analogues detemir or glargine during pregnancy in women with type 1 diabetes:comparison of glycaemic control and pregnancy outcome[J].J Matern Fetal Neonatal Med,2013,26(6):588-592.
[34]Shankardass K,O'campo P,Dodds L,et al.Magnitude of income-related disparities in adverse perinatal outcomes[J].BMC Pregnancy Childbirth,2014,14r96.
[35]Mortensen LH.Socioeconomic inequality in birth weight and gestational age in Denmark 1996-2007:using a family-based approach to explore alternative explanations[J].Soc Sci Med,2013,76(1):1-7.
[36]Scifres CM,Feqhali MN,Althouse AD,et al.Effect of excess gestational weight gain on pregnancy outcomes in women with type 1 diabetes[J].Obste Gynecol,2014,123(6):1295-1302.
Safety of insulin analogues in pregnant women:a systematic review and meta-analysis
Lyu Shishi,Xu Yong,Wang Jiying.Department of Endocrinology,Affiliated Hospital of Luzhou Medical College,Luzhou 646000,China
Xu Yong,Email:xywyll@aliyun.com
ObjectiveToassess the effects ofinsulin analogues(aspart,lispro,glargine,and detemir)on the pregnant outcome in diabetic patients.MethodsEmbase,Pubmed,and Cochrane database were searched for respective study,prospective study and randomized study on different insulin analogues therapy through May 31,2014.Statistical analysis was done by RevMan 5.2 software.Results3 519 articles were searched,24 studies met the eligible criteria and a total of 3 734 cases were included.Compared with regular insulin,lispro decreased the rates of neonatal jaundice[risk ratio(RR=0.63,95%CI:0.44-0.90,P=0.01)]and severe maternalhypoglycemia(RR=0.33,95%CI:0.12-0.89,P=0.03),and increased birth weight(WMD=116.44,95%CI:28.78-204.11,P=0.009)and the incidence of large for gestational age(LGA)births(RR=1.42,95%CI:1.20-1.69,P<0.000 1).Rates ofcesarean section and macrosomia were similar in pregnant women treated with aspart and regular insulin.Birth weights and rates of severe maternal hypoglycemia were similar in pregnant women treated with glargine and NPH insulin.Rates ofLGA,macrosomia,and neonatal hypoglycemia were similar in pregnant women treated with detemir and NPH insulin.ConclusionsAspart,glargine,detemir are safe for the treatment of diabetes during pregnancy,and do not increase the adverse outcome ofmothers or fetuses,but the safetyoflisproneed further research.
Insulin analogues;Pregnancy;Diabetes mellitus;Adverse outcome
(Int J Endocrinol Metab,2015,35:93-99)
10.3760/cma.j.issn.1673-4157.2015.02.006
646000 四川省泸州医学院附属医院内分泌科
徐勇,Email:xywyll@aliyun.com
2014-10-13)

