间歇低氧对大鼠肝脏GSK-3及mTOR表达的影响
任国梅 任寿安
间歇低氧对大鼠肝脏GSK-3及mTOR表达的影响
任国梅 任寿安
目的 测定间歇低氧大鼠肝脏糖原合成酶激酶-3(GSK-3)及哺乳动物雷帕霉素靶蛋白(mTOR)的表达,观察间歇低氧对胰岛素信号转导通路的影响。方法 将24只健康雄性Sprague-Dawley大鼠按照随机数字表法分成间歇空气组(NC组)、间歇低氧4周组(IH4组)、间歇低氧8周组(IH8组),每组8只。于上午9:00至下午5:00将IH4组及IH8组暴露于间歇低氧舱内,NC组则给予间歇压缩空气。检测各组大鼠空腹血糖、空腹胰岛素(FINS),并以稳态模型评估-胰岛素敏感指数(HOMA-IS)及稳态模型评估-胰岛素抵抗指数(HOMA-IR)评价胰岛素抵抗;免疫组化法测定大鼠肝脏GSK-3及mTOR的表达,以平均灰度值评价二者的蛋白表达量。结果 与NC组相比,IH4组、IH8组HOMA-IS降低,空腹血糖、FINS、HOMA-IR升高,以IH8组更为显著(F值分别为62.52,100.37,68.90,85.49,P均<0.01);与NC组相比,IH4组、IH8组GSK-3及mTOR蛋白表达均升高,以IH8组更明显(F值分别为72.25,148.01,P均<0.01)。Pearson相关分析显示GSK-3、mTOR平均灰度值与HOMA-IS呈正相关(r=0.786,0.811,P均<0.01),与 HOMA-IR 呈负相关(r=-0.882,-0.889,P均<0.01)。结论 间歇低氧暴露使大鼠肝脏GSK-3、mTOR表达增加,从而引起胰岛素抵抗。
间歇低氧;胰岛素抵抗;糖原合成酶激酶-3;哺乳动物雷帕霉素靶蛋白
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种以睡眠中频繁发生呼吸气流减少或中断为特征的睡眠呼吸障碍,可诱发严重的睡眠结构紊乱,造成全身多器官、多系统的损伤。OSAHS并发糖尿病的关键在于胰岛素抵抗(IR),且IR随着OSAHS程度的加重而加重[1]。间歇低氧是OSAHS最显著的特征,而间歇低氧可致IR,具体机制尚待研究。胰岛素信号通路的信号减弱或通路受损是IR形成的必要条件,受体后缺陷是绝大多数IR的发生机制,磷脂酰肌醇3激酶(PI3K)/蛋白激酶 B(PKB/Akt)通路为胰岛素受体后主要的信号转导通路,该通路异常可致IR[2]。糖原合成酶激酶-3(GSK-3)及哺乳动物雷帕霉素靶蛋白(mTOR)为该通路重要的负反馈作用蛋白。本实验建立间歇低氧大鼠模型,模拟OSAHS患者的夜间低氧/复氧过程,并选择GSK-3、mTOR为研究靶点,探讨间歇低氧导致IR的机制。
1 材料与方法
1.1 实验动物及分组 健康雄性Sprague-Dawley大鼠24只,平均体重(170±10)g,按照随机数字表法分为间歇空气组(NC组)、间歇低氧4周组(IH4组)、间歇低氧8周组(IH8组),每组8只,标记。实验动物、饲料、垫料均由山西医科大学实验动物中心提供,饲养于山西医科大学第一医院呼吸科实验室。实验室许可证号:SYXK(晋)2009-0004;动物批号:SCXK(晋)2009-0001。动物分笼饲养,自由饮水,湿度(50±5)%,室温(23±2)℃。
1.2 间歇低氧大鼠模型制备 间歇低氧舱制备:体积65 cm×45 cm×50 cm,厚5 mm的透明有机密封玻璃箱,舱盖密封,舱两侧各有2个出气孔以保持舱内气压恒定。由尼龙抗压力管连接氧气钢瓶、氮气钢瓶、单向电磁阀门(该控制系统由单片机编制程序控制)及进气口。控制系统程序设定:先输氮气45 s,使舱内氧浓度由21%逐渐降至最低氧浓度7%,持续10 s后再通氧气45 s,使舱内浓度逐渐恢复至21%后再持续10 s,每个循环110 s。舱内氧浓度由间歇低氧仪控制,同时由便携式测氧仪实时监控,由生石灰吸收舱内水分及CO2。暴露方案:将IH4组与IH8组大鼠每日上午9:00至下午5:00(共8 h)暴露于间歇低氧舱内;NC组大鼠给予间歇压缩空气,其余条件同实验组。
1.3 标本采集 于第4、8周间歇低氧暴露结束后将3组大鼠称重、腹腔注射10%水合氯醛麻醉、固定、暴露腹主动脉、采血、静置、高速离心,取上清液于-80℃超低温冰箱保存以备检测血清胰岛素。取部分肝组织浸泡于4%中性甲醛溶液,48 h后石蜡包埋、切片、染色。
1.4 指标检测
1.4.1 生理生化指标 间歇低氧暴露结束后测定3组大鼠空腹血糖、空腹胰岛素(FINS)。取大鼠微量尾尖血滴于美国强生公司AW06336402B血糖仪配套试纸上,读取血糖值。采用125I胰岛素放射免疫分析药盒、全自动放射免疫分析仪检测血清胰岛素水平。计算稳态模型评估-胰岛素抵抗指数(HOMA-IR)=(空腹血糖×FINS)/22.5,计算稳态模型评估-胰岛素敏感指数(HOMA-IS)=1/(空腹血糖×FINS)。
1.4.2 免疫组化法测定大鼠肝脏GSK-3、mTOR的表达 采用石蜡包埋切片,常规脱蜡,兔抗鼠GSK-3一抗稀释度为1∶100,兔抗鼠mTOR一抗稀释度为1∶150,加入一抗后4℃过夜,孵育;生物素标记二抗,DAB显色,封片,Olympus显微镜下观察切片。用PBS代替一抗阴性对照,用已知阳性片作阳性对照,阳性染色为棕黄色。在光镜下(400×)对免疫组化切片采图,采用Image-ProPlus图像分析系统进行灰度定量分析。
1.5 统计学处理 检测结果用SPSS17.0统计软件分析,正态分布计量资料以±s表示,多组间均数比较用单因素方差分析,组间两两比较用最小显著性差(LSD)法,两变量间的相关分析用Pearson线性相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠空腹血糖、FINS、HOMA-IS、HOMAIR的结果 与NC组相比,IH4组、IH8组的空腹血糖、FINS及HOMA-IR升高、ISI降低,差异有统计学意义(P均<0.01),以IH8组更为显著(P<0.01),见表1。
表1 各组空腹血糖、FINS、HOMA-IS、HOMA-IR结果比较(±s)
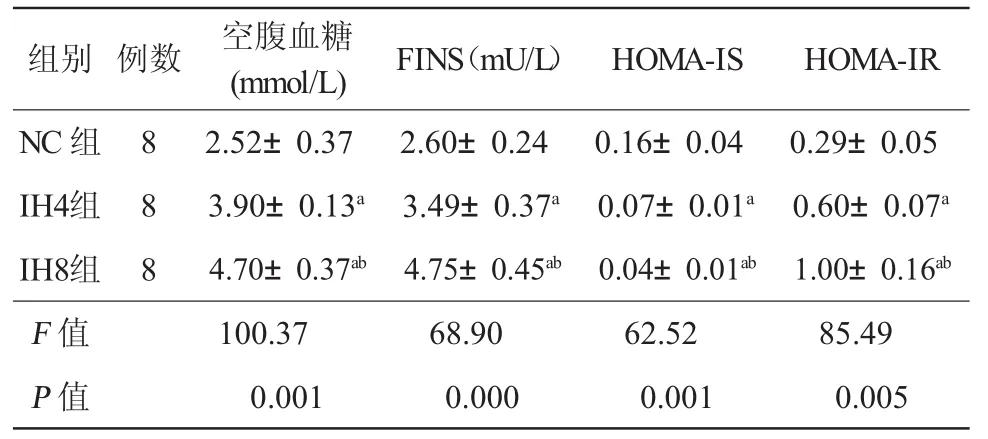
表1 各组空腹血糖、FINS、HOMA-IS、HOMA-IR结果比较(±s)
注:与 NC组相比,aP<0.01;与 IH4 组相比,bP<0.01;FINS:空腹胰岛素;HOMA-IS:稳态模型评估-胰岛素敏感指数;HOMA-IR:稳态模型评估-胰岛素抵抗指数;NC组:间歇空气组;IH4组:间歇低氧4周组;IH8组:间歇低氧8周组
?
2.2 各组大鼠GSK-3、mTOR蛋白的表达 GSK-3蛋白主要在大鼠肝细胞核内表达,核内呈棕黄色,而细胞质中也有少量散在分布的棕黄色颗粒表达;mTOR蛋白主要在大鼠肝细胞胞质中表达,胞质内棕黄色颗粒呈散在分布,细胞核内几乎没有表达。图像定量分析显示:与NC组相比,IH4组和IH8组肝细胞中GSK-3蛋白、mTOR平均灰度值降低,蛋白表达水平升高,差异均有显著性(P均<0.01),与IH8组相比,IH4组表达亦升高,差异有统计学意义(P<0.01),见图1(封 3),表2。
表2 各组GSK-3及mTOR蛋白平均灰度值比较(±s)
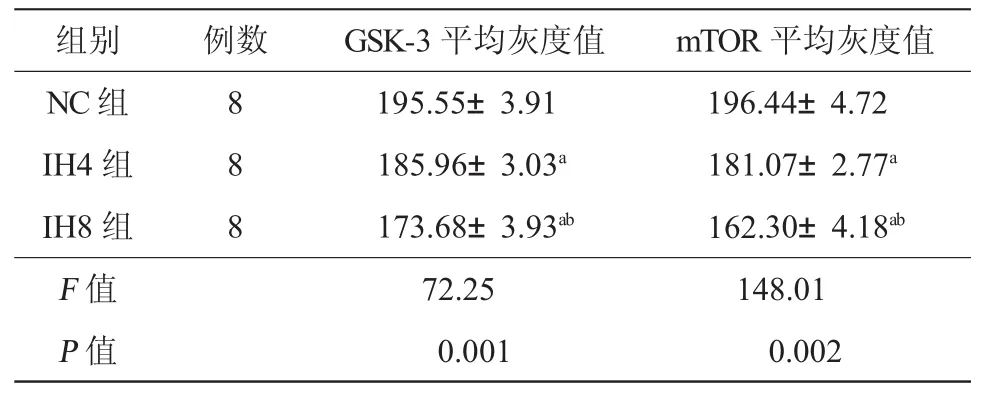
表2 各组GSK-3及mTOR蛋白平均灰度值比较(±s)
注:与 NC组相比,aP<0.01;与 IH4 组相比,bP<0.01;GSK-3:糖原合成酶激酶-3;mTOR:哺乳动物雷帕霉素靶蛋白;NC组:间歇空气组;IH4组:间歇低氧4周组;IH8组:间歇低氧8周组
?
2.3 HOMA-IS、HOMA-IR与 GSK-3及mTOR相关性分析 GSK-3、mTOR平均灰度值与HOMA-IS呈正相关(r=0.786,0.811,P均<0.01),与HOMA-IR 呈负相关(r=-0.882,-0.889,P均<0.01)。
3 讨论
OSAHS与糖尿病及IR联系紧密,两者无论是在流行病学、发病机制还是临床方面均相关[3]。OSAHS患者存在IR,并随OSAHS病情的加重更加明显,另外,IR者OSAHS高发[4]。OSAHS反复出现的呼吸暂停和低通气可致一种特殊的缺氧状态,即低氧/复氧交替、低氧程度重、血氧变化大、机体难适应、发生频率高等特点的间歇低氧。与持续低氧明显不同的是间歇低氧存在低氧后复氧,复氧时产生大量的活性氧簇,引发细胞、分子损伤,临床表现为全身多系统损害,包括IR或糖尿病,但目前具体机制未明,其中包括影响胰岛素信号转导通路中多种蛋白激酶或磷酸酶活性,阻断胰岛素信号转导。Chen等[5]将雄性Sprague-Dawley大鼠分为正常对照组、间歇低氧组和持续低氧组,给予相应干预40 d,用正常血糖高胰岛素钳夹技术检测胰岛素敏感性,结果显示与其他两组相比,间歇低氧组大鼠的外周血胰岛素水平较高,而葡萄糖注射速率明显降低。Polak等[6]将C57BL/6J小鼠分为正常对照组、间歇低氧组、间歇低氧-复氧组,结果显示间歇低氧组空腹血糖、FINS水平及糖耐量高于正常对照组,间歇低氧降低了胰岛素敏感性,损伤了β细胞功能,升高了肝糖原含量及肝糖输出量。本实验发现间歇低氧暴露后实验组HOMA-IS降低,空腹血糖、FINS、HOMA-IR升高,以IH8组更显著,差异均有统计学意义,说明间歇低氧可致大鼠IR,且IR程度随暴露时间延长而加重,这与上述实验结论相符。
IR是糖尿病的始发因素,而肝IR是机体IR的核心,因为肝脏是物质代谢中心,是葡萄糖代谢及胰岛素作用的主要器官,也是人体胰岛素受体最密集的脏器之一,对胰岛素极为敏感。对小鼠而言,肝脏中的糖代谢对IR起更重要的作用[7]。IR本质即胰岛素信号转导缺陷,且以受体后的信号抑制最常见。PI3K/Akt通路是胰岛素受体后信号转导的主要途径,该通路信号转导的减弱或中断是发生IR的主因。GSK-3及mTOR均是该通路下游的效应蛋白,可负反馈调节该通路,参与了IR的发生、发展。
GSK-3分为GSK-3α和GSK-3β两种亚型,其磷酸化水平影响自身活性,该激酶磷酸化后失活,去磷酸化后有活性,是调节糖原合成的关键酶。在胰岛素信号通路中,胰岛素信号磷酸化GSK-3,使之失活,引起糖原合成酶去磷酸化,降低血糖。发生IR时,GSK-3活性显著升高,再磷酸化肝糖原合成酶使之失活,抑制糖原合成及葡萄糖转运,升高血糖。MacAulay等[8]将禁食葡萄糖的小鼠GSK-3α基因敲除后,肝糖原合成增多,肝脏胰岛素受体底物(IRS)-1表达显著增加,胰岛素靶组织的葡萄糖耐受性和胰岛素敏感性增强。Greene等[9]发现GSK-3β通过提高IRS-1、IRS-2的丝/苏氨酸磷酸化水平抑制胰岛素受体对IRS-1、IRS-2的酪氨酸磷酸化,从而阻断胰岛素信号转导,引起IR。这些研究均支持GSK-3为PI3K/Akt通路及糖原合成酶的负反馈调节因子。本实验显示,IH4组及IH8组大鼠肝细胞GSK-3蛋白表达比NC组明显增加,且IH8组更为显著,表明间歇低氧条件下GSK-3在大鼠肝细胞中表达升高,暴露时间延长后表达更明显。相关性分析显示GSK-3蛋白平均灰度值与HOMA-IS呈正相关、与HOMA-IR呈负相关,说明间歇低氧使GSK-3蛋白表达增加、发生IR,且随暴露时间延长IR程度加重。
mTOR由mTORC1和mTORC2组成,前者位于Akt下游,能被磷酸化的Akt激活;而后者作为一种蛋白激酶-2,将Akt完全活化[10]。胰岛素与其受体结合后启动IRS-1酪氨酸磷酸化,激活PI3K引起PKB/Akt磷酸化,再激活mTOR并磷酸化其下游底物,从而影响细胞的生长与代谢[11-12]。mTOR及其下游底物核糖体蛋白S6激酶1高度活化后可增加IRS-1的636和639位丝氨酸残基磷酸化及IRS-1降解和转录抑制,负反馈阻断PI3K通路,引起IR[13]。发生IR时,高度活化的mTORC1反馈抑制PI3K通路[14]。最新研究表明通过负性调节mTORC1,可以抑制IRS-1、阻断PI3K信号通路导致IR,且低氧条件下mTOR表达会增强[15]。本实验发现与NC组相比,间歇低氧环境下的IH4组、IH8组mTOR蛋白在大鼠肝细胞胞质中的表达逐渐增加,以IH8组增加明显。同时发现mTOR蛋白平均灰度值与HOMA-IS呈正相关、与HOMA-IR呈负相关,同样也说明间歇低氧使增强mTOR的表达并导致IR发生,且间歇低氧时间延长后IR程度加重。
综上所述,间歇低氧通过各种可能的机制产生IR已得到共识,而PI3K/Akt途径作为胰岛素主要信号转导通路在间歇低氧导致的IR中也发挥重要作用,此途径中的两个负向调节因子GSK-3、mTOR升高均可引发IR,两者在OSAHS合并2型糖尿病发生、发展中发挥重要作用,抑制其活性有望成为治疗OSAHS合并2型糖尿病的新靶点。
本文图1见封3。
[1]Reichmuth KJ,Austin D,Skatrud JB,et al.Association of sleep apnea and type Ⅱ diabetes:a population-based study[J].Am J Respir Crit Care Med,2005,172(12):1590-1595.
[2]孙庆磊,高宏凯,张新国.肝细胞胰岛素信号传导通路与胰岛素抵抗[J].中国实用医药,2007,2(33):182-184.
[3]何权瀛.睡眠呼吸暂停与世界人口全因死亡率前10位疾病的关系[J].中国呼吸与危重监护杂志,2014,13(3):225-228.
[4]Tan BK,Heutling D,Chen J,et al.Metformin decreases the adipokine vaspin in overweight women with polycystic ovary syndrome concomitant with improvement in insulin sensitivity and a decrease in insulin resistance[J].Diabetes,2008,57(6):1501-1507.
[5]Chen L,Cao ZL,Han F,et al.Chronic intermittent hypoxia from pedo-stage decreases glucose transporter 4 expression in adipose tissue and causes insulin resistance[J].Chin Med J,2010,123(4):463-470.
[6]Polak J,Shimoda LA,Drager LF,et al.Intermittent hypoxia impairs glucose homeostasis in C57BL6/J mice:partial improvement with cessation of the exposure[J].Sleep,2013,36(10):1483-1490.
[7]Bunner AE,Chandrasekera PC,Barnard ND.Knockout mouse models of insulin signaling:relevance past and future[J].World J diabetes,2014,5(2):146-159.
[8]MacAulay K,Dobel BW,Patel S,et al.Glycogen synthase kinase 3alpha-specific regulation of murine hepatic glycogen metabolism[J].Cell Metab,2007,6(4):329-337.
[9]Greene MW,Garofalo RS.Positive and negative regulatory role of insulin receptor substrate 1 and 2 (IRS-1 and IRS-2)serine/threonine phosphorylation[J].Biochemistry,2002,41(22):7082-7091.
[10]Sudarsanam S,Johnson DE.Functional consequences of mTOR inhibition[J].Curr Opin Drug Discov Devel,2010,13(1):31-40.
[11]Soliman GA.The integral role of mTOR in lipid metabolism[J].Cell Cycle,2011,10(6):861-862.
[12]Zoncu R,Efeyan A,Sabatini DM.mTOR:from growth signal integration to cancer,diabetes and ageing[J].Nat Rev Mol Cell Biol,2011,12(1):21-35.
[13]Stadlbauer K,Brunmair B,Szöcs Z,et al.The effects of amino acids on glucose metabolism of isolated rat skeletal muscle are independent of insulin and the mTOR/S6K pathway[J].Am J Physiol Endocrinol Metab,2009,297(3):E785-E792.
[14]Robinson KA,Buse MG.Mechanisms of high-glucose/insulinmediated desensitization of acute insulin-stimulated glucose transport and Akt activation[J].Am J Physiol Endocrinol Metab,2008,294(5):870-881.
[15]Johnson SC,Rabinovitch PS,Kaeberlein M.mTOR is a key modulator of ageing and age-related disease[J].Nature,2013,493(7432):338-345.
Effects of intermittent hypoxia on the expression of GSK-3 and mTOR in rat liver
Ren Guomei,Ren Shouan.Department of Respiration,The First Affiliated Hospital of Shanxi Medical University,Taiyuan 030001,China
Ren Shouan,Email:renshouan@163.com
ObjectiveTo determine the expression of glycogen synthase kinase-3(GSK-3)and mammalian target of rapamycin(mTOR)in the liver of rats exposed to intermittent hypoxic,and to observe the effects of intermittent hypoxia on the insulin signaling pathway.MethodsTwenty four healthy male Sprague-Dawley rats were randomly divided into 3 groups according to the random number table:intermittent air group(NC group),4 weeks of intermittent hypoxia group(IH4 group)and 8 weeks of intermittent hypoxia group(IH8 group),with 8 rats in each group.Each day from 9:00 am to 5:00 pm,rats in NC group were housed in intermittent air cabin,while rats in IH4 group and IH8 group were housed in intermittent lowoxygen cabin.Fasting blood glucose and fasting insulin(FINS)were tested.Homeostasis model assessment ofinsulin sensitive index(HOMA-IS)and homeostasis model assessment of insulin resistance index(HOMA-IR)were used to evaluate insulin resistance.The expression of hepatic GSK-3 and mTOR were determined by immunohistochemical method and the amount of protein expression was evaluated by average gray value.ResultsCompared with NC group,HOMA-IS was reduced and fasting blood glucose,FINS,HOMA-IR were elevated in IH4 group and IH8 group,butwasmoreapparentin IH8 group(Fvalueswere 62.52,100.375,68.90,85.49,allP<0.01).Compared with NC group,the expression of GSK-3 and mTOR protein were increased in IH4 group and IH8 group,especiallyin IH8 group(Fvalues were 72.25,148.01,allP<0.01).Pearson correlation analysis showed that the average gray values of GSK-3 and mTOR were positively correlated to HOMA-IS (r=0.786,0.811,allP<0.01),and negatively correlated with HOMA-IR(r=-0.882,-0.889,allP<0.01).ConclusionsIntermittent hypoxia increases the expression of GSK-3 and mTOR in the liver of rats,thus induces insulin resistance.
Intermittent hypoxia;Insulin resistance;Glycogen synthase kinase-3;Mammalian target ofrapamycin
(Int J Endocrinol Metab,2015,35:77-80)
10.3760/cma.j.issn.1673-4157.2015.02.002
山西科技研究基金资助项目(2013011048-4)
030001 太原,山西医科大学第一医院呼吸科
任寿安,Email:renshouan@163.com
2014-12-08)

