光聚合仿贻贝生物粘合剂的制备和性能研究
艾宇飞,杨冬芝,聂 俊
(北京化工大学材料科学与工程学院,北京 100029)
光聚合仿贻贝生物粘合剂的制备和性能研究
艾宇飞,杨冬芝,聂 俊
(北京化工大学材料科学与工程学院,北京 100029)
以聚乙二醇为高分子骨架,分别通过酰氯化反应和迈克尔加成反应,将丙烯酸酯基团和多巴胺基团接到聚乙二醇端基,使得聚乙二醇丙烯酸酯-多巴胺体系既具有光聚合性能,又具有良好的粘接性能,以及优异的生物相容性。利用FT-IR、1H-NMR对其结构进行了表征。得到的聚乙二醇-多巴胺体系(PEG-Dopas)具有较好的粘接强度,放置24 h后其粘接强度会从0.90 MPa增加到1.62 MPa。PEG-Dopas的细胞贴附性好,对细胞的生物毒性较小。
光聚合;多巴胺;生物粘合剂
1 前言
每年全球有数百万人由于外伤或手术形成创伤而需要治疗,这些创伤处主要包括皮肤、肌肉、结缔组织、内脏器官等。缝合是最常见的处理方法,虽然可以提供很好的拉伸强度,以及相对较低的事故率等,但缺点是过程繁琐,在缝合处易形成应力集中,体内残留时间过长时会造成肉芽肿瘤,形成血栓而导致缝合失败,易留疤痕以及拆线会带来二次痛苦等[1,2]。随着科学技术的进步,现代医学理念的更新,以及医疗市场的需求,缝合技术已无法满足当代临床医学的要求,因此近几十年来,国内外的科研人员不断致力于研发各种类型的生物粘合剂来取代缝合技术。生物粘合剂,是一类具有特殊功能性的粘合剂,当其用于生物医学领域时,既具有一般粘合剂的粘接功能,又有满足生物医学要求的各种性能。目前生物粘合剂种类繁多,已达几十种,按照使用的用途主要可分为硬组织粘接类粘合剂[3], 软组织类粘接剂[4],牙科类粘接剂[5]以 及皮肤用压敏胶[6]等。由于现存的医用类生物粘合剂在机体的使用过程中或多或少都存在一定的缺点和问题,因此人们开始将目光投向生物的粘附行为,以期通过仿生方法来寻找和研发一种新型的生物粘合剂。
贻贝隶属于软体动物门(Mollusca)瓣鳃纲(Bivalvia)贻贝科(Mytilidae),普遍存在于地球上的海洋以及沿岸地区,特别是在冷水海域中的甲壳类动物。尽管它们赖以生存的环境十分潮湿,甚至要历经波浪和潮汐的反复冲刷,但它们利用自身分泌的一种具有超强粘附性能的粘附蛋白质,仍然可以紧紧地粘接在各种基质材料表面[7~10]。贻贝具有的这种惊人的防水粘附能力、超快的固化速度以及优异的粘附多样性,是目前任何一种化学合成粘合剂所不具备的。经研究发现,贻贝粘附蛋白(MAPs)中含有的3,4-二羟基苯丙氨酸(多巴,DOPA)是贻贝具有超强粘接性的至关重要因素[11~13]。现在制备及模拟贻贝粘附蛋白的主要研究方法包括:(1)天然贻贝粘附蛋白的直接提取;(2)使用DNA基因重组技术来制备贻贝粘附蛋白;(3)合成高分子的仿生。由于前2种方法工艺繁琐、成本较高、产率较低,因此目前合成高分子的仿生法是研究的重点和热点[14~16]。
本文采用三臂聚乙二醇(PEG)作为分子链骨架,先通过酰氯化反应,将可光聚合的丙烯酸酯基团(CH2=CH-COO-)接枝到三臂聚乙二醇分子链端基上,得到了可光交联的聚乙二醇丙烯酸酯(PEGTA),然后又利用迈克尔加成反应将带有粘接功能的多巴胺功能团(Dopamine)连接到三臂聚乙二醇上,得到聚乙二醇-多巴胺(PEG-Dopas),并可利用光聚合技术进行交联聚合。使得到的聚乙二醇-多巴胺既具有良好的生物相容性,又具有光固化性能,还带有耐湿粘接性,有望作为一种生物粘合剂使用。
2 实验部分
2.1 主要原料
盐酸多巴胺,上海阿拉丁试剂公司;三臂聚乙二醇(Mw1500),美国Neocrin公司;丙烯酰氯,上海阿拉丁试剂公司;三乙胺,分析纯,北京化学试剂公司;中性氧化铝,100-200目,国药集团化学试剂有限公司;光引发剂D-2959,分析纯美国Ciba-Geigy化学公司;DMEM细胞培养基,Sigma-Aldrich公司;小鼠成纤维细胞(L929),北京大学医学部病原生物系;磷酸盐缓冲溶液(PBS,pH 7.4),北京索莱宝科技有限公司;各种有机溶剂,化学纯,北京化学试剂公司。
2.2 合成三臂聚乙二醇丙烯酸酯(PEG-TA)
将15 g三臂聚乙二醇与300 mL甲苯加入四口烧瓶,使用Dean-Stark分离器进行共沸蒸馏1 h。然后通氮气30 min,将液体冷却至室温后,将100 mL的二氯甲烷和6.3 mL的三乙胺加入上述混合液,并且继续在氮气保护下进行搅拌。在冰浴条件下,逐滴滴加3.6 mL的丙烯酰氯。整个体系在黑暗条件下过夜反应。反应结束后,得到的浅黄色液体使用中性氧化铝进行过滤。并使用大量的二氯甲烷进行洗涤。然后将碳酸氢钠加入甲苯-二氯甲烷的混合液,并且搅拌1 h。除掉碳酸氢钠,使用旋转蒸发仪除去大量的溶剂。接着加入冰浴条件下的乙醚中进行重结晶,然后过滤得到聚乙二醇丙烯酸酯固体。将聚乙二醇丙烯酸酯固体使用乙醚进行洗涤后,真空干燥。得到白色的聚乙二醇丙烯酸酯固体。产率约为80%。合成过程见图1。1H-NMR( CDCl3,δ):δ=3.65(s,PEG主 链 -CH2-CH2-氢 ) , δ=4.3 0~4.3 3(t,-C H2-O-C OCH=CH2),δ=5.83~5.85(dd,CH2=CH-COO-), δ=6.13~6.18,δ=6.41~6.45(dd,CH2=CHCOO-)。根据核磁计算出反应的C=C双键取代度高达95%。
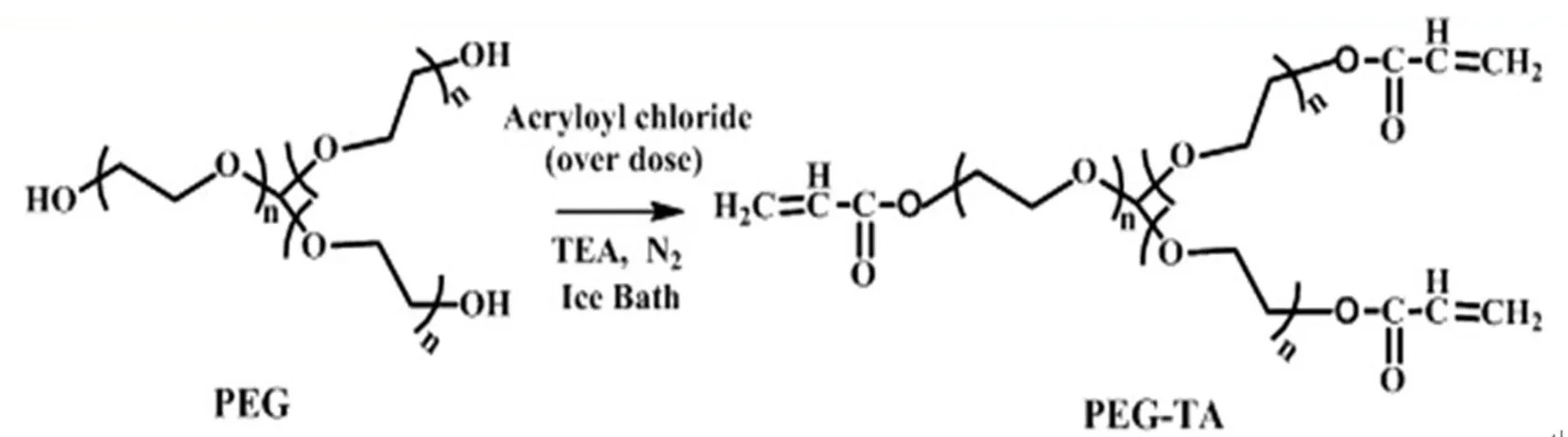
图1 合成聚乙二醇丙烯酸酯Fig.1 Synthesis of PEG-TA
2.3 合成三臂聚乙二醇-多巴胺(PEG-Dopas)
将称量好的PEG-TA用N,N-二甲基甲酰胺(DMF)和二氯甲烷的共溶剂溶解,加入配有机械搅拌、冷凝回流以及温度计的四口烧瓶中,在搅拌情况下通氮气30 min,然后加入三乙胺。接着继续在氮气保护的情况下加入盐酸多巴胺,然后升温至规定温度后恒温反应一定的时间。反应结束后,利用旋转蒸发除去二氯甲烷溶剂,将混合液倒入冰浴条件下的乙醚溶液中,产生白色固体。过滤后白色固体继续使用乙醚进行洗涤,然后置于真空干燥箱干燥。产率为30%左右。合成过程见图2。1H-NMR(DMSO,δ) : δ=3.63( s,PEG主 链 -CH2-CH2-) ,δ=4.21~4.24( t,CH2=CHCOO-CH2-) ,δ=5.9 4~5.9 7( d d,C H2=C H C O O-) ,δ=6.17~6.24,δ=6.37~6.32(dd,CH2=CHCOO-),δ=6.4 1~6.4 8,δ=6.4 9~6.6 3,δ=6.67~6.69(多巴胺中苯环上的H)。通过计算苯环上氢位移峰的面积与C=C双键上氢位移峰的面积,可得到多巴胺的取代度为32%。

图2 合成聚乙二醇丙烯酸酯-多巴胺Fig.2 Synthesis of PEG-Dopas
2.4 光交联制备PEG-TA和PEG-Dopas凝胶
以PEG-TA为例,将40%的PEG-TA和1%(相对于PEG-TA)的光引发剂D-2959一起加入水溶液,摇晃均匀。然后将溶液注入由玻璃和橡胶垫片构成的模具中。注意整个过程避免紫外光的照射。然后将模具置于紫外固化箱(EXFO lite,加拿大EFOS公司)中固化。将得到的凝胶片在真空箱干燥,为后续测试备用。PEG-Dopas凝胶的制备方法与PEG-TA的过程一样。
2.5 傅立叶变换红外光谱(FT-IR)分析
Nicolet 5700实时傅立叶变换红外光谱仪(美国Thermo公司)。样品溶于溶剂后在KBr盐片上点样涂膜,扫描范围为4 000~650 cm-1, 分辨率4 cm-1。
2.6 核磁共振(1H-NMR)分析
使用Bruker AV400(德国Bruker 公司)核磁共振仪测试,室温,CDCl3,氘代二甲基亚砜(DMSO)为溶剂,TMS 为内标。
2.7 实时红外(RT-IR)分析
在Nicolet 5700实时傅立叶变换红外光谱仪上配备(HTA)附件,通过实时红外(RT-IR)来监测聚乙二醇丙烯酸酯体系的光聚合动力学过程。可以通过计算C=C双键位于近红外区6 100~6 250 cm-1内吸收峰面积的实时变化来得到双键转化率(Double bond conversion)。
2.8 粘接强度的测试
首先将20%的明胶涂敷在玻璃的表面并形成一层明胶膜,以此来模拟人体组织。接着用溶有40%的样品和1%(相对于样品)的光引发剂D-2959的水溶液涂覆在明胶涂层表面,并采用搭接的方式将2片玻璃固定,搭接面积约为15 mm ×20 mm,然后置于固化箱固化,制得拉伸实验所需样片。固化后在37 ℃环境中恒温放置不同的时间,然后用Model 1185型万能力学测试机(美国Instron公司)在室温下进行剪切测试。拉伸速度5 mm/min。
2.9 细胞贴附实验
凝胶片浸泡在磷酸盐缓冲溶液中,然后高压蒸汽环境下消毒15 min。置于带有DMEM培养基的24孔板中,置于恒温培养箱于37 ℃条件下培养48 h。然后移除凝胶片,将得到的浸渍液采用微孔过滤器除去杂质和细菌。此外,在环境为5%CO2,37 ℃和饱和湿度的CO2培养箱中培养L-929细胞。每48 h换1次培养液。当L-929细胞生长汇合率为70%~80%时,对细胞进行胰蛋白酶降解操作、离心收集,并加入新的DMEM,配置成细胞悬液。接种到培养板内样片的表面。在37 ℃的CO2培养箱中培养48 h。除去未贴附的细胞。用hoechst 33,258溶液染色。然后继续使用磷酸盐缓冲溶液清洗2次后,使用Olympus BX41型荧光显微镜(日本Olympus公司)观察染色的样品。
2.10 细胞毒性实验(MTT实验)
根据医疗器械生物学评价标准(GBT 16886.5—2003)来进行相对毒性的测试。凝胶片先浸泡在PBS中,然后在高压蒸汽环境下消毒15 min。置于带有DMEM培养基的24孔板中,置于恒温培养箱于37 ℃培养48 h。然后移除凝胶片,将得到的浸渍液采用微孔过滤器除去杂质和细菌。
此外,在环境为5%CO2,37 ℃和饱和湿度的CO2培养箱中培养L-929细胞。每48 h换1次培养液。当L-929细胞生长汇合率为70%~80%时,对细胞进行胰蛋白酶降解操作、离心收集,并加入新的DMEM,配置成细胞悬液。
将处于对数期的L-929细胞接种在96孔细胞培养板中(接种密度8 ×103cells/well)。每组取用的细胞悬浮液均分为6份。继续培育24 h后,移除培养基,然后在实验组中加入预先得到样品提取液,阴性对照组加入新鲜的DMEM,分别再培育24、48、72 h。然后,每孔加入20 μL的带有0.5% MTT原液(5 mg/mL)的PBS。37 ℃继续再培养细胞4 h,以便细胞和MTT试剂可以充分反应。等培养结束,仔细地移除含有未反应的MTT试剂的培养基。加入DMSO,溶液避光震荡10 min,等结晶物溶解完全后,使用酶标仪测量溶解后的甲瓒晶体紫外光吸收率(OD值)。
2.11 统计学分析
将MTT实验得到的数据表达为平均值±标准偏差。利用统计学中ANOVA单边方差的方法对数值进行计算,判断其与阴性对照组有无显著性差异。当P >0.05时可以认为没有统计学意义上的显著性差异(n-6)。
3 结果与讨论
3.1 FT-IR分析
图3(a)所示的是PEG-TA的红外分析图。2 872 cm-1处的吸收峰归属于PEG主链上亚甲基的-C-H不对称伸缩振动,1 109 cm-1处为醚键-C-O-C-的反对称伸缩振动峰,1 723 cm-1处的峰为丙烯酸酯基团上羰基C=O的特征吸收峰,809 cm-1处的吸收峰归属于丙烯酸酯基团上C=C双键的红外吸收峰。图3(b)为PEG-Dopas的红外吸收谱图。在3 422 cm-1出现了新的吸收宽锋,归属于多巴胺中-N-H的伸缩振动峰,而在1 723 cm-1和 811 cm-1处仍然具有丙烯酸酯基团上羰基C=O,C=C双键的红外特征峰,证明产物PEG-Dopas中既含有可光聚合的丙烯酸酯基团,又带有可粘接的多巴胺基团。
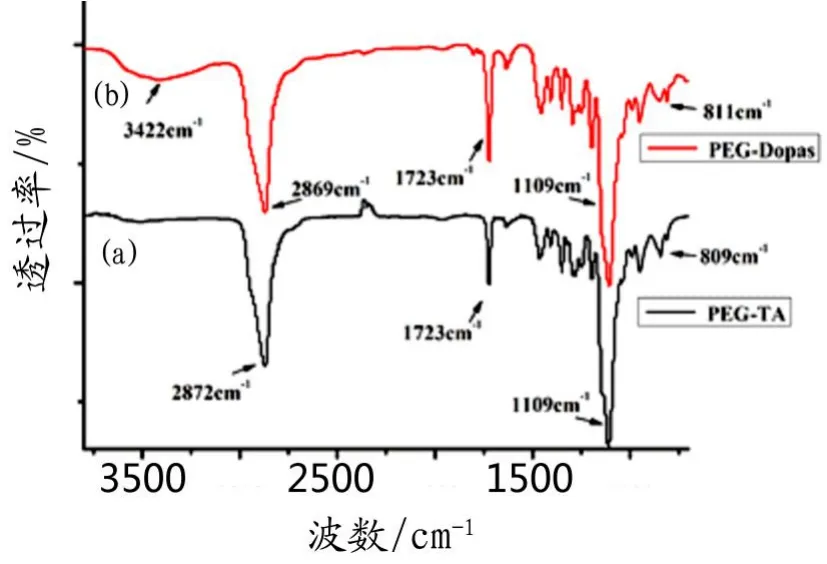
图3 PEG-TA和PEG-Dopas的红外谱图Fig.3 FT-IR spectra of PEG-TA and PEG-Dopas(a.聚乙二醇丙烯酸酯;b.聚乙二醇丙烯酸酯-多巴胺)
3.2 RT-IR分析
当光强为30 mW/cm2,光引发剂为D-2959(浓度为1%)时,PEG-TA和PEG-Dopas的实时红外动力学如图4所示。PEG-TA的双键转化速率以及最终转化率要远远快于PEG-Dopas,10 min时,PEG-TA的双键转化率高达90%左右,而PEG-Dopas仅有55%。分析主要有2个原因引起这种现象,一是由于多巴胺上的酚羟基会与体系中的活性自由基结合,生成活性更低的自由基或者引起自由基的猝灭,起到缓聚或阻聚作用;二可能是酚羟基氧化形成邻醌结构后会使溶液颜色变深,影响了紫外光的透过,从而造成了转化率较低。

图4 PEG-TA和PEG-Dopas体系的光聚合动力学Fig.4 Photocrosslinking kinetics of PEG-TA and PEG-Dopas
3.3 粘接强度
在PEG-Dopas的粘接测试中(图5)可以看出,随着存储时间增加到24 h,PEG-Dopas的粘接强度也从最开始的0.90 MPa增长到了1.62 MPa。这一现象是因为PEG-Dopas与明胶基质的相互粘接是由于处于界面处的多巴胺与明胶分子相互扩散所致,即粘接的强度与这2种材料接触时间的长短有关。当有溶剂存在时,聚乙二醇的多巴胺端基会与明胶发生扩散现象,随着溶剂的挥发,多巴胺就会被固定在明胶基材内,从而形成了较强的粘接力。得到的PEG-Dopas的粘接强度要优于已经商业化的纤维蛋白胶(0.05 MPa)[17]。

图5 不同时间点PEG-Dopas的粘接强度Fig.5 Adhesion strength of PEG-Dopas at different time
3.4 细胞贴附
图6是经过48 h培养后,L-929细胞在PEGDopas凝胶表面的细胞形貌和贴附的荧光照片。可以看出,L-929细胞在材料的表面的铺展状况良好,且细胞活性高。这说明PEG-Dopas凝胶的细胞贴附性好,有利于L-929细胞的生长和繁殖。

图6 PEG-Dopas凝胶表面贴附L-929细胞的荧光照片Fig.6 Fluorescence microscope images of L-929 cells seeded on PEG-Dopas gels
3.5 细胞毒性
理想的生物粘合材料在其使用的过程中,不应该释放出有毒的物质,或者引起有害的副反应。因此,可以使用体外细胞毒性测试的方法来对其的细胞毒性进行评估。图7(a)显示了PEG-Dopas凝胶在酶联免疫检测仪上测定的紫外吸光值(OD,490 nm),图7(b)显示的是相对应的细胞相对增值率。由图可以发现,经过48 h培养,PEG-Dopas凝胶提取液所培养的L-929细胞的活性值和阴性对照组相比,没有统计学意义上的显著性差异(P >0.05)。尽管2 472 h的细胞活性值低于阴性对照组,且表现出了统计学意义的显著性差异(P< 0.05)。但是这些活性值仍然超过阴性对照值的85%以上。实验结果表明PEG-Dopas凝胶对L-929细胞毒性较低。

图7 PEG-Dopas凝胶的MTT测试Fig.7 MTT tests of PEG-Dopas gels(a.PEG-Dopas与阴性对照组和阳性对照组的OD值;b.细胞的相对增值率)
4 结论
(1)以三臂聚乙二醇为高分子骨架,分别通过酰氯化反应和迈克尔加成反应,将丙烯酸酯基团和多巴胺基团接到聚乙二醇端基,利用FT-IR、1H-NMR对其结构进行了表征,说明合成了目标产物。
(2)得到的PEG-Dopas具有较好的粘接强度,要优于商业化的纤维蛋白胶。
(3)PEG-Dopas的细胞贴附性好,对细胞的生物毒性较小。
[1]Cope C,Lee K,Stern H,et al.Use of the vascular closure staple clip applier for microvascular anastomosis in freef lap surgery[J].P lasti c a nd Reconstruc ti ve Surgery,2000,106(1):107-110.
[2] Turan T,Ozç elik D,Kuran I,et al.Eversion with four sutures:an easy,fast and reliable technique for microvascular anastomosis[J].Plastic and Reconstructive Surgery,2001,107:463– 470.
[3]Kandalam U,Bouvier A J,Casas S B,et al.Novel bone adhesives:a comparison of bond strengths in vitro[J].International Journal of Oral and Maxillofacial Surgery,2013,42(9):1054– 1059.
[4]Krishnamoorthy B,Najam O,Khan UA,et al.Randomized prospective study comparing conventional subcuticular skin closure with dermabond skin glue after saphenous veinharvesting[J].Ann Thorac Surg,2009,88(5):1445-1149.
[5]Imazato S,Ma S,Chen J H,Xu H H K.Therapeutic polymers for dental adhesives:Loading resins with bioactive components[J].Dental Materials,2014,30(1):97-104.
[6]Czech Z,Wesolowska M.Development of solvent-free acrylic pressure-sensitive adhesives[J].European Polymer Journal,2007,43(8):3604-3612.
[7]Waite J H.Nature's underwater adhesive specialist[J],International Journal of Adhesion and Adhesives,1987,7(1):9-14.
[8]Qin Z,Buehler M J,Impact tolerance in mussel thread n e t w o r k s b y h e t e r o g e n e o u s m a t e r i a l distribution[J].Nat.Commun.,2013,4:2187.
[9]Lee H,Dellatore S M,Miller W M,Messersmith P B.Mussel-inspired surface chemistry for multifunctional coatings[J],Science,2007,318:426-430.
[10]Qin Z,Buehler M J,Impact tolerance in mussel thread n e t w o r k s b y h e t e r o g e n e o u s m a t e r i a l distribution[J].Nat.Commun.,2013,4:2187.
[11]Waite J H,Tanzer M L.Polyphenolic substance of mytilus edulis:Novel adhesivecontaining L-Dopa and hydroxyproline[J],Science,1981,212:1038-1040.
[12]Yu J,Wei W,Danner E,et al.Mussel protein adhesion depends on inter protein thiol-mediated redox modulation[J].Nature Chem.Biol.,2011,7:588-590.
[13]Samyn P,Rü he J,Biesalski M.Polymerizable Biomimetic Vesicles with Controlled Local Presentation o f A d h e s i v e F u n c t i o n a l D O P A Groups[J].Langmuir,2010,26(11):8573-8581.
[14]Shao H,Stewart R J,Biomimetic underwater adhesives with environmentally triggered setting mechanisms[J].Advanced Materials,2010,22(6):729-733.
[15]Zhang H,Bré L P,Zhao T,et al.Mussel-inspired hyperbranched poly(amino ester) polymer as strong wet tissue adhesive[J].Biomaterials,2014,35(2):711-719.
[16]Ryu J H,Lee Y,Kong W H,et al.Catecholfunctionalized chitosan/pluronic hydrogels for tissue a d h e s i v e s a n d h e m o s t a t i c m a t e r i a l s[J].Biomacromolecules,2011,12(7):2653-2659.
[17]Alston S M,Solem K A,Broderick A H,et al.New method to prepare autologous fibrin glue on Demand[J].Translational Research,2007,149:187 195.–
Synthesis and characterization of photopolymerizable mussel-mimetic adhesive
AI Yu-fei,YANG Dong-zhi,NIE Jun
(Beijing University of Chemical Technology,Beijing 100029,China)
In this study, a bioadhesive containing of poly(ethylene glycol) polymer skeleton, acrylate groups and dopamine groups was synthesized by using esterification and michael addition reaction. The bioadhesive has photopolymerizability,good bonding capacity and excellent biocompatibility. Its chemical structure was confirmed by RTIR and1H-NMR. The adhesive strength of poly(ethylene glycol)-dopamine (PEG-Dopas) was improved from 0.90 MPa to 1.62 MPa after standing for 24 h. This kind of bioadhesive has excellent cell attachment and low cytotoxicity.
photopolymerization;dopamine;bioadhesive
TQ431
A
1001-5922(2015)01-0031-06
2014-07-24
艾宇飞(1979~),男,博士,研究方向:光聚合生物材料制备。E-mail:ayf0919@163.com。

