新型N-糖链受体氘代MPDPZ-Boc-Asn-GlcNAc的合成及其受体性能
于田, 金东日
( 延边大学长白山生物资源与功能分子教育部重点实验室, 吉林 延吉 133002 )
新型N-糖链受体氘代MPDPZ-Boc-Asn-GlcNAc的合成及其受体性能
于田, 金东日*
( 延边大学长白山生物资源与功能分子教育部重点实验室, 吉林 延吉 133002 )
为利用糖链转移酶反应定量分析糖蛋白N-糖链,首先用d8-1-甲基-4-[2,4-二硝基-5-(1-哌嗪基)苯基]哌嗪(d8-PDPZ)与Nω-(2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖基)-Nα-(叔丁氧羰基)-L-天冬酰胺(Boc-Asn-GlcNAc)缩合反应生成d8-PDPZ-Boc-Asn-GlcNAc,然后d8-PDPZ-Boc-Asn-GlcNAc再与碘甲烷反应合成了新的带正电荷的糖链受体d8-MPDPZ-Boc-Asn-GlcNAc.以Endo-M N175Q为糖链转移酶、SG -Asn为糖基供体,利用UPLC-QTOF-MS对d8-MPDPZ-Boc-Asn-GlcNAc的糖链受体性能进行了初步研究.结果表明,在Endo-M N175Q的催化下,d8-MPDPZ-Boc-Asn-GlcNAc与SG-Asn发生酶促反应,生成糖链转移产物d8-MPDPZ-Boc-Asn-SG.如果优化定量反应的条件,d8-MPDPZ-Boc-Asn-GlcNAc可应用于糖链分析.
Endo-M N175Q; 受体; 糖肽; LC-MS
糖基化作用是真核生物蛋白翻译后修饰的重要环节,其在生命活动的许多方面扮演着极其重要的角色,例如蛋白质构象、定位、活性和功能,以及各种生物学反应等[1].研究表明,人类许多疾病的发生和发展都与蛋白上糖链的结构和表达量的改变有关,如炎症[2]、免疫疾病[3]、肿瘤[4]和代谢综合症[5]等.通过定量糖组学技术可以精确地寻找疾病中糖链发生的异常变化,这对疾病的诊断和治疗具有不可估量的作用,因此定量糖组学越来越引起科学家的关注.
目前,质谱技术已应用于糖组学的研究中,并实现了糖链的序列测定和定性研究,但定量分析方法尚不完善.目前,基于质谱检测的化学标记是进行糖链定量的有效方法,如同位素碘甲烷的全甲基化技术[6]、同位素苯衍生物的还原端标记技术[7]等,但这些技术都需要在实验过程中进行额外的化学反应,这不仅需要引入额外的试剂,增加反应步骤,还会产生副反应,给标记效率和样品纯化带来许多不利影响.利用糖苷内切酶转糖基作用的方法可以很好地解决上述问题,但该方法一直没有应用到糖链的定量分析.
Endo-M N175Q是一种N-糖链转移酶,它不仅可以水解糖蛋白和糖肽N-糖链中两个GlcNAc之间的β1-4糖苷键,释放出N-糖链和带有GlcNAc的蛋白或多肽,还具有转糖基活性,能够将寡糖链转移到带有GlcNAc标签的化合物上,在两个GlcNAc之间形成新的糖苷键,从而合成新的糖链化合物[8].目前,Endo-M N175Q已应用于糖肽的合成,但未见有关其在糖链分析中的应用.在文献[9],我们合成了轻同位素标记的受体d0-MPDPZ-Boc-Asn-GlcNAc,并利用Endo-M对糖链进行了定性分析.为利用Endo-M N175Q对N-糖链进行定量分析,本文合成重同位素标记的受体d8-MPDPZ-Boc-Asn-GlcNAc(见图1),并通过质谱对其受体性能进行初步研究,为今后N-糖链的定量分析提供物质基础.
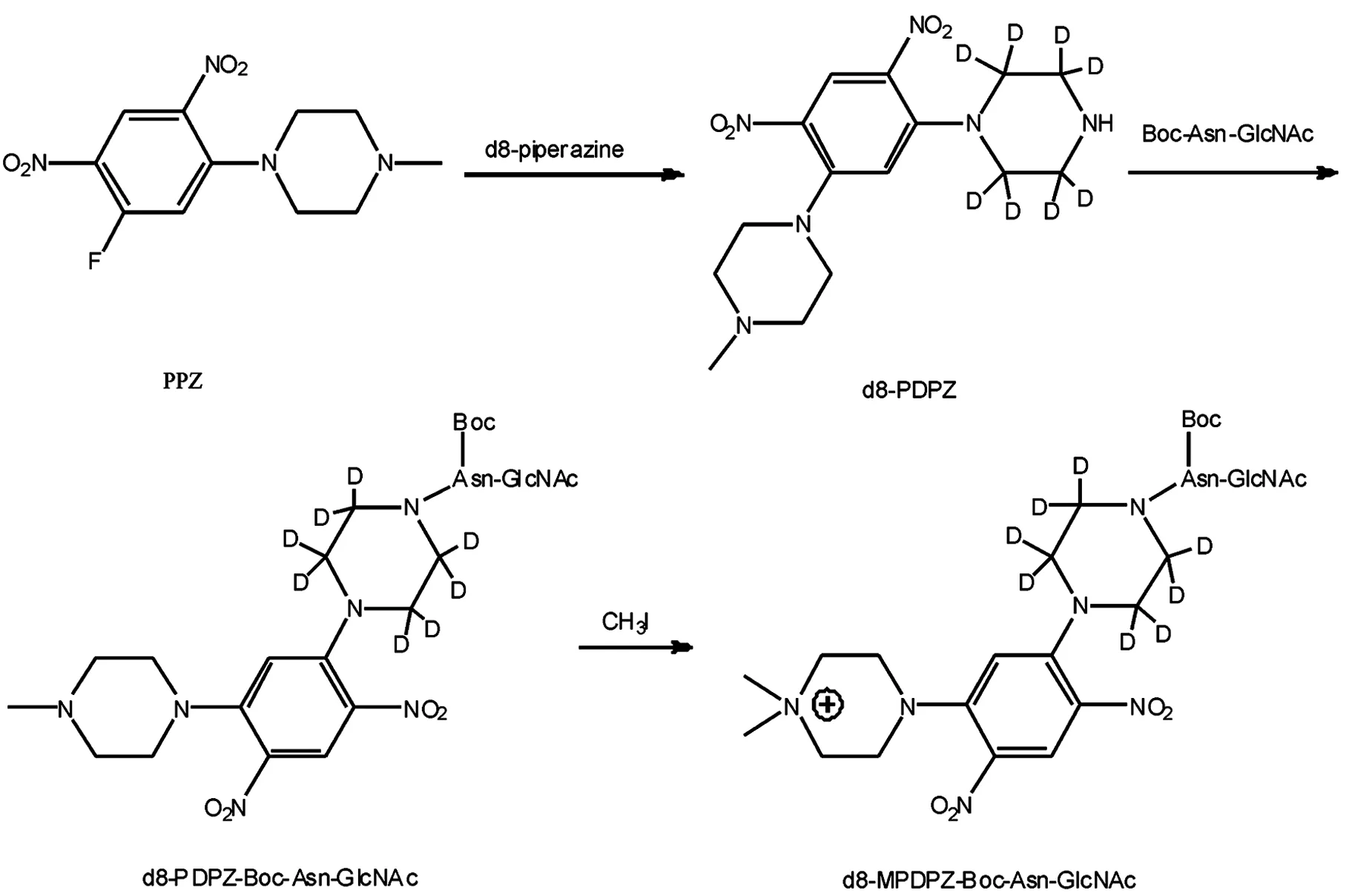
图1 d8-MPDPZ-Boc-Asn-GLcNAc的合成路线
1 实验部分
1.1 仪器与试剂
实验仪器有UPLC-ESI-TOF-MS(Waters),日本岛津公司Axima CFRTMplus基质辅助激光解吸飞行时间质谱仪(MALDI-TOF-MS).
所有反应试剂均为分析纯,购买后未经处理直接使用;柱层析硅胶为青岛海洋化工厂生产,硅胶粒度为100~200目; 1-(5-氟-2,4-二硝基苯基)-4-甲基哌嗪(PPZ)、 d0-哌嗪、 4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉盐酸盐(DMT-MM)、Nω-(2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖基)-Nα-(叔丁氧羰基)-L-天冬酰胺(Boc-Asn-GlcNAc)均为梯希爱(上海)化成工业发展有限公司生产; d8-哌嗪盐酸盐(2,2,3,3,5,5,6,6-d)为美国Cambrige Isotope Laboratories公司生产; SG -Asn为日本大塚化学公司生产.
1.2 d8-1-甲基-4-[2,4-二硝基-5-(1-哌嗪基)苯基]哌嗪(d8-PDPZ)的合成
将25 mg (0.15 mmol) d8-哌嗪盐酸盐溶于1 mL甲醇和43 μL三乙胺中,在60 ℃下将溶于2 mL乙腈的64.0 mg (0.23 mmol) PPZ溶液滴入,然后回流20 min.蒸除溶剂,所得粗产品经硅胶柱分离(V二氯甲烷/V甲醇=5/1)得到黄色固体37.6 mg,产率为96%.1H NMR(300 MHz,CD3OD): δ 8.71(1H,s), 6.29(1H,s), 2.63(4H,s), 2.39(3H,s);13C NMR(75 MHz,CD3OD): δ 42.94, 43.25, 43.53, 43.81, 43.83, 44.84, 50.30, 54.86, 111.45, 129.81, 133.90, 151.04.MALDI-TOF-MS (基质为蒽三酚):m/z359.0 [M+H]+.
1.3 d8-PDPZ-Boc-Asn-GlcNAc的合成
将16.8 mg (0.036 mmol) Boc-Asn-GlcNAc溶于1 mL DMF和甲醇混合溶液中(体积比为4∶6),在室温下加入20 mg (0.06 mmol) DMT-MM,搅拌5 min; 然后加入19.3 mg (0.055 mmol) 1-[5-(1-哌嗪基)-2,4-二硝基苯基]-4-甲基哌嗪(d8-PDPZ),室温反应30 min.蒸除溶剂,加适量水后用二氯甲烷萃取;减压浓缩水层,所得橙黄色粗产品经硅胶柱分离(V二氯甲烷/V甲醇=10/1)后得到12.6 mg产品,产率为50%.MALDI-TOF-MS (基质为蒽三酚):m/z776.3 [M+H]+.
1.4 d8-MPDPZ-Boc-Asn-GlcNAc的合成

1.5 Endo-M N175Q酶转糖基反应
在20 μL 2.5 mM SG-Asn中,分别加入10 μL 4.1 mM d8-MPDPZ-Boc-Asn-GlcNAc、10 μL 0.1 M磷酸缓冲液(pH 6.0)和10 μL 200 mU/mL Endo-M N175Q,在30 ℃下反应30 min.取2.0 μL反应液进UPLC-ESI-TOF-MS.
1.6 UPLC-ESI-MS及HPLC-UV的检测条件
表1和表2分别是超高效液相色谱-电喷雾-飞行时间质谱和HPLC色谱条件.
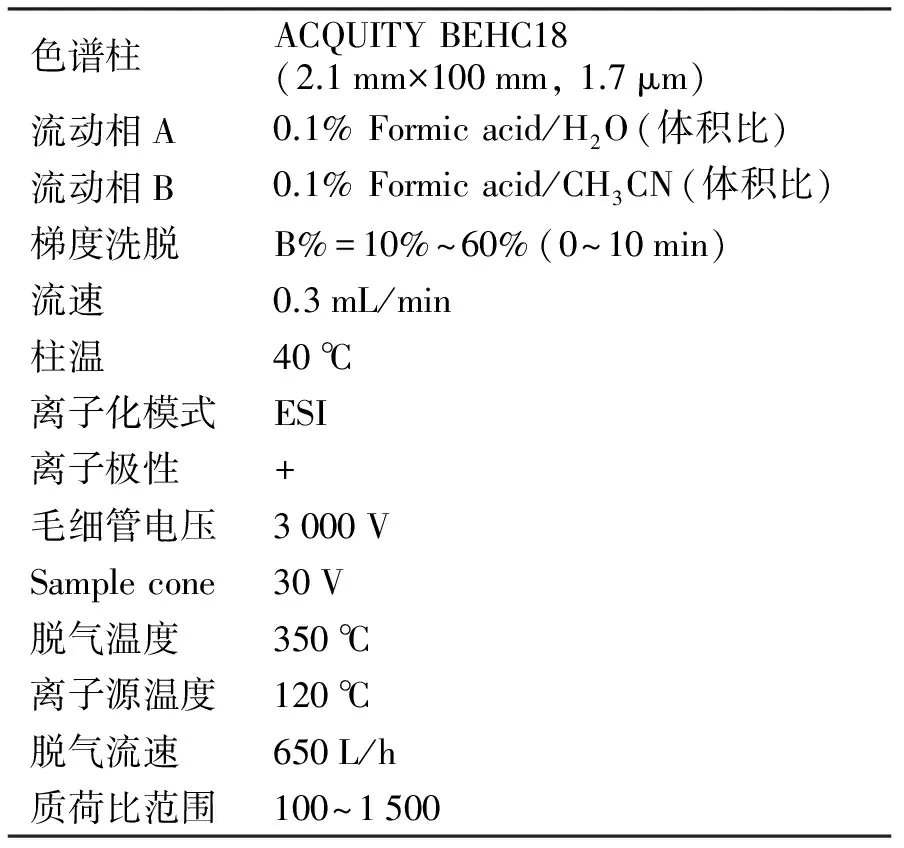
表1 超高效液相色谱-电喷雾-飞行时间质谱条件
2 结果与讨论
2.1 缩合剂的选择
构筑酰胺键的常用方法是进行伴有羧酸活化的脱水缩合反应,其活化剂有N,N′-二环己基碳二亚胺(DCC)/吡啶、2,2′-二吡啶二硫(DPDS)/三苯基膦(TPP)等.我们曾在d0-PDPZ与Boc-Asn-GlcNAc反应中,选用DPDS/TPP作为活化剂合成了d0-PDPZ-Boc-Asn-GlcNAc,但是该方法存在副产物的去除等问题.三嗪缩合DMT-MM既能在传统活化剂、水或质子溶剂中使用[10],还能在含水有机溶剂和水-有机溶剂混合体系中使用,因此具有无需将溶剂脱水的优点.基于此,本文选用DMT-MM作活化剂合成d8-PDPZ-Boc-Asn-GlcNAc.DMT-MM活化机理如图2所示.从图3可知,保留时间为19 min处的峰为d8-PDPZ-Boc-Asn-GlcNAc的峰,其色谱纯度为98.5%.

图2 DMT-MM活化机理

图3 d8-MPDPZ-Boc-Asn-GlcNAc的高效液相色谱图
2.2 d8-MPDPZ-Boc-Asn-GlcNAc的受体性能
Endo-M N175Q是Endo-M的突变体,它不仅具有与Endo-M一样的N-糖链转移性能,而且也能与天然N-糖肽作用.考虑到天然N-糖肽的糖链定量分析,本文选用Endo-M N175Q考察d8-MPDPZ-Boc-Asn-GlcNAc的受体性能.为了提高待测物在电喷雾-质谱上的检测灵敏度以及进行基于质谱的稳定同位素标记糖链定量方法,本文合成了离子型糖链受体d8-MPDPZ-Boc-Asn-GlcNAc.d8-MPDPZ-Boc-Asn-GlcNAc作为酶糖链转移反应的受体,只有标记酶水解下来的糖链,才起到受体作用.因此,本文主要考察d8-MPDPZ-Boc-Asn-GlcNAc能否标记糖链作为判断该试剂的受体性能.以SG-Asn作为糖链供体、d8-MPDPZ-Boc-Asn-GlcNAc作为受体进行的Endo-M N175Q酶促反应见图3,反应后对其产物进行UPLC-ESI-TOF-MS分析,其结果如图4所示.从图4可知,有m/z931.7和1 397.1的质谱峰.从糖链标记物d8-SG-Asn-Boc-MPDPZ的相对分子量可推算,该m/z值分别是[M+2H]3+和[M+H]2+的峰值.由此可见,在Endo-M N175Q酶促反应中,d8-MPDPZ-Boc-Asn-GlcNAc确实起到了受体作用,具有受体性能.
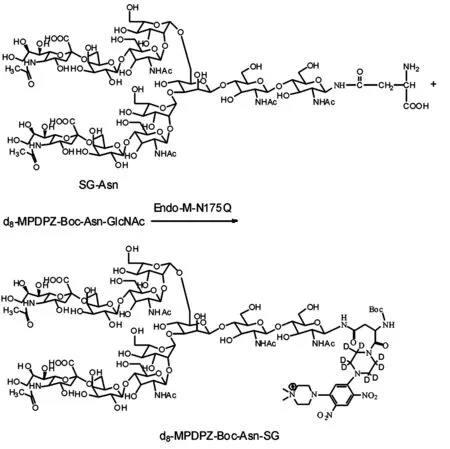
图4 d8-MPDPZ-Boc-Asn与SG-Asn的酶促反应

图5 酶反应产物的质谱图
3 结论
本文以Boc-Asn-GlcNAc为母体合成了d8-MPDPZ-Boc-Asn-GlcNAc,由于其极性较大,易溶于水,所以有利于酶促反应的进行.在糖链转移酶Endo-M N175Q存在下,d8-MPDPZ-Boc-Asn-GlcNAc可作为一种糖链受体对N-糖链进行同位素标记,因此该试剂为定量分析糖蛋白N-糖链提供了一种新的同位素标记受体.
[1] Rudd P, Elliott T, Cresswell P, et al. Glycosylation and the immune system [J]. Science, 2001,291(5512):2370-2376.
[2] Arnold J N, Saldova R, Hamid U M A, et al. Evaluation of the serum N-linked glycome for the diagnosis of cancer and chronic inflammation[J]. Proteomics, 2008,8(16):3284-3293.
[3] Marth J D, Grewal P K. Mammalian glycosylation in immunity [J]. Nat Rev Immunol, 2008,8(11):874-887.
[4] Goetz J A, Mechref Y, Kang P, et al. Glycomic profiling of invasive and non-invasive breast cancer cells [J]. Glycoconj J.2009,26(2):117-131.
[5] Butler M, Quelhas D, Critchley A J, et al. Detailed glycan analysis of serum glycoproteins of patients with congenital disorders of glycosylation indicates the specific defective glycan processing step and provides an insight into pathogenesis [J]. Glycobiology, 2003,13(9):601-622.
[6] Tao W A, Aebersold R. Advances in quantitative proteomics via stable isotope tagging and mass spectrometry[J]. Curr Opin Biotechnol, 2003,14 (1):110-118.
[7] Zhang P, Zhang Y, Xue X, et al. Relative quantitation of glycans using stable isotopic labels 1-(d0/d5)phenyl-3-methyl-5-pyrazolone by mass spectrometry[J]. Anal Biochem, 2011,418(1):1-9.
[8] Yamamoto K, Kasowaki S, Watanabe J, et al. Transglcoscylation activity of Mucor hiemalis endo-beta-N-acetyl-glycosaminidase which transfers complex oligosaccharides to the N-acetylglycosamine moieties of peptides[J]. Biochem Biophys Res Commun, 1994,203(1):244-252.
[9] Min J Z, Suzuki Y, Tomiyasu Y, et al. Development of novel active acceptors possessing a positively chaged structure for the transglycosylation reaction with Endo-M and their application to oligosaccharide analysis[J]. Rapid Commun Mass Spectrom, 2011,25(19):2911-2922.
[10] Kunishima M, Kawachi C, Hioki K, et al. Formation of carboxamides by direct condensation of carboxylic acids and amines in alcohols using a new alcohol- and water-soluble condensing agent: DMT-MM[J]. Tetrahedron, 2001,57(8):1551-1558.
Synthesis and acceptor performance of a new N-linked oligosaccharide acceptor: deuterium MPDPZ-Boc-Asn-GlcNAc
YU Tian, JIN Dongri*
(KeyLaboratoryofNaturalResourcesofChangbaiMountainandFunctionalMolecules(YanbianUniversity),MinistryofEducation,Yanji133002,China)
To quantitative analysis of N-linked oligosaccharides in glycoproteins using transglycosylation reaction, then a permanently positively charged kind and new accepter d8-MPDPZ-Boc-Asn-GlcNAc was synthesized based on a methylation reaction of methyliodide and d8-PDPZ-Boc-Asn-GlcNAc, which was prepared through a condensation reaction of 1-(2,4-Dinitro-5-(piperazin-1-yl)phenyl)-4-methylpiperazine (d8-PDPZ) andNω-(2-acetanido-2-deoxy-β-D-glucopyranosyl)-Nα-(tert-butoxycarbonyl)-L-asparagine (Boc-Asn-GlcNAc). The performance of d8-MPDPZ-Boc-Asn-GlcNAc was investigated by UPLC-ESI-TOF-MS with Endo-M N175Q as enzyme, SG -Asn as donor. The results indicated that the acceptor enzymatically reacted with SG-Asn in the presence of Endo-M N175Q, tansglycosylation product d8-MPDPZ-Boc-Asn-GlcNAc-SG is obtained. Thus, d8-MPDPZ-Boc-Asn-GlcNAc will be used to analyze the oligosaccharides if the quantitative transglycosylation reaction condition is optimized.Key words: Endo-M N175Q; accepter; glycopeptide; LC-MS
2015-01-26 基金项目: 国家自然科学基金资助项目(21365022)
1004-4353(2015)01-0030-04
O626
A
*通信作者: 金东日(1965—),男,教授,研究方向为药物分析.

