sTREM-1在钝性胸部外伤及合并肺挫伤中的动态变化及临床意义
陆志斌,周存荣,占根生,吴卫兵,徐晓晗,吴延虎(南京市浦口区中心医院胸心外科,南京 800;江苏省人民医院胸心外科)
急诊创伤入院患者中有近1/3的患者存在胸部钝性损伤,而肺挫伤又是钝性胸外伤中最常见的并发症。目前研究发现[1],肺挫伤是急性肺损伤(ALI)、急性呼吸窘迫综合征(ARDS)、呼吸机相关性肺炎(VAP)发生发展的独立危险因素,其病理改变是直接或间接地由肺部损伤触发的,包括一系列细胞因子、趋化因子、氧自由基、花生四烯酸代谢产物、凝血级联反应元件等,是肺实质的炎性应答反应。本研究旨在通过检测炎症因子可溶性髓样细胞触发受体-1(soluble triggering receptor expressed on myeloid cell-1,sTREM-1)、肿瘤坏死因子- α(tumor necrosis factor-α,TNF-α)及 C 反应蛋白(C-reactive protein,CRP)的表达水平,探讨其变化与病程发展及疾病转归的关系。
1 资料与方法
1.1 一般资料
选择我院2013-08~2014-10收治入院的单纯钝性胸部外伤无肺部挫伤者30例设为无肺挫伤组,男18例,女12例,年龄23-76岁,平均年龄(50.3±12.1)岁,其中合并肋骨骨折26例;钝性胸部外伤合并肺挫伤者30例设为肺挫伤组,其中男19例,女11例,年龄22-74岁,平均年龄(48.7±10.7)岁,其中合并肋骨骨折29例;钝性胸部外伤合并肺挫伤者进展为ALI/ARDS者8例设为ALI/ARDS组,其中男5例,女3例,年龄46-65岁,平均年龄(52.7±5.8)岁,均合并有多发性肋骨骨折。按照简明损伤定级标准2005版(AIS2005)对患者入院情况进行评分。同期选择30例健康体检者为对照组,其中男性17例,女性13例,平均年龄(49.8±11.02)岁,四组年龄无显著差异。
患者的入选标准:①年龄≥18周岁;②非妊娠期女性;③有明确外伤史,肺挫伤者AIS≥2,胸部以外损伤AIS≤3;④受伤前无急、慢性感染性疾病;⑤无慢性系统性疾病或恶性肿瘤病史。所有患者均为钝性伤,伤后至送达医院就诊时间30 min-4 h以内,入院时均行胸部三维CT扫描确诊合并肋骨骨折(肋骨的连续性中断)或肺挫伤(肺部斑片状阴影)。
合并ALI/ARDS的诊断标准[2],还需符合以下三点:①呼吸频数≥20次/min或呼吸窘迫;②血气分析:PaO2/FiO2≤200 mmHg;③胸部X线或CT检查两肺浸润阴影。入院后主要予吸氧、止血、祛痰、止痛、抑酸等对症治疗;监测动脉血气、血常规+CRP变化。并发血气胸行胸腔闭式引流者有18例。ALI/ARDS组8例均行呼吸机辅助呼吸,其中手术干预6例。所有患者均成功治愈出院,均未使用抗生素常规治疗;无继发肺部感染,无死亡病例。此项研究获得医院伦理委员会批准,所有患者及家属均充分知情同意。
1.2 标本采集与检测
对照组及所有无肺挫伤组、肺挫伤组、ALI/ARDS组患者在受伤入院时、入院后1 d,3 d,7 d取外周静脉血3 ml并肝素抗凝,4℃冰箱保存,3 000 r/min离心10 min后取上清液,-70℃冰箱保存待测。标本检测ELISA实验。血清中的sTREM-1和TNF-α含量测定采用ELISA法,试剂盒由北京达科为生物技术有限公司提供,操作步骤严格按说明书进行。CRP的检测采用芬兰Orion Diagnostica公司Quick Read101免疫比浊法测定。
1.3 统计学处理
2 结果
2.1 血清sTREM-1在四组中随病程动态变化的结果
入院时、入院后第1,3,7天血清sTREM-1肺挫伤组和ALI/ARDS组都较无肺挫伤组高;入院时和入院后第1天ALI/ARDS组相对于肺挫伤组高,均差异有统计学意义(P<0.05,见表1)。无肺挫伤组、肺挫伤组、ALI/ARDS组入院后第3天和第7天血清sTREM-1均较入院时和入院后第1天显著降低(P <0.05)。
2.2 血清TNF-α在四组中随病程动态变化的结果
入院时、入院后第1,3,7天肺挫伤组和 ALI/ARDS组血清TNF-α较无肺挫伤组高;ALI/ARDS组相对于肺挫伤组高,均差异有统计学意义(P<0.05,见表2)。无肺挫伤组、肺挫伤组入院后第1天和第3天较入院时显著升高(P<0.05),入院后第7天较第1天和第3天降低(P<0.05)。ALI/ARDS组入院后第3天和第7天比入院时和入院后第1天显著降低(P<0.05),第7天较入院时、入院后第1天和第3天降低(P<0.05)。

表1 各组血清sTREM-1水平的动态变化 (pg/ml)Table 1 Dynamic changes of serum sTREM-1 level in each group (pg/ml)

表2 各组血清TNF-α水平的动态变化 (pg/ml)Table 2 Dynamic changes of serum TNF-α level in each group (pg/ml)
2.3 血清CRP在四组中随病程动态变化的结果
入院时、入院后第1天、第3天肺挫伤组和ALI/ARDS组血清 CRP较无肺挫伤组高,ALI/ARDS组相对于肺挫伤组高,均差异有统计学意义(P<0.05,见表3)。入院后第7天时ALI/ARDS组比无肺挫伤组和肺挫伤组高(P<0.05)。肺挫伤组血清CRP入院后第1天相对入院时升高;入院后第7天比入院时、入院后第1天和第3天降低(P<0.05)。ALI/ARDS组入院后第1天和第3天相对入院时升高;入院后第3天相对于第1天升高;第7天相对入院时、入院后第1天和第3天降低,均差异有统计学意义(P<0.05)。
2.4 ROC 曲线图
ROC曲线是以灵敏度为纵坐标,1-特异度为横坐标,绘制曲线并对曲线下覆盖面积AUC进行计算分析,评估检测指标可靠性的方法。曲线下面积越大,则诊断价值越高。
在胸外伤合并肺挫伤时,根据血清sTREM-1、TNF-α和 CRP浓度预测,ROC的 AUC分别为0.862,0.839,0.726,sTREM-1、TNF 和 CRP 等指标对疾病的预测价值依次减小(见图1);CRP的诊断价值较差。sTREM-1、TNF最佳阈值分别为96.8 pg/ml,249.6 pg/ml,诊断的灵敏度分别为 95.0%,92.9%,特异度分别为77.3%,74.8%。
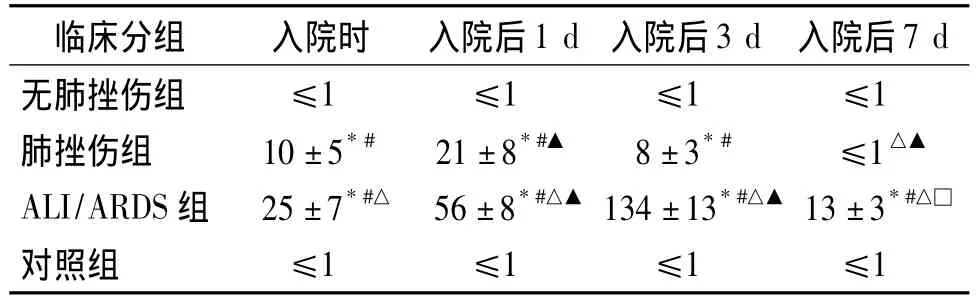
表3 各组血清CRP水平的动态变化 (pg/ml)Table 3 Dynamic changes of serum CRP level in each group(pg/ml)
3 讨论
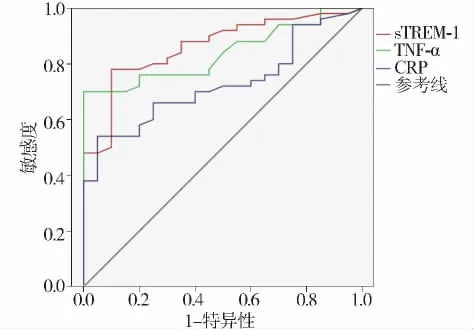
图1 炎症指标对胸外伤合并肺挫伤的判断能力的ROC曲线Figure 1 ROC curve of sTREM-1,TNF and CRP for blunt chest trauma combined with pulmonary contusion
肺挫伤是临床钝性胸部外伤最常见的并发症,其病理机制包括:创伤组织(内皮细胞和上皮细胞)的损伤、炎症反应、肺微血管通透性的增加、肺水肿、表面活性物质功能障碍、通气/血流比例失调、肺的顺应性降低等[1,3]。其本质是一种肺实质损伤后的炎症应答反应。严重者可表现为呼吸窘迫、低氧血症、呼吸衰竭等,易发生ALI或ARDS。合并休克者ARDS的发生率高达56%[4]。所以临床对肺挫伤的严重程度监测显得尤为重要。
TREM-1是与炎症相关的免疫球蛋白超家族成员,近年来逐渐成为研究的热点[5,6]。它表达于中性粒细胞、单核细胞及巨噬细胞等[7],其介导的信号通路TREM-1/DAP12能激活蛋白酪氨酸激酶[7,8],激发多种炎症介质的分泌,如白介素- 6、肿瘤坏死因子-α、白介素-1等,是激发和扩大炎症反应的重要介质[7-9]。sTREM-1是分泌于血液及体液中的可溶性受体,与细胞表达的TREM-1具有相同的胞外结构,可与相同的配体结合,发挥生物学效应[1,7]。在脓毒血症、坏死性胰腺炎、新生儿腹泻、危重患者、泌尿道感染、免疫性疾病及肺部感染中的研究发现[10-15],sTREM-1 的表达变化均与疾病密切相关,参与了人体的炎症反应及免疫应答,对早期诊断及疾病变化预测具有一定的临床价值。TNF-α是TREM-1与配体结合后激活的下游炎症因子,具有广泛的生物学效应,也是炎症反应中的重要介质[1,16]。不仅在肺部感染的血液及肺泡灌洗液中表达升高,在很多炎性疾病如脓毒血症、胆囊炎、胰腺炎等中均表达升高[13,17]。CRP是临床最常用的炎症检测指标,但其特异性及敏感性都不高。故学者们都在寻求某种特异性及敏感性更高的检测指标,来早期诊断或评估病情变化。
通过胸片或CT可对肺挫伤的解剖进行定位,但缺失对机体应答反应改变的了解。本研究联合检测了血浆中炎症因子CRP、TNF-α以sTREM-1,试图探讨胸部创伤及肺挫伤后至恢复期整个病情变化过程中相关因子的动态变化,为病情评估提供有效信息。通过研究发现:血清sTREM-1在发生胸部外伤后均较对照组明显升高(P<0.05);在入院的同一时间段,钝性胸部外伤发展为ALI/ARDS者较胸外伤合并肺挫伤组明显升高(P<0.05),胸外伤合并肺挫伤组较胸外伤无肺挫伤组明显升高(P<0.05)。由此可见,血清 sTREM-1随着病情的严重程度其表达是逐渐增加的,合并肺挫伤越严重则表达越高。从不同分组的病程变化来分析,血清sTREM-1在入院时最高,随着病程的延长表达逐渐降低的,与国外相关研究结果趋势一致[18,19],在入院后第7天仍较健康人群升高。血清TNF-α的表达在各组入院的同一时间段比较与血清sTREM-1有相同的统计学意义,但在无肺挫伤组的第7天可恢复到健康人群水平。它的病程变化曲线与血清sTREM-1截然不同,表现为先升高后减低的一个过程,受伤后第1天达最高水平。由此我们可以推测TNF-α是由sTREM-1表达升高后才大量激发生成,因此峰值出现较晚,而后期表达趋势随着sTREM-1的降低而逐渐下降。进一步证实了 TNF-α属于 sTREM-1的下游炎症因子[16]。相比而言,CRP对病情的评估只有在合并肺挫伤或更严重的ALI/ARDS才表现出差异性,合并肺挫伤的入院后第7天可恢复至正常水平。在病程变化中,合并肺挫伤时峰值出现在入院后第1天,发展到ALI/ARDS时则峰值出现在入院后第3天。对病情的评估相对滞后。ROC曲线分析,血清sTREM-1的曲线下面积最大,为0.862,具有最佳的诊断及预测价值,TNF-α次之,CRP最差。
综上所述,在钝性胸部外伤合并肺挫伤中,血清sTREM-1表达的变化可早期反应病情的严重程度,尤其后期进展为ALI/ARDS者,在早期表达就显著升高。对于顺利治愈的患者,它是随着住院时间延长而逐渐降低的一个过程,其特异性及敏感性都相对较高,临床价值较大,有望成为肺挫伤严重程度的独立评估指标。
[1]Raghavendran K,Notter RH,Davidson BA,et al.Lung contusion:inflammatory mechanisms and interaction with other Injuries[J].Shock,2009,32(2):122-130.
[2]中华医学会重症医学分会.急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南(2006)[J].中华内科杂志,2007,46(5):430-435.
[3]Gallagher JJ.Management of blunt pulmonary injury[J].AACN Adv Crit Care,2014,25(4):375-386.
[4]胡盛寿.胸心外科学[M].北京:人民卫生出版社,2014:13.
[5]Vimal G,Panagiotis P,Neil S.A biomarker panel(bioscore)incorporating monocytic surface and soluble TREM-1 has high discriminative value for ventilator-associated pneumonia:a prospective observational study[J].PLoS One,2014,9(10):e109686.
[6]Marco G,Sergio R,Carmen C,et al.The triggering receptor expressed on myeloid cells(TREM)in inflammatory bowel disease pathogenesis[J].J Transl Med,2014,12(1):293- 296.
[7]Marc D,Frédéric M,Sébastien G.Triggering receptor expressed on myeloid cells-1 as a new therapeutic target during inflammatory diseases[J].Self Nonself,2010,1(3):225-230.
[8]Boufenzer A,Sennoun N,Bouazza Y,et al.Role of TREM-1 in endothelial dysfunction during experimental sepsis[J].Crit Care,2012,16(3):P49-55.
[9]Hamerman JA,Minjian N,Killebrew JR,et al.The expanding roles of ITAM adapters FcRγ and DAP12 in myeloid cells[J].Immunol Rev,2009,232(1):42-58.
[10]梁微波,庞晓清,刘晓青,等.动态监测血清可溶性髓样细胞触发受体1对脓毒症的诊断及预后评估价值[J].中国呼吸与危重监护杂志,2014,13(1):53-57.
[11]Wang HX,Chen B.Diagnostic role of soluble triggering receptor expressed on myeloid cell-1 in patients with sepsis[J].World J Emerg Med,2011,2(3):190-194.
[12]杨芳,涂芳芳,项文娜,等.sTREM-1和CD64指数测定在诊断新生儿腹泻中的临床意义[J].世界华人消化杂志,2014,22(12):1756-1759.
[13]Yin K,Dang SC,Zhang JX.Relationship between expression of triggering receptor-1 on myeloid cells in intestinal tissue and intestinal barrier dysfunction in severe acute pancreatitis[J].World J Emerg Med,2011,2(3):216-221.
[14]关云艳,王倩,吴海荣,等.54例危重病患者sTREM-1与炎症因子表达的相关性及对预后的影响[J].重庆医学,2014,43(19):2415-2416.
[15]Kelsey R,Sébastien G,Saguna V.Triggering receptor expressed on myeloid cells-1(TREM-1):a new player in antiviral immunity[J].Front Microbiol,2014,5(26):627-631.
[16]Mihailidou I,Pelekanou A,Aikaterini P,et al.Dexamethasone down-regulates expression of triggering receptor expressed on myeloid cells-1:evidence for a TNFα-related effect[J].Front Public Health,2013,1(1):50-55.
[17]Shi JX,Li JX,Hu R,et al.Diagnostic value of sTREM-1 in bronchoalveolar lavage fluid in ICU patients with bacterial lung infections:a bivariate meta-analysis[J].PLoS One,2013,8(5):e65436.
[18]Tobias MB,Barbara P,Sven S,et al.Soluble triggering receptor on myeloid cells-1 is expressed in the course of non-infectious inflammation after traumatic lung contusion:a prospective cohort study[J].Crit Care,2011,15(2):R115-119.
[19]Liu N,Gu Q,Zheng YS.Expression of triggering receptor-1 in myeloid cells of mice with acute lung injury[J].World J Emerg Med,2010,1(2):144-148.

