细胞免疫治疗对乳腺癌患者Treg细胞表达的影响
任莉莉,邓春艳,蒋锦杏,俞丽娜,齐 晖,邙建波(深圳市人民医院生物治疗室,深圳 5800;深圳市人民医院甲乳外科;通讯作者,E-mail:mangjianbo@6.com)
细胞的免疫疗法是一种对肿瘤细胞具有靶向杀伤作用的新兴技术,临床上已经证实,其一方面可有效杀伤体内残余癌细胞,抑制肿瘤细胞复发转移,另一方面还能有效提高患者的免疫能力,对于清除残余的微小肿瘤病灶及清除耐药的肿瘤细胞等尤为有效[1]。联合细胞免疫治疗后,乳腺癌患者的生存期及远期复发率都较单纯的手术及放化疗组得到明显改善。由于肿瘤的发生、发展与患者体内免疫状况密切相关,肿瘤本质上是一种免疫相关疾病。调节性T细胞(regulatory T cell,Treg)是健康个体T细胞库的组成部分,约占 CD4+T淋巴细胞细胞的5%-15%[2],这群T淋巴细胞可以发挥特异性抑制作用,动态地调节机体免疫平衡,同时也能阻止机体对肿瘤细胞的免疫效应,造成肿瘤的免疫逃逸、复发及转移,是与肿瘤发生、发展关系最为密切的一组免疫细胞。
本研究旨在通过检测乳腺癌患者外周血中及肿瘤微环境中Treg细胞的表达情况及经细胞免疫治疗后Treg的表达变化,对乳腺癌患者的细胞免疫功能进行初步的评价,探讨细胞免疫治疗后乳腺癌患者体内调节性T细胞的改变,评估细胞免疫治疗对乳腺癌患者免疫状况的影响。
1 资料与方法
1.1 研究对象
收集自2013-03~2014-12在我院甲乳外科就诊且经病理学检查证实为女性乳腺癌患者30例,浸润性导管癌12例,浸润性小叶癌5例,导管内癌10例,黏液腺癌3例,年龄33-67岁,中位年龄48岁。依《AJCC癌症分期手册》的第七版乳腺癌分期标准分期:Ⅰ期14例,Ⅱ期9例,Ⅲ期7例。正常对照组30例来自2013-03~2014-12我院健康体检女性,年龄30-62岁,中位年龄45岁。所有对象均无糖尿病、类风湿、甲状腺功能亢进等自身免疫性疾病以及免疫治疗史。标本采集前均取得研究对象的知情同意并签署知情同意书,均接受细胞因子诱导杀伤性淋巴细胞过继治疗6次(一疗程)。
1.2 方法
1.2.1 细胞因子诱导细胞毒性淋巴细胞治疗(cytokine-induced killer cells,CIK) 抽取患者外周血50 ml,Ficoll经典法分离纯化淋巴细胞,置含IFN-γ(1 000 U/ml)的50 ml GT-551-H3 CIK细胞专用培养基中,培养过夜。次日添加IL-1α(1 ng/ml)、IL-2(800 IU/ml)、抗CD3单抗(100 ng/ml)继续培养。每2 d观察并传代换液。第13天送检微生物培养(包括细菌、真菌、支原体),48 h培养阴性的细胞回输前检测内毒素,阴性细胞收集在250 ml生理盐水中回输。每疗程6次。疗程开始前及最后一次回输后次日及第7,14天抽外周血备用Treg检测。
1.2.2 血液标本 CD4+CD25+CD127low/-Treg 的流式检测 乳腺癌患者细胞免疫治疗疗程开始前及最后一次回输后次日及第7,14天抽外周血与健康体检者肘静脉血3 ml,EDTA抗凝,取待检测样本抗凝血100 μl入流式检测管中,标记检测管及空白管,空白管中加入anti-CD4-PerCP荧光抗体20 μl,样品测定管中加入anti-CD4-PerCP荧光抗体+anti-CD25-FITC荧光抗体+anti-CD127-PE荧光标志的抗体各20 μl,室温下避光孵育20 min。每个测定管中加入溶血素1 ml,振荡混匀,室温下继续避光孵育15 min。转速1 500 r/min,离心5 min后吸管吸去上清。加入1 ml PBS混匀清洗,1 500 r/min离心5 min,可再用PBS清洗一次。吸去上清液后,加入500 μl PBS重悬细胞并于振荡器上充分震荡混匀。应用流式细胞仪对制备好的细胞悬液进行检测,以CD4+T细胞设门,分析CD4+CD25+CD127low/-T细胞所占CD4+T细胞的百分比。
1.2.3 肿瘤浸润淋巴细胞中CD4+CD25+CD127low/-Treg的流式检测 无菌操作取得经病理诊断为乳腺癌的手术标本约 1.2 cm ×0.8 cm ×0.6 cm,包括肿瘤组织及癌旁组织,癌旁组织要求远离肿瘤原发灶至少3 cm。剔除脂肪组织及血管组织,加1 ml PBS后,经组织样本制备仪制备单细胞悬液。吹打混匀后吸取细胞悬液移入离心管中,取少许细胞悬液计数细胞浓度。取10×106个细胞,补加两倍体积的PBS,1 500 r/min,离心10 min,弃去上清液。之后用PBS同法离心清洗一次,完全弃去上清液,再加入PBS 500 μl给予重悬。检测步骤同血液标本。
1.2.4 统计学处理 应用统计软件SPSS16.0统计实验数据,实验所获数据用±s来表示,乳腺癌患者与对照组样本比较采用独立样本t检验,治疗前后乳腺癌患者外周血Treg变化采用单因素方差分析,P≤0.05时为差异具有统计学意义。
2 结果
2.1 乳腺癌患者外周血中Treg细胞的水平与乳腺癌不同分期的关系
随着疾病的进展,乳腺癌患者外周血中Treg细胞的水平随之升高,乳腺癌Ⅰ期患者外周血Treg的表达为(7.98 ±0.38)%,Ⅱ期为(9.12 ±1.07)%,Ⅲ期为(11.34±1.32)%,而健康对照组外周血的Treg仅为(4.35±0.73)%。乳腺癌三个分期的患者外周血Treg表达水平与健康对照组相比均显著增高(P<0.05),Ⅱ期与Ⅲ期乳腺癌患者外周血中Treg细胞的表达水平显著高于Ⅰ期乳腺癌患者(P<0.05,见表1)。
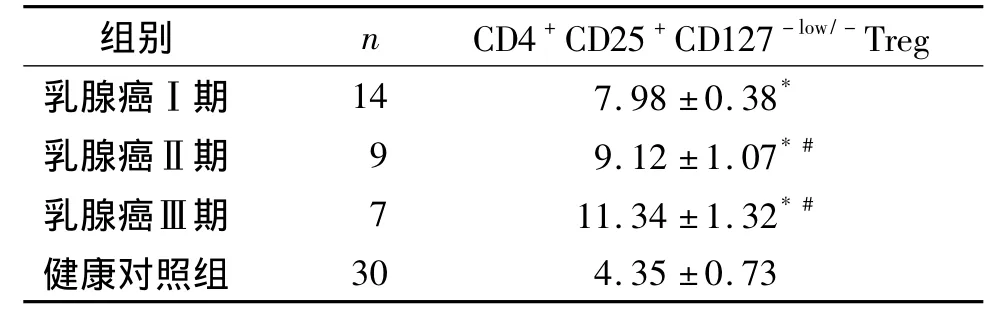
表1 乳腺癌患者外周血Treg的表达 (%)
2.2 乳腺癌患者肿瘤组织及癌旁组织中Treg细胞的水平与乳腺癌不同分期的关系
乳腺癌肿瘤微环境中浸润的淋巴细胞主要定位在肿瘤组织和癌旁组织内,在乳腺癌Ⅰ期患者肿瘤组织中Treg的表达为(17.69±2.37)%,而在Ⅰ期癌旁组织中 Treg的表达为(34.12±6.17)%,癌旁组织中表达显著高于肿瘤组织(P<0.05);Ⅱ期肿瘤组织内为(23.48±4.58)%,Ⅲ期肿瘤组织内为(44.13±6.95)%,而Ⅱ期、Ⅲ期癌旁组织的 Treg分别为(38.97±5.92)%、(52.13 ±10.45)%,均显著高于肿瘤组织中表达(P<0.05)。同时,乳腺癌Ⅱ期、Ⅲ期患者肿瘤组织内的Treg表达水平与Ⅰ期相比,均显著增高(P <0.05,见表2)。
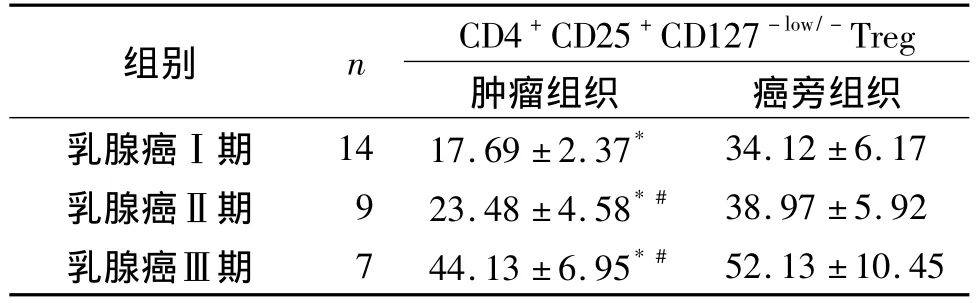
表2 乳腺癌患者肿瘤组织及癌旁组织Treg的表达 (%)
2.3 CIK治疗对乳腺癌患者外周血Treg表达的影响
在CIK治疗一疗程结束后,检测细胞回输后第1,7,14天的患者外周血Treg的表达情况,结果显示在所有接受治疗的患者组中,回输次日患者体内的Treg表达水平均与回输前无显著性差异(P>0.05),但在回输细胞第7天,不同分期组内的乳腺癌患者外周血Treg均有不同的升高(P<0.05或P<0.01)。回输第14天,Treg升高幅度有所回落,接近于未进行细胞免疫治疗之前的外周血表达情况(见表3)。
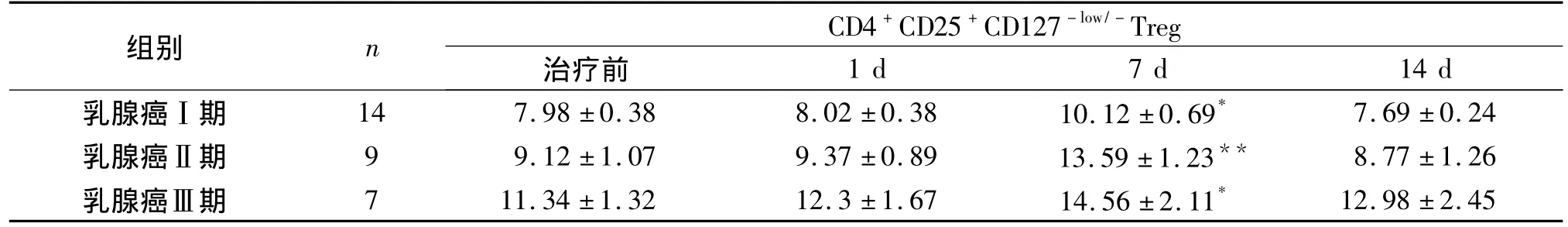
表3 CIK治疗前后乳腺癌患者外周血Treg表达 (%)
3 讨论
调节性T细胞在维持人体健康与疾病状态的免疫平衡中扮演重要角色。疾病条件下诱导产生的Treg(induced Treg,iTreg)在肿瘤组织及患者外周血中扩增、聚集,通过多种机制调整免疫应答,与肿瘤的发生、发展及患者的预后密切相关[3]。iTreg可以表达星质核苷酸酶及CD39、CD73,水解ATP成为5'-AMP 和腺苷,表达前列腺素 E2(PGE2)[4],从而抑制表达腺苷受体的免疫细胞执行功能[5]。iTreg在肿瘤抗原及细胞因子的刺激下大量扩增,直接抑制抗肿瘤免疫,造成肿瘤免疫逃逸。但是,在部分以炎症浸润为特征的肿瘤中,如结直肠癌或某些类型的乳腺癌,iTreg通过产生ADO或PEG2保护机体免受过度的炎性反应的伤害,延缓了肿瘤的进展[6]。因此,可以说Treg的升高和降低对机体存在两方面的作用,Treg的免疫抑制作用最终是对机体有利还是促进了肿瘤发展,与肿瘤的类型密切相关[7]。因此研究在不同疾病状况及治疗手段下iTreg的变化,并向有利于患者临床治疗及预后进行引导和干预,具有重要意义。
本研究结果表明,乳腺癌患者外周血中Treg细胞的比例显著高于健康对照组,在病理分期中表现出临床分期越晚,Treg的表达水平升高的越显著;说明随着乳腺癌病程的进展,Treg的表达水平进一步增高,患者体内免疫抑制状况愈加严重。同时也提示外周血Treg细胞的表达情况与乳腺癌的临床分期有关,Treg细胞含量越高,显示肿瘤进展程度越高,提示外周血中Treg细胞含量可做为评估肿瘤负荷的一种指标。在肿瘤患者癌旁组织中的Treg表达水平高于肿瘤组织内,也是患者机体难以抑制肿瘤转移的一个重要因素。
CIK细胞免疫治疗目前在国内外应用广泛,是肿瘤综合治疗的重要组成部分,在临床应用中观察到患者生存期延长,生存质量改善等疗效[8]。在本研究中,细胞免疫治疗后患者外周血的Treg水平在治疗中期有统计学意义的升高,提示细胞免疫治疗所带来的大量的细胞因子,如IL-2、IL-17等有可能诱导了Treg的发生,导致Treg的数目有所上升,细胞免疫治疗在治疗中期一定程度上加剧乳腺癌患者体内的免疫抑制状态。但是正如文献所述,Treg在不同类型的肿瘤中的升高和减低与肿瘤预后的关系尚不明确[9],因此CIK治疗所带来的Treg的升高,究竟是加剧了乳腺癌患者的免疫抑制,导致肿瘤发展,还是保护了机体免受过度炎性反应的伤害,尚不能判断。
因此,探讨Treg表达变化与乳腺癌发展及预后之间的相关性研究十分必要,进一步建立Treg的数量与肿瘤分型、分期及患者预后等因素的关系,对临床治疗有重要的指导作用。Treg细胞作为一种免疫调节性细胞,可以反映乳腺癌患者全身和局部的免疫功能状态,同时也可以用于评估肿瘤的进展情况,有望成为乳腺癌治疗的一个新靶标。
[1]Whiteside TL.Regulatory T cell subsets in human cancer:are they regulating for or against tumor progression[J].Cancer Immunol Immunother,2014,63(1):67-72.
[2]Nishikawa H,Sakaguchi S Regulatory T cells in tumor immunity[J].Int J Cancer,2010,127:759-767.
[3]de Leeuw RJ,Kost SE,Kakal JA,et al.The prognostic value of FoxP3+tumor-infiltrating lymphocytes in cancer:a critical review of the literature[J].Clin Cancer Res,2012,18:3022-3029.
[4]Fridman WH,Galon J,Pages F,et al.Prognostic and predictive impact of intra and peritumoral immune infiltrates[J].Cancer Res,2011,71:5601-5605.
[5]Deaglio S,Dwyer KM,Gao W,et al.Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression[J].J Exp Med,2007,204:1257-1265.
[6]Campbell DJ,Koch MA.Phenotypical and functional specialization of FOXP3+regulatory T cells[J].Nat Rev Immunol,2011,11:119-130.
[7]Mulligan AM,Raitman I,Feeley L,et al.Tumoral Lymphocytic Infiltration and Expression of the Chemokine CXCL10 in Breast Cancers from the Ontario Familial Breast Cancer Registry[J].Clin Cancer Res,2013,19(2):336-346.
[8]West NR,Kost SE,Martin SD,et al.Tumour-infiltrating FOXP3+lymphocytes are associated with cytotoxic immune responses and good clinical outcome in oestrogen receptor-negative breast cancer[J].Br J Cancer,2013,108(1):155-162.
[9]Schmeel FC,Schmeel LC,Gast SM,et al.Adoptive immunotherapy strategies with cytokine-induced killer(CIK)cells in the treatment of hematological malignancies[J].Int J Mol Sci,2014,15(8):14632-14648.

