左旋精氨酸对肺高压大鼠体内循环微粒的影响
王旭兰,王群让,康 平,宋宝国,常凤军(咸阳职业技术学院医学院护理部,咸阳 7000;陕西中医药大学附属医院心内科;延安大学附属医院东关医院心脑血管外科;陕西省人民医院心脏外科;通讯作者,E-mail:changfengjun00@6.com)
肺高压(pulmonary hypertension,PH)的病理机制复杂、病情进行性加重,而且预后差。PH的病理特征包括:肺血管阻力持续性增加、肺血管增殖及重塑、肺血管血栓形成及肺血管进行性闭塞[1]。但是目前PH的治疗药物针对性差,找到治疗PH的特异性药物是目前的当务之急。
我们前期的研究[2]及其他学者[3]的研究发现左旋精氨酸(L-arginine,L-Arg)可通过改善内皮功能缓解PH。最近的研究[4]还发现循环微粒(circulating microparticles,MPs)可以损害包括肺动脉在内的血管内皮功能。那么L-Arg改善PH是否直接通过影响MPs来实现,目前尚无报道,本研究将探讨L-Arg对PH大鼠体内MPs含量及质量的影响,以进一步了解L-Arg防治PH的作用机制。
1 材料与方法
1.1 实验动物、主要仪器和试剂
SPF级雄性Sprague Dawley(SD)大鼠18只,体重(200±10)g,购自陕西中医药大学实验动物中心。电泳仪、转膜仪为美国BIO-RAD产品,BI-420E+生物机能试验系统购自成都泰盟科技有限公司,PVDF膜购自瑞士罗氏公司、X射线摄影暗匣及中速感感光屏(AX-Ⅱ型)购自广东粤华公司,超声破碎仪购自美国Cole-Parmer。TEMED购自美国Sigma-Aldrich。野百合碱(monocrotaline,MCT)、左旋精氨酸(L-arginine,L-Arg)、戊巴比妥钠和RIPA裂解液为美国Sigma-Aldrich产品,RPMI1640、磷酸盐缓冲液(phosphate buffered saline,PBS)购自美国Gibico公司,eNOS购自Santa Cruz公司,BCA试剂盒为美国Thermo Scientific产品。
1.2 肺高压模型建立及分组
按文献[5]的方法制备PH模型:用乙醇和生理盐水(2∶8)混合液将野百合碱配成20 g/L的溶液,用生理盐水将L-Arg配成150 g/L的溶液。18只雄性SD大鼠随机分为三组(n=6):对照组、MCT组、L-Arg组。除对照组外,MCT组和L-Arg组大鼠腹腔注射MCT 50 mg/kg诱导PH并饲养3周。期间L-Arg组每日腹腔注射L-Arg(500 mg/kg),对照组和MCT组每日腹腔注射等量的生理盐水。
1.3 大鼠肺动脉压力的测定
饲养满3周时,戊巴比妥钠50 mg/kg麻醉大鼠后,通过BL-420E生物机能试验系统检测右心室收缩压(right ventricular systolic pressure,RVSP)[4],间接反应肺动脉压力值。
1.4 大鼠血浆MPs检测
测量肺动脉压力后经腹主动脉采血,然后依文献[6]的两步法提取MPs:第一步离心(4℃ 11 000×g 2 min)得到乏血小板血浆,然后取2 ml乏血小板血浆进行第二步离心(4℃ 13 000×g 45 min),结束后吸去上清,在用100 μl RPMI1640培养基重悬MPs。用BCA试剂盒测定MPs蛋白浓度。
1.5 MPs对大鼠肺血管eNOS蛋白的影响
取6只大鼠分别开胸取肺动脉并小心去除动脉周围组织,将肺动脉剖开放入RPMI1640培养基内平衡1 h,然后分别加入等量的三组MPs(1 mg/ml)刺激1 h。刺激结束后将肺血管用PBS清洗3次并吸干多余PBS后移入液氮内速冻5 min,将速冻的肺血管研磨破碎后用RIPA裂解液在冰上裂解10 min。10 min后离心(4℃ 10 000×g 30 min)并吸取上层蛋白。用BCA试剂盒测定蛋白浓度。提取蛋白通过Western blot检测eNOS蛋白的表达变化。
1.6 统计学方法
2 结果
2.1 大鼠肺动脉压力测定
各组大鼠 RVSP测量结果的比较:与对照组[(11.26 ±2.43 mmHg)]比较,MCT 组[(24.71 ±2.51 mmHg)]大鼠肺动脉压力升高,提示PH建模成功;L-Arg组大鼠的肺动脉压力[(18.15±2.27)mmHg]较MCT组低说明L-Arg缓解了PH病情。
2.2 大鼠血浆MPs含量检测
与对照组[(1.14±0.53 mg/ml)]相比,MCT 组大鼠体内 MPs浓度明显升高[(2.02±0.33)mg/ml];L-Arg一定程度上降低了PH大鼠体内的MPs浓度[(1.64 ±0.31)mg/ml]。
2.3 MPs对大鼠肺血管eNOS蛋白影响
与对照组比较,MCT组和L-Arg组eNOS蛋白的表达均降低,而且MCT组与L-Arg组eNOS蛋白的表达无统计学差异(见图1)。
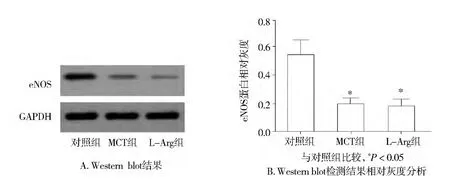
图1 各组大鼠MPs对eNOS蛋白表达的影响Figure 1 Effect of MPs on the expression of eNOS protein in rats
3 讨论
肺血管内皮位于肺血管腔的内表面,肺血管内皮细胞通过分泌各种收缩和舒张因子维持肺动脉压力的稳定,当细胞受到不同炎症因子或病毒的刺激、接触某些药物、组织细胞缺氧、受到血流剪切力等作用时,肺血管内皮组织均会受损[7]。
一氧化氮(nitric oxide,NO)是重要的血管内皮依赖舒张因子。内皮细胞以L-Arg为底物依靠eNOS合成NO促进血管舒张,维持肺动脉压力保持在正常水平。我们[2]和其他研究团队[3,8]表明:LArg通过上调eNOS蛋白的表达、抑制血小板的聚集、减少内皮素-1的产生、促进血管舒张,以缓解肺高压。
内皮细胞被激活或发生凋亡时会以胞膜出芽的形式向周围的环境中分泌细胞MPs[9]。研究发现MPs大小为 0.1-1.0 μm,是亚微米级的细胞颗粒[10,11]。除内皮细胞外,血小板也可以生成 MPs。国内外研究发现体内MPs含量反映内皮损伤和功能障碍[5-8]。Ci等[4]报道 EMPs可以减少瓣膜内皮细胞eNOS蛋白的表达和减少 NO的产生;同时EMPs还通过抑制热休克蛋白90(HSP90)和eNOS的结合而减少NO的生成和增加氧自由基的产生。我们最近的研究显示:MPs通过抑制eNOS蛋白和上调弹性蛋白而加重肺高压[12]。L-Arg是否是通过作用于MPs来缓解肺高压目前尚无报道,这也正是我们这次研究的重点。
本研究显示:L-Arg可以减少PH大鼠体内增高的MPs,但是L-Arg并没有减轻MPs对离体肺血管中eNOS的蛋白表达的下调作用。这一结果说明MPs通过抑制肺动脉血管eNOS的上调而加重肺高压;L-Arg通过为肺动脉血管内皮细胞提供NO底物改善肺高压而减少MPs的数量来缓解MPs对肺高压的加重,但是L-Arg并没有影响MPs的质量。
综上所述,PH时MPs升高,后者损害肺血管eNOS蛋白表达而进一步恶化PH,即:PH→MPs升高→eNOS下降→内皮功能受损→PH升高的恶性循环。L-Arg通过缓解肺高压降低了MPs含量而减轻MPs对肺高压的损害,即:L-Arg→PH降低→MPs数量减少→PH下降的循环。但是L-Arg并没有影响MPs本身对肺血管内皮的损害。我们的研究进一步阐明了L-Arg防治PH的机制,为今后将L-Arg作为防治PH的临床药物提供理论依据。
[1]Grimminger F,Schermuly RT.PDGF receptor and its antagonists:role in treatment of PAH[J].Adv Exp Med Biol,2010,661(6):435-46.
[2]王群让,王旭兰,代晓霞.精氨酸防治肺动脉高压的研究[J].陕西医学杂志,2014,43(9):1115-1117.
[3]常凤军,魏伟,欧志君,等.左旋精氨酸恢复eNOS和iNOS平并制肺动脉高压的研究[J].中华胸心血管外科杂志,2012,28(4):237-240.
[4]Ci HB,Ou ZJ,Chang FJ,et al.Endothelial microparticles increase in mitral valve disease and impair mitral valve endothelial function[J].Am J Physiol Endocrinol Metabol,2013,304(7):E695-702.
[5]Hugel B,Carmen M,Martinez MC,et al.Membrane microparticles:two sides of the coin[J].Physiology,2005,20(1):22-27.
[6]王妍,陶军,涂昌,等.高血压病对内皮微颗粒水平的响[J].中华老年心脑血管病杂志,2006,8(4):222-224.
[7]Hirsch AT.Vascular disease,hypertension and prevention:from endothelium to clinical events[J].JAGG,2003,42(2):377-379.
[8]Tan X,Pan JQ,Li JG,et al.L-Arginine inhibiting pulmonary vascular remodling is associated with promotion of apoptosis in pulmonary arterioles smooth muscle cell in broiler[J].Res Vet Sci,2005,79(3):203-209.
[9]Brogan PA,Dillon MJ.Endothelial microparticles and the diagnosis of the vasculitides1[J].Int Med,2004,43(12):1115-1119.
[10]Sims PJ,Faioni EM,Wiedmer T,et al.Complement proteins C5b-9 cause release of membrane vesicles from the platelet surface that are enriched in the membrane receptor f or coagulation f actor V and express prothrombinase activity[J].J Biol Chem,1988,263(34):18205-18212.
[11]Heijnen HF,Schiel AE,Fijnheer R,et al.Activated platelets release two types of membrane vesicles:microvesicles by surface shedding and exosomes derived from exocyt osis of multivesicular bodies and alphagranules[J].Blood,1999,94(11):3791-3799.
[12]王旭兰.循环微粒对大鼠肺动脉内皮的损害及与肺动脉高压的关系[J].陕西医学杂志,2015,44(1):12-14.

