全脑缺血再灌注后Bad蛋白的表达与细胞凋亡的关系及ERK信号转导途径对其的影响
何家璇,薛荣亮,吕建瑞,吴 刚,雷晓鸣(西安交通大学第二附属医院麻醉科,西安 710004;通讯作者,E-mail:xbyw@163.com)
目前研究认为,脑缺血再灌注损伤仍是多种因素或机制共同或先后作用的结果,其具体机制非常复杂。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员是连接细胞膜表面受体与决定性基因表达之间重要调节酶,对其成员之一细胞外信号调节激酶(extracellular signal regulated kinase,ERK)在脑缺血再灌注损伤中作用的研究结果仍不完全一致,在脑缺血再灌注致神经元凋亡中ERK通路是何作用尚未定论。Bad(Bcl-xL/Bcl-2 associated death promoter,Bad)是 B 细胞淋巴瘤/白血病-2(B-cell leukemia-2,Bcl-2)蛋白家族中的促凋亡蛋白的一员,生理状态下Bad蛋白以磷酸化状态稳定存在,而去磷酸化的游离Bad蛋白通过易位和一系列细胞活动促进凋亡的发生[1-3]。但Bad与ERK信号通路之间的关系如何目前报道甚少。本实验建立大鼠全脑缺血再灌注模型,应用特异性抑制剂对ERK通路进行干预,检测磷酸化ERK和磷酸化Bad的表达变化及与神经细胞凋亡的关系,探讨ERK对全脑缺血再灌注损伤后大鼠神经元凋亡的作用及对凋亡调控蛋白Bad的影响。
1 材料与方法
1.1 材料与试剂
小鼠抗磷酸化Bad(Ser112)单克隆抗体(Cell Signaling Technology公司,美国),兔抗ERK单克隆抗体(Cell Signaling Technology公司,美国),PD98059(Cell Signaling Technology公司,美国),TUNEL试剂盒购自德国宝灵曼公司,SP法免疫组化试剂盒购自北京中山生物技术公司。
1.2 动物分组及模型的建立
选用健康雄性SD大鼠90只,由西安交通大学医学院动物中心提供,体重为(300±20)g。随机分成三组,假手术组(sham,n=30)、全脑缺血再灌注组(IR,n=30)和 PD98059干预组(sham,n=30),每组各设6个时间点,分别为再灌注后2,6,12,24,48,72 h,每组各时间点均为5只。采用大鼠四血管结扎法建立全脑缺血模型,大鼠全脑缺血5 min后进行再灌注。IR组:所有动物均以1%戊巴比妥钠40 mg/kg行腹腔内注射麻醉,待翻正反射消失后俯卧固定于手术台上,在大鼠枕颈正中切开皮肤显露枕后三角,在显微镜下于枕后三角外侧与第一横突之间找到椎动脉博动后,以25 mV电凝器凝断双侧椎动脉,逐层缝合,术毕回笼,使其体温维持37℃左右。24 h后先将大鼠经尾静脉注射生理盐水(每只鼠给予0.3 mg/kg),20 min后进行夹闭颈总动脉处理。以同样方法麻醉,在胸锁乳突肌后气管旁,显露颈总动脉,用无创动脉夹同时夹闭5 min,期间密切观察其瞳孔变化,无瞳孔散大者予以剔除,逐层缝合后回笼,分别于再灌注后 2,6,12,24,48,72 h 以4%多聚甲醛灌注处死。PD组:将SD大鼠经尾静脉注射抑制剂PD98059(每只鼠给予0.3 mg/kg)20 min后进行夹闭颈总动脉处理,其他操作同IR组。sham组:除不凝断椎动脉和夹闭颈总动脉外,其他处理同IR组。
1.3 组织学检查
在再灌注后 2,6,12,24,48,72 h 各时点麻醉大鼠,于剑突下横向剪开腹壁显露膈肌,将其沿胸壁左右向剪开,将胸前壁离断掀起,显露心脏,用9号针从心尖插入心室,剪开右心房,先用生理盐水然后再用4%多聚甲醛200 ml灌注至肝脏变白、四肢僵硬,断头取脑,在视交叉后1 mm及4 mm处冠状切面切开,取中间块,固定后石蜡包埋,在海马齿状回互包平面连续冠状切片,片厚4 μm。HE染色光镜(×400)观察海马CA1/CA3区神经元细胞形态。
1.4 TUNEL 染色
采用德国宝灵曼公司的TUNEL试剂盒染色,参照试剂盒方法并做部分修改,同时设立阳性(加DNaseⅠ,1 mg/L)和阴性对照(不加TdT)组。光镜观察显示细胞核有明显的黄棕色颗粒或斑片为阳性细胞,即凋亡细胞。定量分析方法为:光镜下计算凋亡指数(apoptosis index,AI)。计算方法:每只动物随机两张切片,每张切片观察CA1或CA3区,分别计算各区凋亡细胞数和总细胞数:AI=凋亡细胞数/总细胞数×100%。
1.5 免疫组化染色
鼠抗磷酸化Bad单克隆稀释度为1∶150,兔抗ERK单克隆稀释度为1∶100。等稀释度的兔抗IgG做阴性对照。切片依次脱蜡至水,3%过氧化氢孵育10 min,三蒸水洗5 min×3次。PBS(pH 7.4)浸泡5 min,微波炉抗原修复15 min。自然冷却至室温。滴加封闭血清,室温孵育1 h,倾去勿洗。滴加1∶100的p-ERK、p-Bad抗体,放入4℃冰箱过夜。PBS冲洗5 min×3,擦干组织周围水分,滴加生物素标记的二抗,60℃孵育30 min;三蒸水洗5 min×3次,擦净切片周围水分后,滴加辣根酶标记链霉卵白素工作液,放入37℃温箱孵育20 min。三蒸水洗5 min×3次,DAB显色,脱水、透明、封片。
1.6 图像分析
切片采用Leica Qunatimet570图像分析系统进行图像分析。取每张切片CA1区、CA3区各测5个相同单位面积取平均灰度值。灰度值越高则表达越弱。
1.7 统计学处理
2 结果
2.1 HE染色观察神经元细胞形态
高倍镜下各时点可见假手术组大鼠海马锥体细胞排列整齐,形态完整;缺血组神经元细胞肿胀,分布不均,细胞周围间隙增宽,有的细胞体积缩小,核固缩深染。PD组神经元细胞结构模糊,细胞间质水肿明显。
2.2 TUNEL染色检测神经元细胞凋亡
TUNEL法检测发现IR组在缺血再灌注后6 h凋亡细胞开始增加,主要位于CA1区,24-48 h为高峰,至72 h明显减少。各时间点CA1区凋亡细胞数多于CA3区(P<0.05)。PD组于各时间点各区凋亡细胞计数多于IR组(P<0.05,见表1)。
表1 SD大鼠缺血再灌注后各时点CA1区和CA3区凋亡指数(±s,%)Table 1 Apoptosis index in CA1 and CA3 of SD rats after ischemia reperfusion(±s,%)

表1 SD大鼠缺血再灌注后各时点CA1区和CA3区凋亡指数(±s,%)Table 1 Apoptosis index in CA1 and CA3 of SD rats after ischemia reperfusion(±s,%)
与 sham 组比较,*P <0.05;与 IR 组比较,ΔP <0.05;与 CA1比较,#P <0.05
组别2 h 6 h 12 h 24 h 48 h 72 h CA1区sham 组 0.25 ±0.50 1.49 ±0.67 1.51 ±0.65 1.57 ±0.78 2.14 ±0.48 1.65 ±0.63 IR 组 2.54 ±0.38 14.42 ±4.25* 29.24 ±6.08* 41.32 ±7.30* 38.94 ±7.32* 21.36 ±5.07*PD 组 5.63 ±0.84 29.76 ±5.13*Δ 43.57 ±7.11*Δ 60.08 ±7.68*Δ 53.31 ±7.36*Δ 31.06 ±6.56*Δ CA3区sham 组 0.25 ±0.50 1.49 ±0.67 1.51 ±0.65 1.57 ±0.78 2.14 ±0.48 1.65 ±0.63 IR 组 1.33 ±0.29 9.05 ±3.12*# 20.57 ±6.08*# 33.75 ±6.12*# 30.13 ±6.34*# 15.03 ±4.22*#PD 组 4.04 ±0.70 23.32 ±6.02*Δ# 31.26 ±6.10*Δ# 49.87 ±7.26*Δ# 42.82 ±7.21*Δ# 22.64 ±6.10*Δ#
2.3 免疫组化染色检测p-ERK及p-Bad的表达
p-ERK染色阳性表达于细胞核内,呈现浅棕黄色颗粒状。p-ERK在sham组各时点海马CA3区细胞核内无表达,胞质内极少表达,CA1区表达弱于CA3区(P<0.05,见表2);IR组各时点在海马CA1区p-ERK均未见表达,CA3区于再灌注后2 h可见细胞核内有微弱的表达,于再灌注6 h后逐渐下降,至再灌注后48 h未见表达。PD组CA1区、CA3区均未见着色。
p-Bad在sham组各时间点可见表达;IR组于再灌注后2 h在CA3区可见p-Bad表达,之后逐渐减弱,再灌注后24 h后未见,CA3区表达均强于CA1区(P<0.05);IR组各时间点表达均弱于sham组(P<0.05);PD组p-Bad各时间点表达均弱于IR组(P<0.05),再灌注后2 h及6 h可见微弱表达,之后时间点未见表达,CA3区表达均强于CA1区(P <0.05,见表3)。

表2 SD大鼠缺血再灌注后各时点CA1区和CA3区p-ERK灰度值Table 2 The p-ERK gray value in CA1 and CA3 of SD rats after ischemia reperfusion
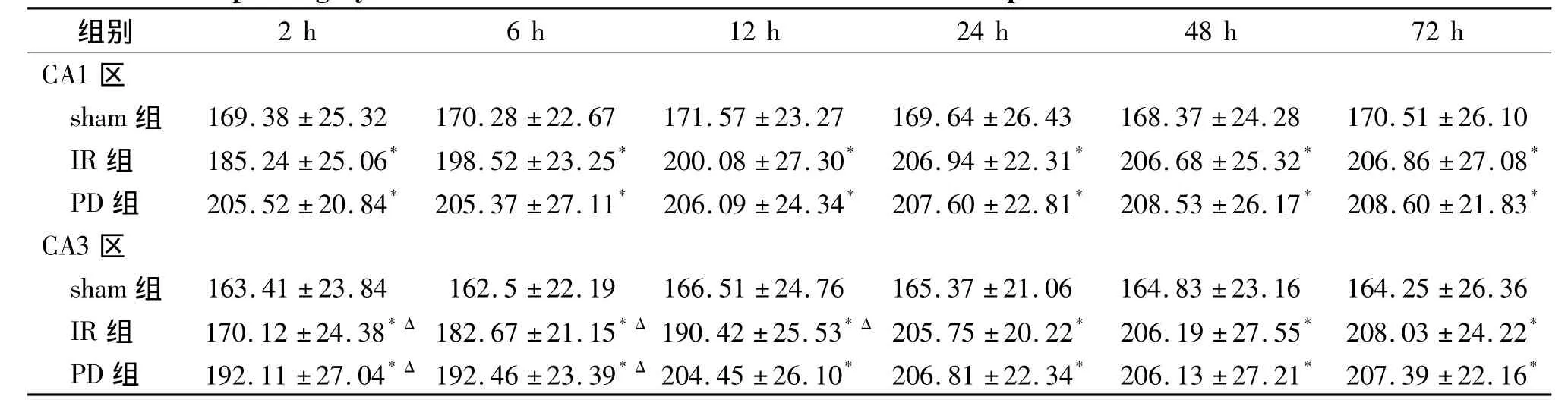
表3 SD大鼠缺血再灌注后各时点CA1区和CA3区p-Bad灰度值Table 3 The p-Bad gray value in CA1 and CA3 of SD rats after ischemia reperfusion
3 讨论
MAPK家族成员是哺乳动物细胞内一组进化保守的细胞信号转导酶类,作为重要的信号传递途径之一,其连接细胞膜表面受体与决定性基因的表达,被认为是任何胞外刺激由胞外向胞内转导的跨膜信号通路的交汇点。ERK是MAPK家族的一员,引起ERK激活的细胞外信号主要是生长因子等有丝分裂刺激,它的信号传递途径是涉及调节细胞生长、发育及分裂的信号网络的核心。研究表明ERK途径在多种疾病包括脑缺血再灌注损伤过程中发挥着重要作用。迄今为止,在重要脏器的缺血/再灌注损伤研究中,均发现在损伤早期伴有ERK蛋白激酶的激活。但其在脑缺血中的表达及作用研究结果不一。PD98059是作用于ERK通路中ERK上游的蛋白激酶MEK(MAPK/ERK激酶)的特异性抑制剂,其特异性地抑制ERK的磷酸化而阻断此通路的细胞信号转导。
脑缺血再灌注损伤可诱导神经元凋亡[4-7],并激活一些基因及其表达产物,通过对促细胞凋亡基因和抑制细胞凋亡基因的调控发挥作用。从目前巳知的细胞凋亡机制看,线粒体功能异常是重要的通路,而该通路与Bcl-2家族蛋白有着密切关系[8]。在凋亡诱导因素的刺激下,细胞的跨膜或者胞内信号通路将被启动,此时相对线粒体来说,Bad蛋白的磷酸化和非磷酸化将成为一个检查点(check piont)。线粒体膜表面分别存在着Bax同型二聚体,非磷酸化的Bad将直接导致Bax的单聚化,从而形成线粒体的Ca2+内流和细胞色素C外流的交换通道,这将导致膜电势降低、ATP形成不足及下游的caspapse活化[9];而磷酸化的Bad则可能诱导Bax的单聚化,从而失去作为凋亡诱导信号的功能[10]。据报道[11],地塞米松刺激下,ERK通路被显著抑制。其结果是,Bcl-2等抗凋亡活性蛋白失去ERK的磷酸化激活,从而加速了凋亡过程的发生,且由于Bad蛋白不能被磷酸化,故导致下游的线粒体膜电势的崩溃和ATP形成不足,内质网等Ca2+库不能维持正常的功能,游离Ca2+流入胞质,从而诱发细胞凋亡。
Bad是Bcl-2蛋白家族中的促凋亡蛋白的一员,正常生理状态下磷酸化的Bad与其分子伴侣蛋白14-3-3结合组成无活性的复合物[8,9]。接受凋亡刺激后,Bad去磷酸化,去磷酸化的Bad与分子伴侣蛋白解离,Bad从构成性结合的Bcl-XL-Bax二聚体中置换并释放促凋亡的Bax[3],Bax移位到线粒体,促使线粒体释放cytC,引起caspase级联反应导致细胞凋亡[11]。总之,稳定状态的磷酸化Bad蛋白发挥抗凋亡效应,而去磷酸化的游离Bad蛋白通过易位和一系列细胞活动促进凋亡的发生。
本实验结果显示,脑缺血再灌注后ERK在SD大鼠海马缺血耐受区CA3区表达而缺血敏感区CA1区未见表达,应用ERK通路抑制剂后,CA1区凋亡神经细胞数目增加,同时发挥抗凋亡效应的磷酸化Bad蛋白在CA1区表达减弱,这一结果更加支持了ERK信号转导通路的抗凋亡作用。王耀岐等[13]实验发现5 min脑缺血使对缺血敏感的海马CA1区p-JNK表达增加,p-ERK无明显表达,CA3区存活的神经元上有p-ERK的表达,而p-JNK的表达较弱,他们认为CA1区缺乏保护信号而增强有害信号的表达可能是脑缺血后神经元延迟性死亡的重要机制。我们研究结果与此一致,提示ERK可能参与了脑缺血后的细胞保护,因此缺血敏感的CA1区缺乏保护性信号,应用抑制剂后保护性信号表达更加减少,凋亡细胞增加;对缺血耐受的CA3区保护性信号表达强于CA1区,应用抑制剂后保护性信号表达也减轻。Hu等[14]用 Western blot和激光共聚焦显微镜在大鼠脑缺血模型上观察15 min脑缺血后MAPK的活性变化,发现缺血再灌注后30 min和4 h在耐受缺血的CA3/DG区细胞核有p-ERK表达,在死亡的CA1区神经元无表达。而JNK的底物c-Jun却在CA1区选择性表达,提示ERK参与缺血后的细胞保护,JNK介导了神经元损伤。我们的研究结果也与这些报道一致。ERK激活后通过信号传导,活化细胞核内不同的转录调节因子,进而使细胞出现增殖、分化或凋亡。本实验中IR组较sham组ERK表达增强,也提示我们缺血再灌注后ERK活性的增加参与了促进细胞存活的保护性机制,可能是缺血刺激引起的胶质细胞释放生长因子等机制所致。
综上所述,通过本研究我们认为ERK通路参与了缺血后神经元的保护,是脑缺血再灌注时神经元的存活通路;特异性抑制剂使得ERK通路发生变化并影响凋亡调控蛋白Bad的表达,抗凋亡效应的磷酸化Bad蛋白表达减少,也从另一方面说明ERK参与了缺血后神经元的保护。磷酸化ERK和磷酸化Bad在抑制剂组表达下降且变化一致,同时细胞凋亡增加并达到高峰,说明ERK信号通路可能通过抑制Bad的磷酸化抗凋亡形式向去磷酸化促凋亡形式的转变,参与到细胞凋亡的线粒体途径中发挥抗调亡机制,参与脑缺血再灌注时神经细胞的保护。
[1]Datta SR,Dudek H,Tao X,et al.Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery[J].Cell,1997,91(2):231-241.
[2]Tan Y,Demeter MR,Ruan H,et al.BAD Ser-155 phosphorylation regulates BAD/Bcl-XL interaction and cell survival[J].J Biol Chem,2000,275(33):25865-25869.
[3]Yang E,Zha J,Jockel J,et al.Bad,a heterodimeric partner for Bcl-XL and Bcl-2,displaces Bax and promotes cell death[J].Cell,1995,80(2):285-291.
[4]薛荣亮,纪娜,高静,等.茶多酚对大鼠全脑缺血再灌注损伤的影响[J].中华麻醉学杂志,2011,31(9):1117-1119.
[5]吴刚,薛荣亮,吕建瑞,等.全脑缺血再灌注后Fas、TNFR1蛋白的表达与细胞凋亡的关系及Bcl-2过度表达对其的影响[J].中华麻醉学杂志,2011,31(8):1298-1303.
[6]赵紫玉,薛荣亮,吕建瑞,等.急性等容量血液稀释对大鼠全脑缺血再灌注时海马组织细胞凋亡的影响[J].中华麻醉学杂志,2012,32(2):201-203.
[7]曹瑞琪,李雪卿,吴文浩,等.酸敏感离子通道在大鼠全脑缺血再灌注损伤中的作用[J].中华麻醉学杂志,2011,31(1):108-111.
[8]Gross A,Mc Donnell JM,Korsmeyer SJ.Bcl-2 family members and the mitochondria lcomplex that integrates glycolysis and apoptosis[J].Genes Dev,1999,13(15):1899-1991.
[9]Danial NN,Gramm CF,Scorrano L,et al.BAD and glucokinase reside in a mitochondrial complex that integrates glycolysis and apoptosis[J].Nature,2003,424(6951):952-956.
[10]Datta SR,Ranger AM,Lin MI,et al.Survival factor mediated BAD phosphorylation raises the mitochondrial threshold for apoptosis[J].Dev Cell,2002,3(5):631-643.
[11]马莲环,刘建.ERK1/2的研究进展[J].国外医学生理、病理科学与临床分册,2005,25(3):279-282.
[12]Wei MC,Zong WX,Cheng EH,et al.Proapoptotic BAX and BAK:a requisite gateway to mitochondrial dysfunction and death[J].Science,2001,292(5517):727-730.
[13]王耀岐,李军,曹红,等.ERK和JNK通路在沙土鼠脑缺血预处理中的表达及作用[J].中国药理学通报,2006,22(3):337-340.
[14]Hu BR,Liu CL,Park DJ.Alteration of MAP kinase pathways after transient forebrain ischemic[J].J Cereb Blood Flow Metab,2000,20(7):1089-1095.

