哺乳动物雷帕霉素靶蛋白结构与信号通路研究进展
李 欣
(成都大学体育学院,四川 成都610600)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)可以感受细胞所处环境的营养状态和能量状态,是一个高度保守的丝氨酸/苏氨酸激酶,是细胞营养状态、能量状态的传感器,它处于PI3K/Akt信号通路的下游,能感受并整合经PI3K信号通路传递的生长因子信号,在调节细胞生长和细胞周期中起非常关键的作用[1].目前的研究表明,其调节作用主要集中在以下几个方面:(1)通过影响p70S6K的活性而调控核糖体的生成;(2)通过改变4E-BP1的磷酸化状态而调控翻译起始复合物的功能;(3)通过影响真核延伸因子-2激酶,而调控多肽链的延伸[2].
1 结构
在酿酒酵母中发现两种可被雷帕霉素抑制的基因:TOR1和TOR2,其编码的雷帕霉素靶蛋白是一种高度保守的大分子蛋白,可以抵抗免疫亲和蛋白-免疫抑制剂复合物(FKBP-雷帕霉素)的生长抑制效应.TOR1和TOR2基因编码两种分子量为280道尔顿,相似度70%的TOR1和TOR2蛋白,其哺乳动物直向同源物为mTOR,mTOR蛋白与酵母TOR相比,其氨基酸序列有42%的相似,蛋白包括2 549个氨基酸和几个保守的结构功能域.N端包括20个连续的由37-47个氨基酸残基组成的HEAT重复序列,分为两簇,构成一对反向平行α-螺旋结构,调节复合蛋白质中蛋白与蛋白间的亲和力[3].
TOR蛋白在C端有一个与PI3K和肌醇磷脂4位激酶高度同源的催化功能域,其相关蛋白家族成员包括:MEC1、TEL1、RAD3、MEI-41、DNA-PK、ATM、ATR和TRRAP..这些蛋白的C端都有一个同源的磷脂酰肌醇激酶功能域,因此被称为PI3K-相关激酶蛋白家族.但mTOR从功能上看是还是一种丝氨酸/苏氨酸蛋白激酶,它还包括一个FKBP-雷帕霉素结合功能域(FRB),该功能域可以出现氨基酸替换,阻止FKBP-雷帕霉素复合物与mTOR的结合,在FRB和催化功能域间存在一个约为500氨基酸序列的FAT功能域,起到支架或蛋白-蛋白作用功能域的作用.在C端还含有一个大约35个氨基酸的延伸序列:FATC功能域,该功能域为mTOR活性所必需,去除任意一个该功能域的氨基酸都会使mTOR活性丧失[4],FATC和FAT相互作用可产生催化功能,在两个功能域间,可能还存在一个阴性调节功能域NRD.其具体结构见图1[3].
在哺乳动物体内,mTOR一般以两个功能不同的复合物形式存在:mTORC1和mTORC2[5].mTORC1时,mTOR与两个高度保守的蛋白质Raptor和G蛋白β亚基样蛋白结合,Raptor是种进化保守的分子量为150道尔顿,其与mTOR的HEAT功能域,以及p70S6K和4E-BP1上的TOR信号模序结合.Raptor可通过稳定mTOR的正确折叠,或作为支架蛋白将底物募集到激酶功能域附近,或通过调节mTOR的细胞内定位来介导mTOR对营养物质的感受[6].Raptor和mTOR之间的相互作用需要G蛋白β亚基样蛋白(G protein β-subunit-like protein,GβL),其是另一种mTOR的结合蛋白,分子量为36道尔顿,含有7个WD-40重复序列,可直接结合到mTOR的催化功能域,参与mTOR对氨基酸水平的感受.mTORC2时,mTOR与Rictor、mSIN1和GβL形成复合物.mTORC2最有特性的功能是可以磷酸化Akt的丝氨酸残基473,而该残基正是Akt磷酸化mTORC1的位点,且Akt的转角基序苏氨酸残基450也需要mTORC2的磷酸化,因此,在Akt信号通路中,mTORC2位于Akt的上游,而mTORC1则位于Akt的下游[7].
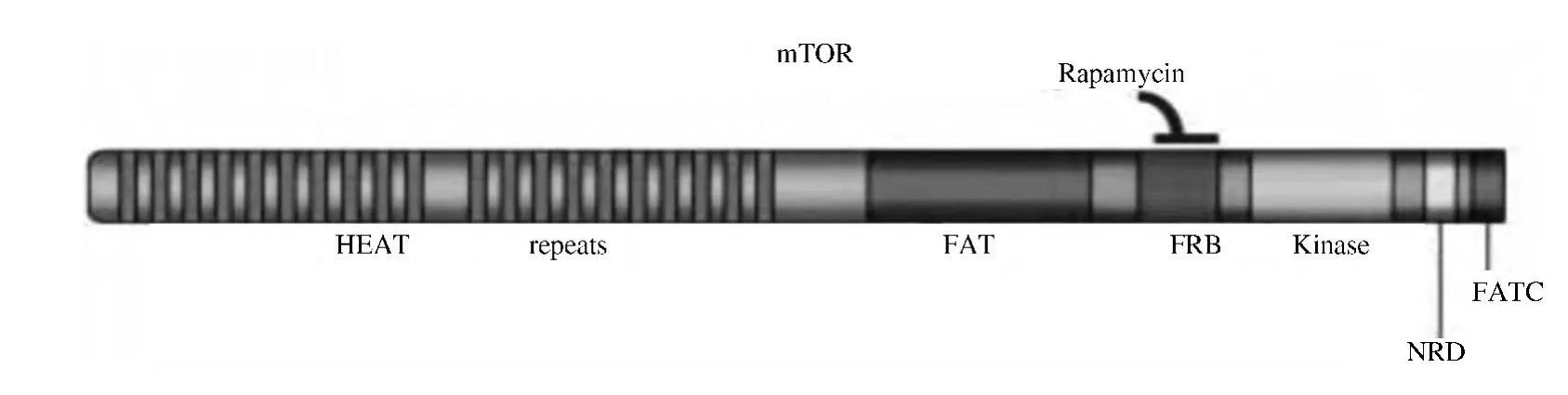
图1 mTOR结构示意图
2 mTOR的上游调节因子
2.1 营养物质对mTOR的调节
当TOR1和TOR2蛋白从出芽酵母中提取出来时,也发现了与它们结合的蛋白质:AVO1、AVO2、AVO3、LST8和KOG1.AVO1、AVO2、AVO3只和TOR2结合,而LST8和KOG1则可与TOR1或TOR2任意单独的结合.其结合不受雷帕霉素或营养剥夺的影响.但当mTOR-Raptor结合后,营养环境对mTOR与底物结合并磷酸化的能力有显著影响,在存在雷帕霉素或营养剥夺时,mTOR基因的细胞周期停留在G0期,mTOR-GβL-Raptor与底物的结合能力丧失;而当营养充裕时,Raptor与mTOR的底物间的亲和力增加.值得注意的是,雷帕霉素可以导致Raptor与mTOR间的解离,而营养剥夺则不会.
细胞内的氨基酸水平也可以调节mTOR的活性,其中亮氨酸的作用最为显著[8].亮氨酸浓度的增高可以通过Rheb和AMKP,而不是生长因子信号通路来增加mTOR的活性,但其控制mTOR活性的具体机制尚不明了,现有证明表明这可能与线粒体代谢变化相关[9].mTOR也可通过调节氨基酸透酶的活性来调节细胞内的氨基酸浓度.ATP浓度下降或线粒体功能失调会激活AMKP,从而抑制mTOR表达[10].在缺氧或低血糖时,细胞内升高的腺苷单磷酸活化蛋白通过变构作用激活AMKP,磷酸化其下游靶因子,抑制mTOR,降低ATP的消耗.AMPK也可磷酸化mTOR的负调控因子TSC2,而减弱mTOR表达.
2.2 PI3K
mTOR的活性可被生长因子调节,胰岛素和其他生长因子可显著增加mTOR敏感型的S6K和4EBP1的磷酸化程度.PI3K的激活可以使4E-BP1因胰岛素引起的磷酸化程度达到最大,当使用PI3K抑制剂渥曼青霉素和LY294002时,S6K和4EBP1的磷酸化程度降低,这些证据表明生长因子引起的mTOR的激活须经PI3K介导,即PI3K是mTOR上游的正性调节因子[11].在HEK-293细胞株中,过表达的PI3K催化亚基-p110可以在缺乏生长因子或胰岛素时,导致4EBP1的磷酸化,负性调节亚基P85的过表达能抑制胰岛素诱导的S6K的磷酸化.这些结果与PTEN缺乏后细胞中4E-BP1和p70S6K高水平磷酸化的变化是一致的.
2.3 Akt
丝氨酸-苏氨酸蛋白激酶Akt是PI3K的下游效应物,在调节mTOR活性中具有重要作用.哺乳动物细胞表达三种由不同基因编码的Akt蛋白.Akt激活的限速步骤包括PH功能域与PI3K结合-异位至细胞膜-被PDK1磷酸化.HEK-293细胞株中过表达的完全激活形式的Akt可以在缺乏生长因子和存在渥曼青霉素时,提高4E-BP1的磷酸化程度.而具有显性负效应的Akt可以损坏胰岛素诱导的4E-BP1的磷酸化.这些表明Akt是mTOR的上游调控因子[12].当缺乏Akt1和Akt2时,p70S6K的磷酸化下降程度少于4E-BP1,提示p70S6K的磷酸化主要依赖于Akt3,而4E-BP1的磷酸化更依赖于Akt3.但一些实验对Akt作为mTOR上游正性调节因子的地位表示了怀疑:在哺乳动物细胞中p70S6K的磷酸化与Akt的活性并不总是保持一致;Akt作用于mTOR的机制仍不明了,mTOR拥有两个临近的磷酸化位点,苏氨酸残基2446和丝氨酸残基2448,Akt可磷酸化丝氨酸残基2448,而这两个残基均位于mTOR的负性调节功能域中,且这两个氨基酸被丙氨酸替换后对mTOR的活性没有影响.
2.4 TSC1/TSC2
结节性硬化症的的错构瘤蛋白和结节蛋白是由结节性硬化症中肿瘤抑制突变基因TSC1和TSC2编码的,这两种蛋白质通过N端连接,组成一个异二聚体复合物,形成一个抑制mTORC1活性的功能单位,是mTOR的上游负调控因子.该二聚体缺乏时,p70S6K和4E-BP1的磷酸化程度均增高,可产生与PTEN突变相似的细胞和器官体积增大的效果,而该二聚体过表达时,p70S6K和4E-BP1的磷酸化程度均降低.TSC2含有一个GTP酶激活蛋白(GAP)的功能域域,刺激小G蛋白Rheb内在的GTP酶活性,从而使Rheb转化为GDP结合的灭活状态.而当Rheb是GTP结合状态时,它可激活mTORC1.在受到生长因子作用时,活化的Akt可以直接磷酸化TSC2的氨基酸残基,而使其失去抑制Rheb作用的活性来激活mTOR.但过表达的TSC2发生α替代变异时,可阻断Akt介导的mTORC1的激活.这些表明Akt介导的TSC2的磷酸化对调节mTORC1活性十分重要[13].Rheb是TSC2GTP酶的一个直接底物.营养丰富时,Rheb处于活化状态,与GTP结合,并与包括mTOR在内的多种蛋白发生作用.而营养缺乏时,TSC2的GTP酶激活蛋白域诱导Rheb水解失活形成Rheb-GDP,从而抑制mTOR活性.总之,Rheb是位于TSC1/TSC2复合物下游,mTOR的正调控因子.同时,TSC2是细胞内AMP/ATP比例感受器AMPK的直接底物,ATP水平下降时,磷酸化状态的AMPK能磷酸化并激活TSC2,从而通过Rheb抑制mTOR信号[14].
3 mTOR的下游效应物
mTOR受氨基酸或生长因子刺激时,可以经激活p70S6K和抑制4EBP-1来控制翻译起始,p70S6K的激活可以导致核糖体蛋白S6的磷酸化,从而使5'TOP mRNAs翻译,这种mRNA含有大量的转录产物,可以编码大部分的核糖体蛋白和翻译元件.因此,通过控制5'TOP mRNAs翻译,mTOR上调了翻译效率.4EBP-1是翻译抑制物,可被mTOR磷酸化灭活,从而与eIF4E脱离,eIF4E可与帽结构结合,开始帽依赖性翻译.
3.1 4E-BPs
eF4E和eIF4G的相互作用受4E-BPs调控,哺乳动物的4E-BPs是由3种不同的基因编码而成的低分子量蛋白:4E-BP1、4EB-P2和4E-BP3.低磷酸化的4E-BPs与eIF4E有着高度的亲和力,而高磷酸化的4E-BPs则不与eIF4E作用[15].4E-BPs的磷酸化位点包括:苏氨酸残基37、苏氨酸残基46、丝氨酸残基65、苏氨酸残基70、苏氨酸残基83、丝氨酸残基101和丝氨酸残基112.4E-BPs从eIF4E上脱落时,其残基磷酸化按苏氨酸残基37、苏氨酸残基46、丝氨酸残基65、苏氨酸残基70的顺序进行.mTOR只磷酸化丝氨酸残基65时,4E-BP1无法与eIF4E分离,但当用一个氨基酸去替代丝氨酸残基65时,会大大减弱4E-BP1与eIF4E的结合,因此其余残基的磷酸化协同会加快4E-BP1与eIF4E的解离.
3.2 p70S6K
哺乳动物细胞含有两种由不同基因编码的S6激酶,S6激酶调节细胞生长,是TOR蛋白的直接靶物质,S6激酶通过作用于其直接下游效应因子S6蛋白,增加mRNA的翻译效率来控制细胞生长.S6蛋白的磷酸化与5‘TOP mRNA的翻译效率相关,但目前的研究表明S6蛋白并不是调节5‘TOP mRNA翻译的唯一因子.eIF4B也是S6K的靶物质,eIF4B对RNA解旋酶eIF4A具有调节作用,其丝氨酸残基422是S6K的特异性磷酸化位点,因此eIF4B可能是S6K在翻译和细胞生长中的重要调节因子,由于eIF4B能帮助eIF4A打开RNA的二级结构,所以eIF4B的磷酸化程度增强能提高具有二级结构的mRNA的翻译效率.
3.3 eIF4G
eIF4G是一个支架蛋白,在组装核糖体起始复合物中起着关键作用.eIF4G包括eIF4G1和eIF4G2,均包括三个通过铰链区连接的功能和结构域.两者都是磷蛋白,但他们的磷酸化调节方式不同,当受到血清、胰岛素和生长因子的刺激时,eIF4G1的磷酸化程度高于eIF4G2,eIF4G1包括两簇磷酸化位点,一个位于N端的丝氨酸残基314,另一个在蛋白中间的铰链区,包括丝氨酸残基1148、1188和1232,对PI3K和mTOR抑制剂敏感.当eIF4G被mTOR磷酸化时,发生构象改变,活性增加[16].
3.4 真核延伸因子-2激酶
mTOR对翻译的调节中还存在其它靶蛋白:真核生物延伸因子-2激酶.真核延伸因子-2苏氨酸残基56的磷酸化可导致失活,雷帕霉素能通过对真核延伸因子-2激酶的影响来抑制真核延伸因子-2的去磷酸化.雷帕霉素磷酸化真核延伸因子-2激酶的位点为丝氨酸残基78位,359和366[17].
4 研究展望
mTOR不仅在细胞生长中控制mRNA翻译,调控蛋白质合成,而且还参与刺激基因的转录过程.营养物质充足时,mTOR能通过将一些受营养调控的转录因子滞留在细胞质中,从而抑制这些饥饿特异性基因的转录.通过对转录因子STAT3一级结构的研究发现,其存在TOR识别基序(TOR signaling),提示其可能被Raptor募集,而后被mTOR磷酸化.目前的研究已证实聚合酶I特异性转录因子上游结合因子UBF和转录起始因子1A也是受mTOR调节的靶物质.mTOR可以通过UBF来刺激rRNA的转录.
[1] Foster KG,Fingar DC.Mammalian target of rapamycin(mTOR):conducting the cellular signaling symphony[J].J Biol Chem,2010,285(19):14071-7.
[2] Hay N,Sonenberg N.Upstream and downstream of mTOR[J].Genes Dev,2004,18(16):1926-45.
[3] Schmelzle T,Hall MN.TOR,a central controller of cell growth[J].Cell,2000,103(2):253-62.
[4] Takahashi T,Hara K,Inoue H,et al.Carboxyl-terminal region conserved among phosphoinositide-kinase-related kinases is indispensable for mTOR function in vivo and in vitro[J].Genes Cells,2000,(9):765-75.
[5] Huang J,Manning BD.A complex interplay between Akt,TSC2 and the two mTOR complexes[J].Biochem Soc Trans,2009,37(Pt 1):217-22.
[6] Kim DH,Sarbassov DD,Ali SM,et al.GbetaL,a positive regulator of the rapamycin-sensitive pathway required for the nutrient-sensitive interaction between raptor and mTOR [J].Mol Cell,2003,11(4):895-904
[7] Wullschleger S,Loewith R,Hall MN.TOR signaling in growth and metabolism[J].Cell,2006,124(3):471-84.
[8] Kimball SR,Jefferson LS.Molecular mechanisms through which amino acids mediate signaling through the mammalian target of rapamycin [J].Curr Opin Clin Nutr Metab Care,2004,7(1):39-44.
[9] Xu G,Kwon G,Cruz WS,et al.Metabolic regulation by leucine of translation initiation through the mTOR-signaling pathway by pancreatic beta-cells[J].Diabetes,2001,50(2):353-60.
[10] Gleason CE,Lu D,Witters LA,et al.The role of AMPK and mTOR in nutrient sensing in pancreatic beta-cells[J].J Biol Chem,2007,282(14):10341-51
[11] Brunn GJ,Williams J,Sabers C,et al.Direct inhibition of the signaling functions of the mammalian target of rapamycin by the phosphoinositide 3-kinase inhibitors,wortmannin and LY294002 [J].EMBO J,1996 ,15(19):5256-67.
[12] Kroczynska B,Kaur S,Platanias LC.Growth suppressive cytokines and the AKT/mTOR pathway[J].Cytokine,2009,48(1-2):138-43.
[13] Inoki K,Li Y,Zhu T,et al.TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signaling[J].Nat Cell Biol,2002,4(9):648-57.
[14] Huang J,Manning BD.A complex interplay between Akt,TSC2 and the two mTOR complexes[J].Biochem Soc Trans,2009,37(Pt 1):217-22.
[15] Niedzwiecka A,Marcotrigiano J,Stepinski J,et al.Biophysical studies of eIF4E cap-binding protein:recognition of mRNA 5'cap structure and synthetic fragments of eIF4G and 4E-BP1 proteins[J].J Mol Biol,2002 ,319(3):615-35.
[16] Long X,Spycher C,Han ZS,et al.TOR deficiency in C.elegans causes developmental arrest and intestinal atrophy by inhibition of mRNA translation [J].Curr Biol,2002,12(17):1448-61.
[17] Browne GJ,Proud CG.A novel mTOR-regulated phosphorylation site in elongation factor 2 kinase modulates the activity of the kinase and its binding to calmodulin [J].Mol Cell Biol,2004 ,24(7):2986-97.
——雷帕霉素

