InraPorc模型和NRC模型中猪的氨基酸需要量
Jaap van Milgen, Jean-Yves Dourmad
(1.INRA,UMR1348 Pegase,35590 Saint-Gilles,France;2.Agrocampus Ouest,UMR1348 Pegase,35590 Saint-Gilles,France)
1 InraPorc模型中生长猪的氨基酸需要
生长猪蛋白沉积是氨基酸需要量的主要决定因素。氨基酸需要量以及采食量决定日粮中氨基酸的推荐量。然而,蛋白沉积和采食量在生长期间会改变,在日粮中氨基酸的需要量大致上由蛋白质的沉积曲线和采食量曲线决定,模型使用者需要提供这些信息才能获得精确的氨基酸需要预测评估。由于身体内蛋白质和水分有很强的相关性,因此体内蛋白质和体重之间的相关关系也很强。根据使用者提供的一系列体重和采食量数据 (生长育肥期至少3个数据),软件能画出饲料采食量和蛋白质的沉积曲线。蛋白质沉积曲线通过3个模型因子描述:初始蛋白量(与初始体重密切相关)、生长期日均蛋白质沉积量(与日增重密切相关)、一个“成熟”指标(表示动物是早熟或者晚熟)。根据此沉积曲线和所沉积蛋白质的氨基酸组成(表1),可以得到氨基酸的沉积曲线。
InraPorc模型中赖氨酸最大沉积效率为72%,意味着沉积1 g赖氨酸至少需要1.39 g赖氨酸,即使赖氨酸是动物的第一限制性氨基酸,也有0.39 g被动物降解。Moughan(1998)将之称为“代谢必需量”,代表分解代谢从未完全关闭。各种氨基酸的最大沉积效率不可能完全相同。其他氨基酸的最大沉积效率通过赖氨酸的最大沉积效率和理想蛋白模型在后台计算出来(表1)。事实上,关于氨基酸的最大沉积效率的资料鲜见报道。
从表1中可以看出,不同氨基酸的最大沉积效率差别非常大。沉积效率最大的氨基酸为精氨酸,超过100%,说明精氨酸能在猪体内合成。组氨酸的最大沉积效率也相当高,但这在生物学上是不是现实可行的还不知道。由于这些沉积效率是通过理想蛋白质组成计算得到的,理想蛋白组成的错误数据也会导致不正确的沉积效率。如,在IraPorc模型的初始版本中,标准回肠消化率(SID)异亮氨酸和赖氨酸比为60%,与之对应的异亮氨酸的最大沉积效率为60%。但相关研究表明SID异亮氨酸和赖氨酸比高于60%(Gloaguen等,2013;Barea 等,2009)。 SID 异亮氨酸和赖氨酸比应用55%(保守值)之后,相应的异亮氨酸最佳沉积效率就变为67%(表1)。
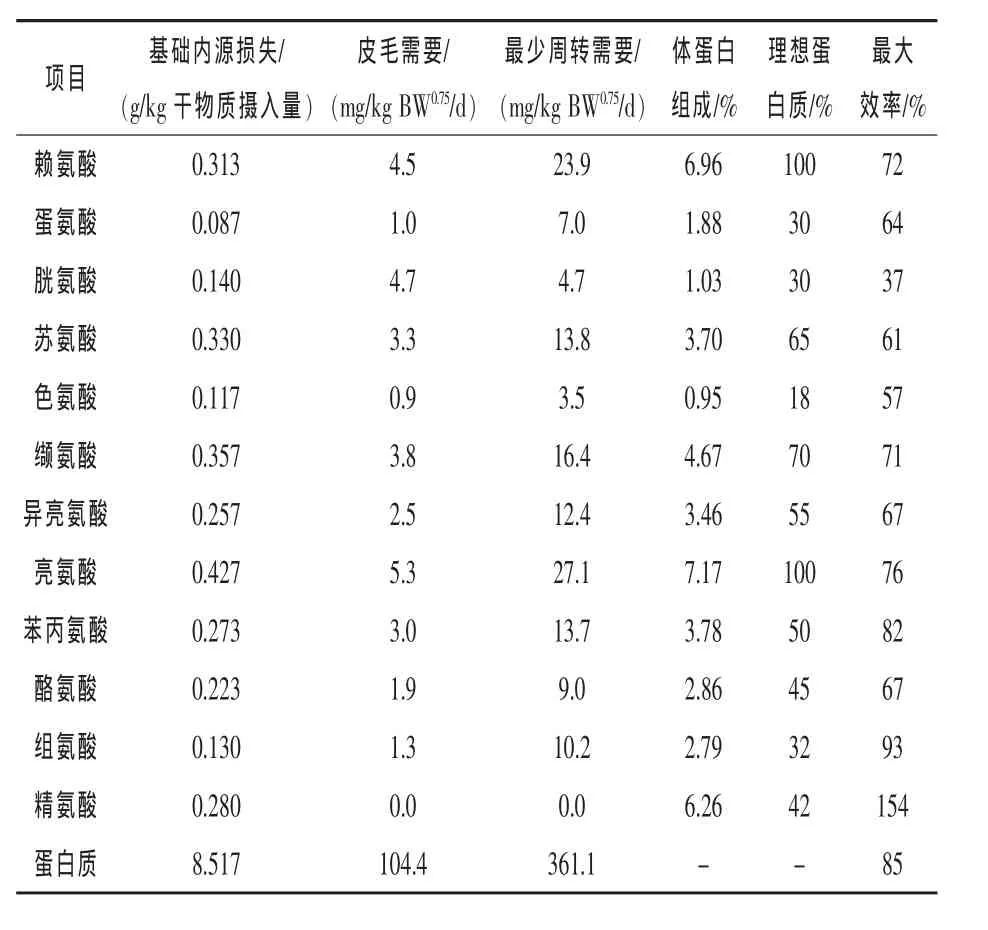
表1 InraPorc模型中由理想蛋白组成、体蛋白组成和维持需要计算得到的氨基酸利用的最大效率
氨基酸的维持需要量由皮毛损失和最小蛋白质代谢损失组成。这些数据由Moughan(1998)发表的相关数据计算得到。基础内源损失的数据就是INRA-AFZ饲料营养成分表中的数据(Sauvant等,2004),并与软件中的SID数据一致。氨基酸的最大沉积效率仅仅指氨基酸被用于蛋白质沉积的部分,不包括维持需要和基础内源损失部分。SID氨基酸应用于维持和内源损失的效率认定为100%。
长期以来,维持所需的赖氨酸被认定为36 mg/kg BW0.75/d(NRC,1998;Wang 和 Fuller,1989)。尽管这里所用的值 (例如4.5+23.9=28.4 mg/kg BW0.75/d)低于36,但其中也包括了基础内源损失。在上文的例子中(对1头50 kg体重、采食量为2 kg/d猪的需要量进行析因分析),基础内源损失为0.626 g/d,相当于 33 mg/kg BW0.75/d。因此在Inraporc模型里,维持所用赖氨酸需要量再加上基础内源性损失会高于Wang和Fuller(1989)的推荐量。尽管如此,维持需要占整个氨基酸需要量的比例是很小的。基于以上描述,可以计算生长育肥猪在某一阶段的SID氨基酸需要量,图1为赖氨酸利用的一个示例。因为基础内源性损失、维持和蛋白质沉积需要量的相对比例会随生长而变化,因此理想蛋白质模型并不是恒定的。苏氨酸和缬氨酸的内源性损失相对较多。由于这些氨基酸的损失随着生长而增加,因此在体重由30 kg增加到110 kg时SID苏氨酸和赖氨酸比与缬氨酸和赖氨酸比提高了约2个百分点。
由图1可知,InraPorc模型提供了一个对单个动物氨基酸需要的预测。这个推荐量低于一群猪有相同生长表现时的需要量。InraPorc模型给出的是猪群的平均需要量,这比猪个体平均的需要量高约10%。
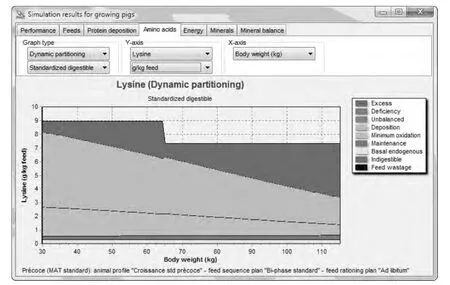
图1 InraPorc模型预测30~115 kg阶段猪对SID赖氨酸的利用情况
2 NRC模型中生长猪氨基酸的需要
NRC(2012)模型和InraPorc模型概念上相似。两者主要的不同是氨基酸的利用效率。NRC模型默认赖氨酸用于维持的最大效率是75%。为了解释动物之间的变异,需要一系列严格控制的屠宰试验数据用来测试模型,以调整氨基酸用于沉积蛋白效率的数据。
此外,最大效率会随体重变化。在20 kg体重时蛋白沉积赖氨酸的最大效率为68.2%,是120 kg体重时的56.8%。这与InraPorc模型中的策略不同,InraPorc模型在整个生长期使用一个恒定的效率(72%)。与此同时,NRC模型中氨基酸用于维持和内源损失的效率与用于蛋白质沉积的效率相同,而InraPorc模型认为氨基酸用于维持和内源损失的效率为100%。NRC模型中不同氨基酸的内源损失要比InraPorc模型中的内源损失高15%~85%。
当InraPorc模型和NRC模型输入相似的参数时(例如,采食量和蛋白质沉积曲线),可以对两个模型预测的需要量进行比较。在预测20 kg体重猪SID氨基酸需要量时,InraPorc模型稍微高于NRC模型(不到10%),而在预测140 kg体重猪时正好相反,InraPorc模型预测值会稍微较低。尽管两种方法预测需要量稍有不同,但整体来说非常相似。由于InraPorc和NRC两个模型都是动力学模型,所以理想蛋白模型在生长期也是变化的。在InraPorc模型中变化最大的是苏氨酸和缬氨酸,NRC中最大的是苏氨酸、蛋氨酸+胱氨酸、缬氨酸和异亮氨酸。20~140 kg体重时,InraPorc模型中SID苏氨酸赖氨酸比从64%增加到65%,NRC模型中从62%增加到67%。尽管不同时期SID氨基酸和赖氨酸比有变化,但是这两个模型都可以计算整体的理想蛋白质组成。由表2可知,两个模型非常相似,只有少数例外(如蛋氨酸+胱氨酸、苏氨酸、缬氨酸和异亮氨酸)。
3 InraPorc模型中怀孕母猪和哺乳母猪氨基酸的需要
InraPorc母猪模型是描述不同胎次母猪营养利用和需要的少有的几个模型之一。Dourmad等(2008、1999)对这个模型有详细的描述,整个模型基于怀孕和泌乳阶段能量和氨基酸利用,其中包括不同胎次胚胎的生长、母体增重、产奶量以及哺乳期体组织的动员。
由于怀孕母猪的限饲以及哺乳期蛋白质摄入通常低于产出,因此,在繁殖母猪中很难应用体蛋白沉积这一概念(不同于生长猪)。实际生产中母猪饲喂的主要目标是分娩时达到理想体重和背膘厚,实际的蛋白质沉积量很难达到母猪的潜在蛋白质沉积量(自由采食时的蛋白质沉积量)。因此,InraPorc模型基于怀孕期胎儿蛋白沉积和摄入的能量剩余(摄入能量-维持能量),利用经验公式描述母猪的蛋白质沉积。设定赖氨酸的最大沉积效率为65%。其他氨基酸的限制量通过怀孕母猪理想蛋白质组成计算得到(表2)。哺乳期乳中蛋白质和氨基酸的流失也是通过经验公式计算得到。通过窝增重和窝仔猪数计算乳蛋白的流失量。日产奶量通过将平均产奶量和哺乳天数代入模型中计算得到。产奶量在前19天逐渐增加,随后稍微降低。哺乳期的蛋白沉积(更准确的说是蛋白动员)也通过一个经验方程(通过计算第一限制氨基酸的摄入和乳中蛋白的损失)描述。其他氨基酸的平衡通过哺乳母猪理想蛋白质组成计算 (表2)。由于使用的是经验方程,因此氨基酸用于产奶的效率也未知。但一般来说,氨基酸转化为产奶的效率相对较高 (如赖氨酸的SID效率为80%~82%),乳蛋白的生成不需要或很少需要蛋白周转,这与肌肉蛋白合成不同。

表2 InraPora模型和NRC模型中生长猪、怀孕母猪和哺乳母猪理想蛋白质组成(以其与赖氨酸的百分比表示)
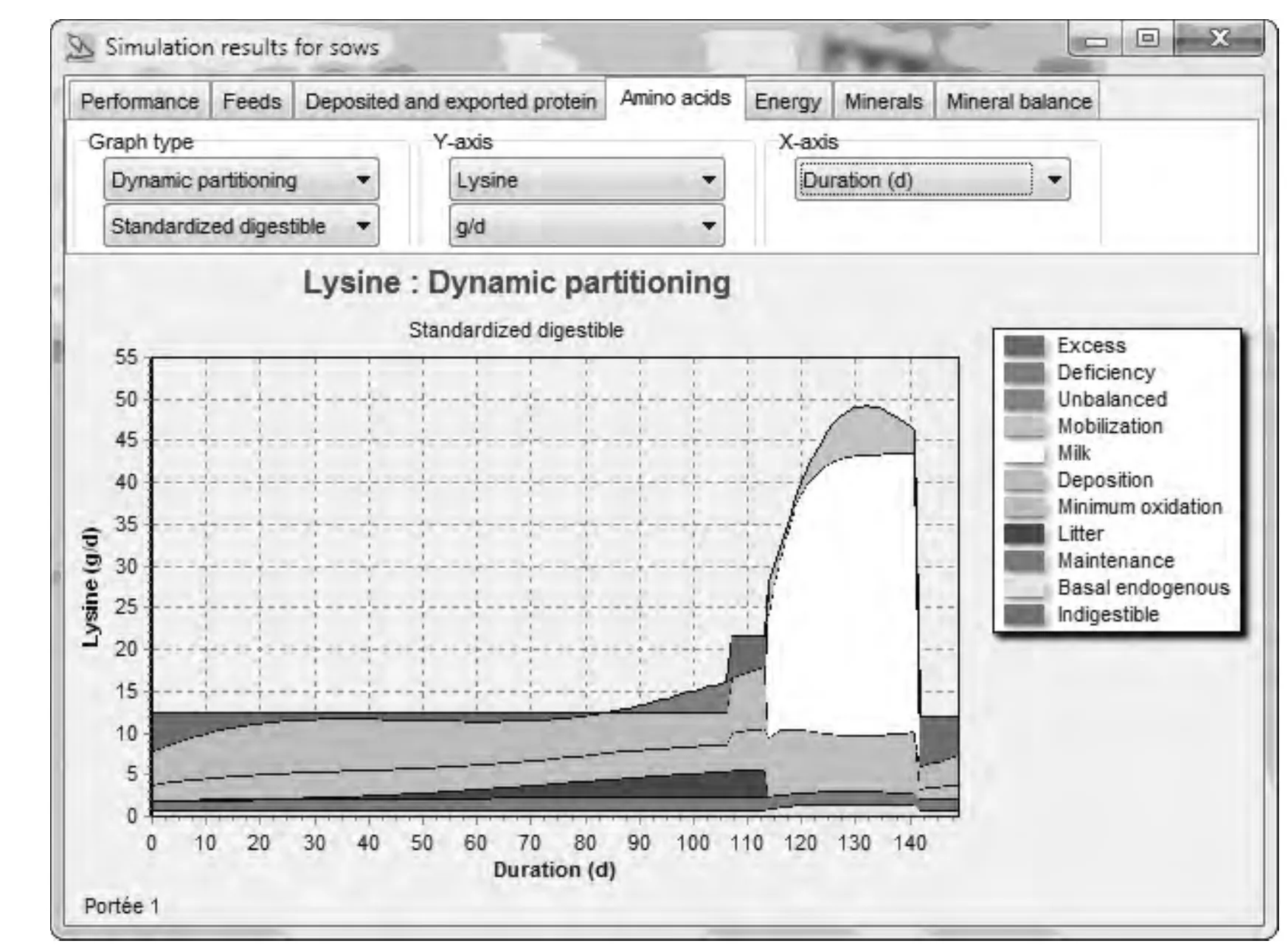
图2 InraPorc模型对初产母猪SID赖氨酸利用的预测
图2显示了初产母猪在第一次繁殖周期的SID赖氨酸利用情况。在怀孕早期,母猪需要沉积大部分的赖氨酸(主要表现为肌肉),因为初产母猪还未达到成熟体重。给母猪提供充足的赖氨酸就会发挥它的生长潜力,而赖氨酸过量则会脱氨。大约从60 d开始,在母体肌肉生长时在每窝仔猪(胎儿)中赖氨酸的滞留快速增加,从85 d开始,赖氨酸不足以维持最大的母体生长。因此,在怀孕最后一周提供给母猪高SID赖氨酸含量的泌乳日粮,母猪可以更好地表现出赖氨酸沉积的潜能。在泌乳期间,采食量的快速增加允许更多的赖氨酸用于生产和储存在母乳中。然而,增加的采食量不足以维持全部产乳量,因此母猪将会动员体蛋白来用于产乳,尤其在泌乳的最后14 d。断奶后,赖氨酸供应充足并开始恢复体蛋白储存。因此,对于初产母猪关于“母猪赖氨酸需要量”这个问题不能简单地回答,母猪仍然在生长,同时泌乳期又在失重,然后在下次怀孕期间重新恢复体重。另外,母猪在怀孕期间采用限饲,也可能导致蛋白质和赖氨酸沉积低于母猪的生物潜能。在泌乳期间,母猪动员体储备来提供产乳所需的能量和体蛋白以及体脂的动员。因此,日粮中增加赖氨酸含量并不一定能减少体蛋白的动员。
4 NRC模型中怀孕和哺乳母猪的氨基酸需要
NRC模型也使用析因法评估怀孕母猪和哺乳母猪的氨基酸需要量。对于怀孕母猪,NRC模型明确地考虑了每胎产仔数、乳腺组织、胎盘、羊水、子宫、时间依赖的母体蛋白质沉积和能量依赖的母体蛋白质沉积作为单独的蛋白池评估。对于前4个蛋白池,胎儿蛋白沉积的定量分析是最重要的,通过类似于InraPorc使用的关系来描述。时间和能量依赖的蛋白沉积与InraPorc使用的很相似。氨基酸需要量获得是通过每个蛋白池的氨基酸成分的蛋白沉积相乘,除以这些氨基酸的利用效率。氨基酸利用效率是通过拟合(限制)提供的数据模型预测估计。基础内源性损失占怀孕和哺乳母猪的不同内源性蛋白损失比分别为17.6 g/kg和9.8 g/kg干物质摄入量,但是对于生长猪氨基酸组成相同。
对于每个阶段的母猪很难给出一个 “账面价值”表示的氨基酸需要量,因为增重、失重和背膘厚度、窝仔数和窝增重均会影响氨基酸的需要量。InraPorc和NRC模型需要用户根据实际情况输入以便使上面描述的总体理念可以放大或缩小。这是一种可以自动校准的程序,当用户提供输入与输出的模式相比后,可调整所选模型的参数以便预测实际情况的营养需要量。
InraPorc模型分别对怀孕母猪和哺乳母猪使用各自固定的理想蛋白质组成。这与NRC模型不同,其中每个蛋白池都有自己的理想蛋白质模型,这样怀孕期和哺乳期的整个理想蛋白质模型将随着胎次和窝仔数的改变而改变。然而,这些变化是相对较小的,表2给出了泌乳母猪和怀孕母猪群的平均理想蛋白模型。除了异亮氨酸和含硫氨基酸,InraPorc使用的理想模式和NRC非常相似。两个模型表明在泌乳期的蛋氨酸+胱氨酸与赖氨酸的比值比在怀孕期的更低,但NRC模型比InraPorc模型差异更大。
5 配制配方日粮的依据
最低成本的饲料配方是基于限制营养指标的线性方案(如日粮中营养元素的最小和最大含量),在满足动物营养需要的前提下饲料原料以最低成本来组合。最低成本饲料配方的局限性是需要量是一个固定值,且配方日粮中的营养含量需要在配方师设定的安全范围之内。有经验的配方师可以调整需要量和评估生长表现。关于量化和系统化报告营养缺乏的影响的研究报道较少,如赖氨酸、色氨酸或缬氨酸的缺乏对生长表现的影响。在关于仔猪“二次氨基酸”的研究试验中发现,缺乏缬氨酸或者异亮氨酸对生长性能的危害大于亮氨酸、组氨酸或者苯丙氨酸(Gloaguen等,2014、2013;Barea 等,2009)。 建模方法,如在 InraPorc和NRC模型使用,在这方面向前迈进了重要的一步,因为其在一定程度上能预测由于缺乏氨基酸而在生长性能上的降低。然而,这些模型不能解释氨基酸间的互作(如支链氨基酸间的互作)以及一个氨基酸的缺乏或过量对采食量的影响。
6 结论
蛋白质模式和赖氨酸需求是基于个人试验研究或者试验汇编确定的。不同文献中提出了生长猪和母猪的不同理想蛋白质组成模式(Wu,2014;van Milgen 等,2008;Boisen,2003)。 模型生成的理想蛋白质组成在未来将更适用,而不是在猪只不同阶段推荐一种理想蛋白组成。模型考虑了氨基酸利用的不同方式以及在生产过程中发生的动态变化。无论是InraPorc模型还是NRC模型,哪一种是最适合的选择留给使用者去判定。
[1]B area R,Brossard L,Le Floc'h N,et al.The standardized ileal digestible isoleucine-to-lysine requirement ratio may be lower than fifty percent in eleven-to twenty-three-kilogram piglets[J].J Anim Sci,2009,87:4022 ~ 4031.
[2]Boisen S.Ideal dietary amino acid profiles for pigs.In Amino acids in animal nutrition [M].Volume 2.Edited by D'Mello JPF.Oxon:CABI Publishing,2003.157~168.
[3]Dourmad J Y,Étienne M,Valancogne A,et al.InraPorc:A model and decision support tool for the nutrition of sows[J].Anim Feed Sci Technol,2008,143:372 ~ 386.
[4]Dourmad J Y,Noblet J,Père M C,et al.Mating,pregnancy and prenatal growth[A].A quantitative biology of the pig[C].Kyriazakis I.Oxon:CABI Publishing,1999.129 ~ 153.
[5]Gloaguen M,Le Floc'h N,Primot Y,et al.Response of piglets to the standardized ileal digestible isoleucine,histidine and leucine supply in cerealsoybean meal-based diets[J].Animal,2013,7:901 ~ 908.
[6]Moughan P J.Protein metabolism in the growing pig.In A quantitative biology of the pig[M].Edited by Kyriazakis I.Oxon,UK:CABI Publishing,1998.299~331.
[7]NRC.Nutrient requirements of swine Eleventh revised edition edn[S].Washington,DC,USA:National Academy Press,2012.
[8]NRC.Nutrient requirements of swine.10th revised edition edn[M].Washington,DC,USA:National Academy Press,1998.
[9]Sauvant D,Perez J-M,Tran G.Tables of composition and nutritional value of feed materials[M].Pigs,poultry,cattle,sheep,goats,rabbits,horses,fish.Paris,France:INRA Editions,2004.
[10]van Milgen J,Valancogne A,Dubois S,et al.InraPorc:A model and decision support tool for the nutrition of growing pigs[J].Anim Feed Sci Technol,2008,143:387 ~ 405.
[11]W ang T C,Fuller M F.The optimum dietary amino acid pattern for growing pigs[J].1.Experiments by amino acid deletion Br J Nutr,1989,62:77 ~89.
[12]Wu G.Dietary requirements of synthesizable amino acids by animals:a paradigm shift in protein nutrition[J].J Anim Sci Biotechnol,2014,5:34.

