水稻种子样品前处理对转基因成分荧光PCR检测的影响
王志纯,张 冰,邵碧英,江树勋,缪婷玉,彭 娟,陈文炳
(1.福建省种子管理总站,福建福州350003;2.福建出入境检验检疫局检验检疫技术中心,福建福州350001;3.厦门塔斯曼生物工程公司,福建厦门361023)
随着转基因技术的不断发展,被推广应用的转基因生物种类越来越多.2012年全球有28个国家种植了1.7×108hm2的转基因农作物,比2011年增长6%,是1996年的100倍.据估计,2012年全球转基因农作物种子创造的价值达到150亿美元,主要有转基因玉米、大豆、棉花、菜籽及甜菜等[1].由于转基因产品对人类、动物的健康、生态环境等存在不确定性与潜在风险,许多国家都制定了严格的转基因生物管理法规[2-3],对转基因生物及其产品严加监控,我国也先后出台了转基因生物与技术的相应法规,如国务院令第304号《农业转基因生物安全管理条例》,农业部令第8号《农业转基因生物安全评价管理办法》等.我国迄今为止尚未批准水稻等主粮作物的转基因品种商品化生产,但由于一些农作物科研单位对转基因科研材料疏于管理、隔离不规范,可能因串粉而导致邻近田块的水稻遭受转基因污染[4-5].欧盟、日本等国屡次从我国出口米制品中检出未经批准商品化生产的转基因水稻品系成分,对我国米制品实施更加严苛的入境检查[6-7],致使我国出口企业因此遭受惨重损失.因此,需要建立精准的水稻种子转基因检测方法.实验室样品制备与DNA提取等前处理对检测结果的准确性影响较大,但是,在现成的水稻等植物及其产品转基因成分检测方法等标准中[8-9],对实验室样品制作与DNA提取纯化等处理只有笼统的表述,水稻种子样品的粉碎细度等前处理对检测结果的影响研究迄今未见报道.
DNA的聚合酶链反应(polymerase chain reaction,PCR)技术是目前物种鉴定、检验检疫与转基因产品检测常用的方法[10],已经广泛应用于稻谷(米)及其制品的转基因成分检测[11-16].为提高水稻种子转基因成分荧光PCR检测方法的准确性、降低方法的检出限、规范操作程序,本研究以转基因水稻科丰6号种子样品[含有CaMV 35S启动子、NOS终止子、苏云金杆菌(Bt)编码晶体毒蛋白的Cry1Ab与豇豆胰蛋白酶抑制剂基因CpTI基因等外源基因]为实验材料,对影响水稻种子中转基因成分检测的主要前处理因素,包括样品研磨细度与 DNA提取过程中的十六烷基三甲基溴化铵 (hexadecyltrimethylammonium bromide,CTAB)裂解缓冲液温育时间等进行分析,以期筛选出优化的前处理措施组合,提高稻谷转基因成分实时荧光PCR检测结果的准确性,为建立水稻种子转基因精准检测方法提供依据.
1 材料与方法
1.1 供试材料
非转基因水稻“汕优63”种子与转基因水稻科丰6号种子(转基因稻谷质量分数为100%)由福建省农业科学院提供,科丰6号转基因大米阳性参照物质(转基因大米质量分数为0.01%)由中国检验检疫科学研究院提供.
1.2 试剂
TE缓冲液(pH 8.0)、超纯水、蛋白酶K、RNA分解酶为上海生工生物工程有限公司产品;Premix Ex Taq(2×)(Probe qPCR)试剂盒为大连宝生物科技公司产品;水稻内源基因(GOS)与外源基因扩增用的引物与探针[9]由大连宝生物科技公司合成(表1).其他试剂药品均为国产分析纯.

表1 荧光定量PCR引物/探针序列Table 1 The primer/probe sequence of fluorescence PCR
1.3 方法
1.3.1 样品制备 每个样品均匀分为4份,称取200 g,烘干研磨.非转基因稻谷样品研磨成粉末,分别过50目(滤过颗粒<270 μm)与100目(滤过颗粒<150 μm)圆振筛,制成颗粒细度<50目、50-100目、>100目3个细度范围的样品.科丰6号转基因稻谷样品粉末过筛方法同上.
非转基因稻谷样品粉末分别与颗粒细度相同的转基因稻谷样品按照不同质量分数进行配制.称取相同颗粒细度的非转基因稻谷样品粉末99.99 g与转基因稻谷样品0.01 g充分混匀,制成质量分数为0.01%的转基因稻谷样品.以同样的方法制作转基因稻谷质量分数为0.001%的转基因稻谷样品.
1.3.2 DNA提取 采用CTAB法[11]提取DNA,称取1 g样品粉末于50 mL离心管中,加入5 mL质量浓度为20 g·L-1的CTAB裂解缓冲液,于65℃恒温摇床中振荡温育(1、4、>8),最后将获得的DNA溶于300 μL的0.1×TE缓冲液(pH 8.0)中,充分涡旋后,测定DNA溶液的 D260nm/D280nm值与质量浓度(ng·μL-1).每份样品重复提取2份DNA.
1.3.3 荧光PCR温度循环与阈值设定 实时荧光PCR反应温度循环程序为2步法:95℃预变性10 min;95℃变性35 s,60℃退火及延伸60 s,45个循环.阈值设定原则[17]根据仪器噪声情况进行调整,以阈值线略高于正常阴性样品扩增曲线的最高点为准.
1.3.4 荧光PCR反应体系 荧光PCR单管反应体积为20 μL,引物与探针等试剂加样量如表2.
1.3.5 样品前处理对荧光PCR检测的影响 供试稻谷样品的转基因稻谷质量分数为0.01%,按照1.3.1与1.3.2节设置的3种颗粒细度与3种CTAB温育时间,共9种处理方法,各提取2份DNA,每份DNA做2次荧光PCR反应,即每个样本做4次PCR反应;共检测4个基因,包括水稻内源基因(GOS)与抗虫转基因农作物种子常见的3个外源基因(CaMV 35S、NOS、Cry1Ab);共进行144管PCR反应,每次(96孔板)实验都设置阳性对照(质量分数为0.01%科丰6号转基因大米阳性参照物质)、非转基因稻谷(汕优63)阴性对照与双蒸水(ddH2O)空白对照各1个.
1.3.6 转基因水稻种子样品检出率 CTAB温育时间同为>8 h(过夜)的情况下,对3种不同颗粒细度转基因稻谷质量分数为0.001%的稻谷样品,各提取24份DNA,每份DNA做2次PCR反应,进行3个外源基因CaM V35S、NOS、Cry1Ab的检出率测试.

表2 荧光PCR反应体系Table 2 Fluorescence PCR reaction systems
1.4 数据统计分析
采用Microsoft Office Excel 2003进行数据分析与绘图,对不同处理条件下样品DNA质量浓度与内源和外源基因的实时荧光PCR检测结果(Ct值)的差异显著性进行方差分析,并估算边际均值条形图.
2 结果与分析
2.1 样品颗粒细度及CTAB温育时间对DNA提取效果的影响
转基因稻谷质量分数为0.01%的样品DNA溶液的质量浓度平均值如表3.各个组合样品的DNA溶液 D260nm/D280nm值为1.7 -1.9,符合 PCR 检测要求.
由表3可知,在相同的颗粒细度下,提取的DNA质量浓度均随着DNA提取过程中CTAB温育时间的延长而提高,温育时间>8h条件下提取的DNA浓度高于其它2个温育时间处理;在温育时间相同情况下,DNA质量浓度随样品颗粒细度目数的增加而增高,颗粒大小>100目的样品中提取的DNA质量浓度比其余2种颗粒细度高;CTAB温育时间>8 h、颗粒大小>100目的样品提取的DNA质量浓度在9种处理组合中为最高.
方差分析表明,样品颗粒细度与CTAB温育时间对样品DNA提取质量浓度的影响均达到极显著水准(F行=24.18,F列=28.62,F0.01=18.00,P <0.01).
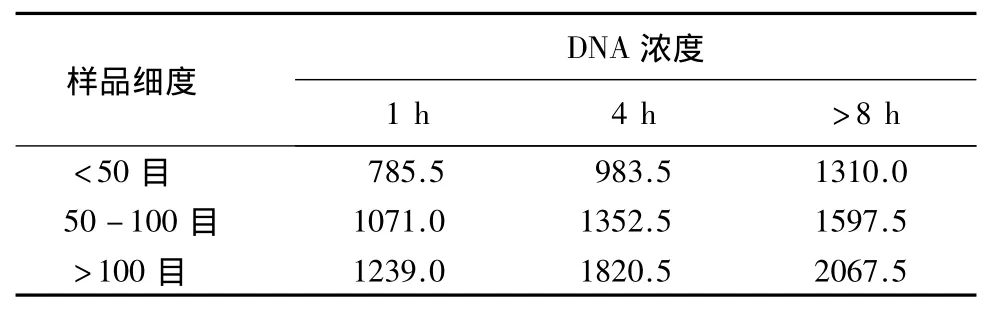
表3 稻谷样品提取到的DNA浓度Table 3 The DNA concentration of rice seed samples ng·μL -1
2.2 样品前处理对荧光PCR检测的影响
由表4可知,目数因素与时间因素对于稻谷样品的内源基因GOS和4个外源基因荧光PCR检测结果的Ct值都有极显著影响;目数和时间两因素的交互作用,对样品内源基因GOS有极显著影响,对外源基因CaMV 35S与NOS的检测结果影响显著,对Cry1Ab的检测结果影响不显著.
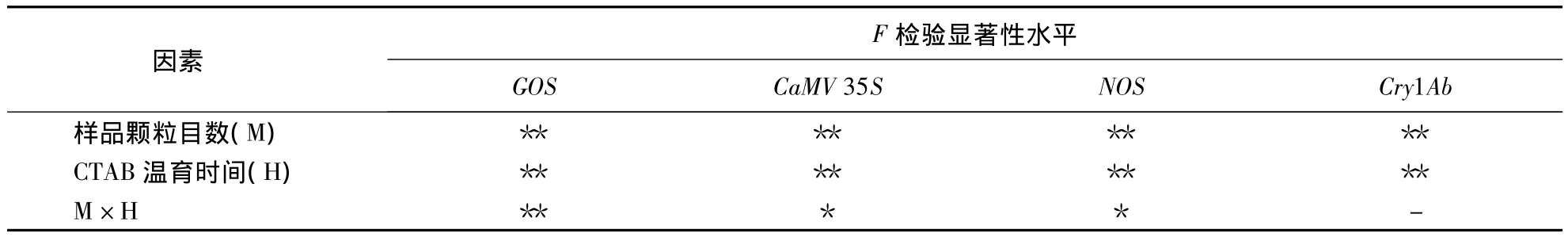
表4 前处理对水稻种子转基因样品(0.01%)4个基因Ct值的影响显著性F检验1)Table 4 F test of significant effect of pretreatment to Ct values of 4 genes in transgenic rice seed(0.01%)
基于Microsoft Office Excel 2003数据分析(图1、图2和图3),结果表明,样品颗粒细度 >100目、CTAB温育时间>8h的前处理条件下,3个外源基因CaMV 35S、NOS、Cry1Ab荧光PCR检测结果Ct值均为最小,灵敏度最高.因此选择可见样品颗粒细度>100目和温育时间>8 h为前处理最佳组合.
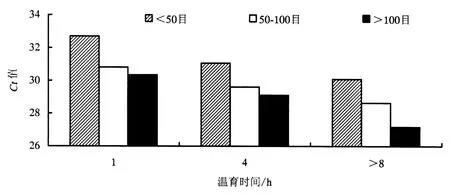
图1 0.01%转基因含量稻谷样品CaMV 35S估算边际均值Fig.1 Estimating marginal average figure of CaMV 35S of 0.01%GM rice seed
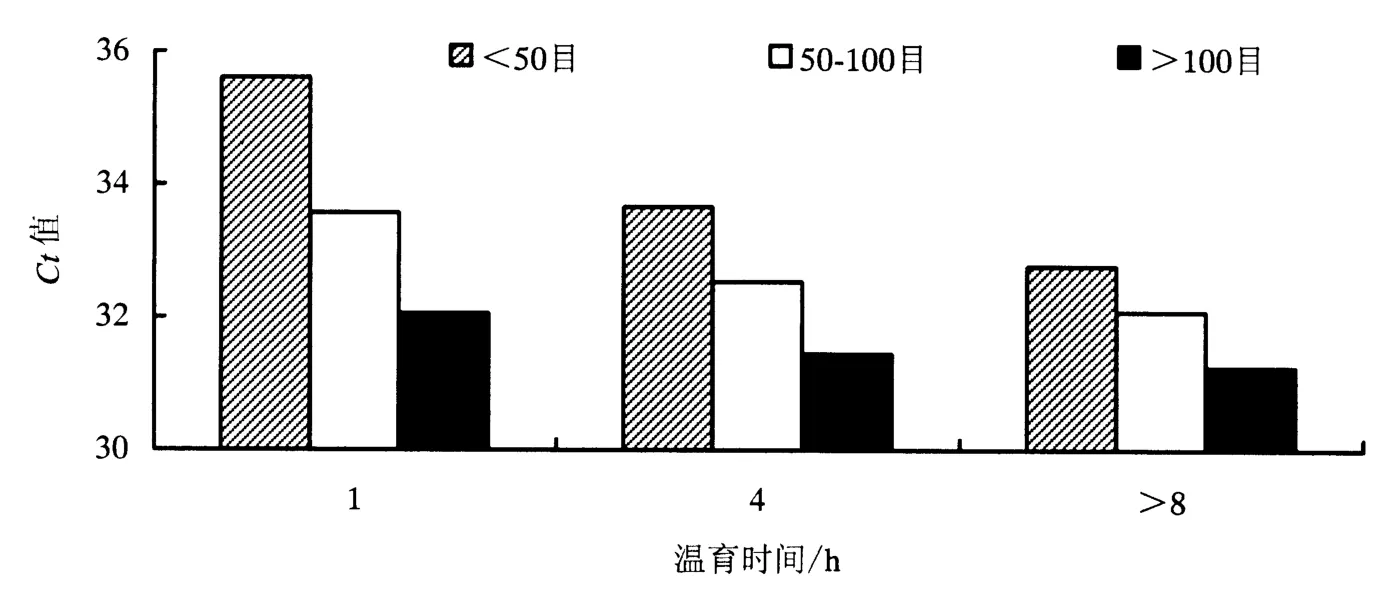
图2 0.01%转基因含量稻谷样品NOS估算边际均值Fig.2 Estimating marginal average figure of NOS of 0.01%GM rice seed
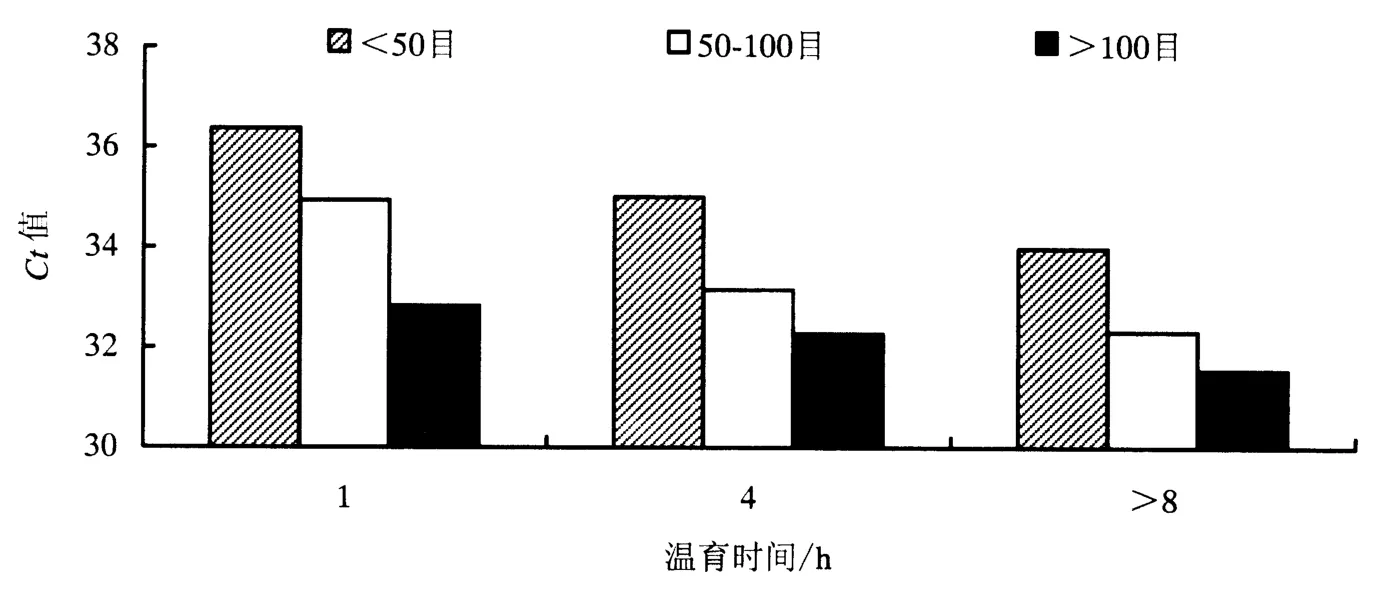
图3 0.01%转基因含量稻谷样品Cry1Ab估算边际均值Fig.3 Estimating marginal average figure of Cry1Ab of 0.01%GM rice seed
2.3 样品颗粒细度对稻谷低含量转基因成分检出率的影响
CTAB缓冲液温育同为>8 h的条件下,3个外源基因CaMV 35S、NOS、Cry1Ab的检出率见表5.样品颗粒细度 <50 目时,CaMV 35S、NOS、Cry1Ab 的检出率分别为 52.08%、62.50%、54.17%;样品颗粒细度在 50-100目时,3个基因检出率分别为81.25%、85.42%、83.33%;样品颗粒细度>100目时,3个外源基因检出率均为100%.
颗粒细度>100目的样品转基因成分PCR检测的Ct值平均数(由48个数据平均)都在判断阳性结果的Ct值(阳性判断标准值为≤36)以下[9](表6).说明前处理中的研磨细度对检出率有显著影响,恰当的前处理措施可以使得检出限(检出率稳定在95%以上的最低检出含量[18])降低到0.001%,比报道的转基因大米荧光 PCR 检出限为0.01%[13,14]降低10 倍.
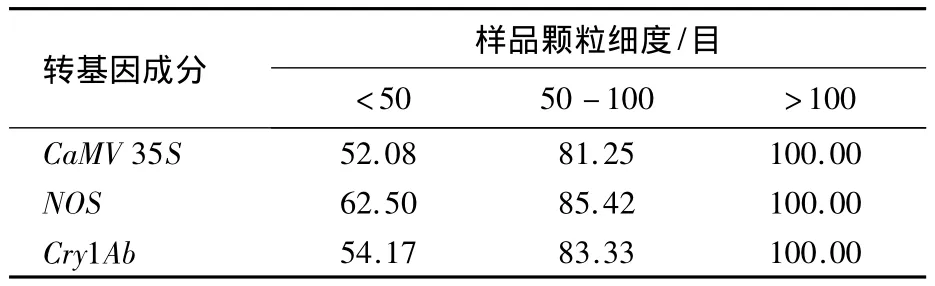
表5 样品颗粒细度对稻谷样品转基因成分(质量分数0.001%)检出率的影响Table 5 Effect of sample particle fineness on detection rate of transgenic component(0.001%)in rice seed samples

表6 样品颗粒细度>100目、CTAB温育时间>8 h处理组合的稻谷样品转基因成分(质量分数0.001%)检测Ct平均值Table 6 Average Ct values detected from transgenic components(0.001%)in rice seed samples treated by combination of sample particle fineness>100 mesh and CTAB incubation time>8 hours
3 讨论
稻谷(大米)和米制品转基因检测的研究多数限于方法的建立[11,12,14],或是PCR方法的灵敏度试验[13-14],而样品前处理对转基因成分检测的影响研究,鲜见报道.本研究结果表明,样品颗粒细度与CTAB温育时间对DNA提取效果的影响均达到极显著水准.颗粒细度>100目与CTAB温育时间>8h的处理组合提取的DNA浓度最高.CTAB缓冲液温育时间与样品颗粒细度对内源基因GOS和3个外源基因荧光PCR检测结果都有极显著影响;两因素间的交互作用仅对内源基因GOS有极显著影响,对CaMV 35S、NOS有显著影响,对Cry1Ab基因影响不显著.3个外源基因检测结果的估算边际均值图均表明样品颗粒细度>100目和温育时间>8 h为前处理最佳组合.在CTAB温育时间>8 h、样品颗粒细度目数>100目时,转基因稻谷(质量分数为0.001%)的3个外源基因(CaMV 35S、NOS、Cry1Ab)检出率均为100%,而且荧光PCR检测结果Ct平均值都在阳性结果判断值36以下.
当置信水平为95%时,样品测定值与零浓度样品(不含待测成分)的测定值有显著性差异即为检出限,实验要求重复20次以上[18].本研究对添加科丰6号转基因稻谷(质量分数为0.001%)的样品进行3种不同颗粒细度的处理,各重复提取24份DNA,每份DNA做2个PCR反应,共48个PCR重复,3个外源基因CaMV 35S、NOS、Cry1Ab的检出率表明,优化的前处理条件与PCR反应体系能够使荧光PCR方法的检出限从公认的转基因物质质量分数0.01%降低到0.001%,即检测方法灵敏度提高10倍.说明样品前处理对稻谷种子转基因成分检测结果的准确性有重要影响.
[1]CLIVE J.2012年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志,2013,33(2):1-8.
[2]KAEPPLER H F.Food safety assessment of genetically modified crops[J].Agronomy Journal,2000,92(4):793 -797.
[3]NICKSON T E.Planning environmental risk assessment for genetically modified crops:problem formulation for stress-tolerant crops[J].Plant Physiology,2008,147(2):494 -502.
[4]戎俊,宋志平,苏军,等.Bt/CpTI转基因稻及其非转基因亲本对照在间隔种植条件下的转基因漂移[J].生物多样性,2006,14(4):309 -314.
[5]陆永良,彭于发,王渭霞,等.抗除草剂转基因水稻基因漂移至常规栽培稻的频率研究初报[J].中国水稻科学,2010,24(6):663-666.
[6]European Community.Commission Decision(2008/289/EC)of 3 April 2008 on emergency measures regarding the unauthorised genetically modified organism‘Bt 63’in rice products[J].Official Journal of the European Union,2008,L096:29 -34.
[7]European Community.Commission Implementing Decision No 2011/884/EU of 22 December 2011 on emergency measures regarding unauthorised genetically modified rice in rice products originating from China and repealing Decision 2008/289/EC[J].Official Journal of the European Union,2011,L343:140 -148.
[8]陈红运,黄文胜,朱水芳,等.SN/T 1194—2003植物及其产品转基因成分检测抽样与制样方法[S].北京:中国标准出版社,2003.
[9]陈红运,梁新苗,陈双雅,等.SN/T 2584—2010水稻及其产品中转基因成分实时荧光PCR检测方法[S].北京:中国标准出版社,2010.
[10]陈文炳,王志明,李寿崧,等.分子标记在动植物检验检疫与GMO产品检测中的应用[J].福建农业大学学报,2004,33(4):494-500.
[11]MADE D,DEGNER C,GROHMANN L.Detection of genetically modified rice:a construct-specific real-time PCR method based on DNA sequence from transgenic Bt rice[J].European Food Research Technology,2006,224(2):217 -278.
[12]吴孝横,路勇.利用实时荧光PCR方法检测转Bt基因大米[J].现代食品科技,2009,25(2):211-216;220.
[13]吴志毅,张明哲,陈曦.大米和米制品Bt63转基因检测PCR方法的灵敏度研究[J].浙江农业学报,2009,21(6):549-554.
[14]黄新,张琰,侯立华,等.转基因水稻“科丰6号”实时荧光PCR定性定量检测方法研究[J].生物技术通报,2010(2):90-93.
[15]REITING R,GROHMANN L,MADE D.A testing cascade for the detection of genetically modified rice by real-time PCR in food and its application for detection of an unauthorized rice line similar to KeFeng6[J].Journal of Consumer Protection and Food Safety[J].2012,5(2):185 -188.
[16]魏霜,陈贞,芦春斌,等.多重 PCR检测转基因水稻的转基因成分[J].食品科学,2012,33(12):159-162.
[17]蒋春燕,王泰健,王琴,等.实时荧光定量 PCR技术[J].动物医学进展,2005,26(12):97-101.
[18]孙明.检出限的分类与计算方法[J].现代农业,2012(3):33-34.

