氧浓度及 Notch 通路对大鼠纤维环细胞增殖和细胞周期的影响
·基础研究·
氧浓度及Notch通路对大鼠纤维环细胞增殖和细胞周期的影响
马俊,张颖,陈元元,石长贵,袁文
作者单位:200003上海,第二军医大学附属长征医院骨科
通信作者:袁文yuanwenspine@163.com
【摘要】目的检测不同氧浓度条件下椎间盘纤维环细胞Notch信号通路相关分子的表达变化,明确参与调节纤维环细胞增殖的相关靶基因。方法体外分离、培养大鼠纤维环细胞,运用CCK-8细胞活力检测试剂盒、流式细胞仪检测不同氧浓度培养条件下Notch信号通路抑制剂L685458(2 μmol/L、4 μmol/L、8 μmol/L)对纤维环细胞增殖及细胞周期的影响;荧光定量RT-PCR检测不同氧浓度培养条件下纤维环细胞Notch信号表达水平变化。结果CCK-8结果显示与常氧条件相比,低氧培养纤维环细胞时所测吸光度值明显升高;无论常氧或低氧条件,加入Notch抑制剂干预后所测吸光度值明显降低;流式细胞仪结果显示与常氧条件相比,低氧培养纤维环细胞处于S/G2期细胞所占百分率明显升高,加入Notch抑制剂干预后处于S/G2期细胞所占百分率明显降低。低氧干预8~24 h后,Notch3、Notch4、Delta-like1、Delta-like3、Hes1、Hes5、Hes7 mRNA都有不同水平上调,Hey2 mRNA表达水平下调。结论低氧可以通过上调Notch信号通路的表达水平促进纤维环细胞增殖,Notch信号可能作为一个研究靶点用于延缓椎间盘退变的过程。
【关键词】大鼠; 椎间盘退行性变; 细胞增殖; 受体,Notch; 细胞低氧
基金项目:上海市自然科学基金青年项目(12ZR1454900)
作者简介:马俊(1989— ),硕士,医师
【中图分类号】R 349.53 【文献标志码】 A
DOI【】
收稿日期:(2014-03-05)
Influences of oxygen tension and Notch signaling pathway on proliferation and cell cycle of rat annulus fibrosus cells
MAJun,ZHANGYing,CHENYuan-yuan,SHIChang-gui,YUANWen.DepartmentofOrthopaedics,ChangzhengHospital,SecondaryMilitaryMedicalUniversity,Shanghai200003,China
Abstract【】ObjectiveTo observe the influences of O2 concentration on the expression levels of Notch signaling components in rat annulus fibrosus cells(AFCs), and to explore the target gene participates in controlling the proliferation process of AFCs. MethodsRat annulus fibrosus cells were harvested and cultured in vitro under hypoxia or normoxia condition. AFCs were administrated to different concontrations of Notch signal inhibitor, L685458(2 μmol/L, 4 μmol/L, 8 μmol/L), for 8-24 h, the proliferation and cell cycle of AFCs were examined by CCK-8 assay and flow cytometry. The expression level of Notch signaling components were tested by quantitative real-time polymerase chain reaction (qRT-PCR). Results CCK-8 assay indicated that the optical density value of AFCs under hypoxia was increased when compared with under normoxia, while decreased with different concontrations of L685458 whether under hypoxia or normoxia. Flow cytometry indicated that the viability and percentage of S/G2 phase cells of AFCs under hypoxia was increased when compared with under normoxia, while decreased with different concontrations of L685458 whether under hypoxia or normoxia. When AFCs were cultured under hypoxia for 8-24 h, the expression of Notch3, Notch4, Delta-like1, Delta-like3, Hes1, Hes5, Hes7 were increased and Hey2 was decreased at mRNA level compared with under normoxia . ConclusionHypoxia promotes the proliferation process of AFCs through up-regulation of Notch signaling components, and Notch signaling may become a therapeutic target for retarding the process of disc degeneration.
【Key words】Rats; Intervertebral disc degeneration; Cell proliferation; Receptors, notch; Cell hypoxia
J Spinal Surg, 2015,13(1):50-55
椎间盘退变是临床上引起颈腰痛的最主要原因之一。以椎间盘自身细胞为基础的细胞治疗技术在延缓椎间盘退变的进程中可能具有重要的意义[1]。椎间盘组织细胞始终生活在相对低氧的微环境中,其细胞本身也形成了一套独特的适应机制来适应局部低氧微环境的变化[2]。Notch信号通路是一个对低氧刺激敏感、调节细胞增殖分化的经典信号通路[3]。在关节软骨细胞中,Notch信号通路参与维持软骨细胞的增殖过程,而在其分化过程中Notch信号及靶基因Hes5表达下调[4]。低氧微环境可以抑制骨髓间充质干细胞向成骨细胞分化,在这一过程中Notch信号通路被激活,Notch1表达上调;阻断Notch1表达后骨髓间充质干细胞向成骨细胞分化的能力减弱[5]。目前研究证据显示体外低氧环境可以激活Notch信号通路从而促进椎间盘细胞增殖[6]。但Notch受体、配体、靶基因众多,目前还未完全明确具体哪些因子参与调节了椎间盘细胞的增殖过程。本实验旨在通过检测不同氧浓度条件下椎间盘纤维环细胞(annulus fibrosus cells,AFCs)Notch信号通路相关分子的表达变化,明确参与调节AFCs增殖的相关靶基因,为进一步体外调控AFCs增殖和人工椎间盘构建奠定基础。
1材料和方法
1.1试剂与仪器
雄性SD大鼠购自第二军医大学实验动物中心,动物实验经过第二军医大学动物伦理委员会批准。DMEM/F12培养基、胎牛血清、Ⅰ型胶原酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、1%青霉素/链霉素、0.25%胰酶(含/不含EDTA,Gibco);CO2细胞培养箱及低氧培养箱(Thermo scientific, USA)、倒置相差显微镜(Olympus);4%多聚甲醛,甲苯胺蓝染液。RNA提取试剂Trizol(Invitrogen),反转录试剂盒ReverTra Ace qPCR RT Kit(TOYOBO),PCR引物(Invitrogen),Real time PCR试剂 iQ SYBR Green Supermix(BioRad)。CCK-8细胞活力检测试剂盒(同仁公司,日本),酶标仪(Bio-RAD,USA),细胞周期检测试剂盒(南京凯基生物公司),流式细胞仪(BD公司)。
1.2实验方法
1.2.1大鼠AFCs的分离和培养
取3月龄雄性SD大鼠4只,腹腔内注射过量戊巴比妥钠处死。无菌条件下整块取出腰段脊柱,分离椎间盘,小刮匙刮除啫喱状髓核组织,留取纤维环。PBS 清洗2次,用眼科剪将纤维环剪成1 mm×1 mm×1 mm大小,加入不含EDTA的胰酶预消化20 min,之后加入20 mL 0.15%Ⅰ型胶原酶,在37℃摇床中继续消化。消化1 h后经200目滤网过滤,收集滤液至15 mL离心管内离心5 min,去上清,将分离得到的细胞重悬于含有10%胎牛血清、1%青霉素/链霉素的DMEM/F12完全培养液并接种于6 cm培养皿内,将滤网上未消化的纤维环组织继续上述步骤重复消化1次,将细胞置于37℃、5%CO2细胞培养箱内培养,2~3 d换液1次,约12 d时细胞达到完全汇合。细胞生长完全汇合以后进行传代。本研究均使用单层培养的第三代AFCs。
1.2.2大鼠AFCs甲苯胺蓝染色
细胞爬片成功后去除培养液,PBS冲洗3次,4%多聚甲醛室温固定10 min;PBS冲洗1次,滴加甲苯胺蓝染液,室温染色30 min,用自来水轻柔润洗数秒,蒸馏水洗2次,冷风吹干。
1.2.3实验分组
将体外培养的第三代AFCs分为2组。A组:常氧培养组(21% O2,5%CO2,74%N2);B组:低氧培养组(1% O2,5%CO2,94%N2),分别于干预后8~24 h行相关检测。
1.2.4CCK-8检测不同氧浓度干预后AFCs增殖情况
将第三代AFCs以7.5×103/孔的密度接种到96孔板中,加入含10%FBS的完全培养基,培养24 h使细胞贴壁后加入不同浓度的Notch通路抑制剂L685458(2 μmol/L、4 μmol/L、8 μmol/L),空白对照组不加入药物,阴性对照组不加纤维环细胞,每个浓度梯度设置6个复孔,分别在常氧和低氧条件下继续培养24 h后换液,PBS冲洗各孔1次,将CCK-8试剂和完全培养基按1∶10体积比配制成工作液,每孔加入110 μL,继续培养2 h后用酶标仪检测480 nm处的吸光度(optical density,OD)值。
1.2.5流式细胞仪检测不同氧浓度干预后AFCs细胞周期变化
将第三代纤维环细胞以1.0×105/孔的密度接种到6 cm培养皿中,隔天换液。待细胞生长至50%~60%融合时,加入4 μmol/L Notch通路抑制剂L685458,后分别置于低氧和常氧条件下培养24 h,PBS清洗1次,消化、离心,收集并调整细胞浓度为1×106/mL。制备的单细胞悬液用体积分数为70%的冰乙醇固定,4℃过夜。进行细胞周期测定前,用PBS洗去固定液;加100 μL RNase A 37℃水浴30 min;再加入400 μL PI染色混匀,4℃避光孵育30 min,上机检测,记录激发波长488 nm处红色荧光,分析细胞周期各时相百分比。每处理组2个重复,实验重复3次。
1.2.6Real-time PCR检测Notch信号相关分子mRNA表达水平
将第三代纤维环细胞等密度接种至10 cm培养皿中,置于37℃、5%CO2细胞培养箱内培养,待细胞生长至约80%融合时,将其分别置于低氧和常氧条件下继续培养8~24 h收集细胞。Trizol抽提细胞总RNA,运用ReverTra Ace qPCR RT Kit进行逆转录反应,37℃ 15 min,98℃ 5 min,反应结束之后,保存于-20℃以便进行后续反应。运用iQ SYBR Green Supermix进行RT-PCR反应,实验重复3次。引物序列见表1。

表1 RT-PCR 分析所使用的引物序列
1.3统计学处理
2结果
2.1纤维环细胞形态学观察及甲苯胺蓝染色
原代纤维环细胞接种24 h后陆续贴壁,继续培养,见贴壁细胞呈多边形或梭形,培养12 d左右细胞接近融合,连续传代。典型的第三代纤维环细胞多伸出突起,呈梭形(见图1a,b);纤维环细胞甲苯胺蓝染色后细胞核染成紫色,胞浆染成深蓝色(见图1c,d)。
2.2CCK-8检测结果
CCK-8细胞活力检测显示常氧条件下培养24 h后,所测OD值为0.794±0.018,低氧组OD值为0.908±0.018,2组比较差异有统计学意义(P<0.01),说明低氧培养可以促进AFCs增殖。分别在常氧和低氧培养条件下加入不同浓度Notch抑制剂L685458(2 μmol/L、4 μmol/L、8 μmol/L),干预24 h后所测OD值分别为:0.741±0.016、0.670±0.025、0.569±0.019、0.832±0.018、0.756±0.021、0.643±0.013,不管在低氧或是常氧培养条件下,与对照组相比,L685458干预后OD值明显降低,且OD值与浓度呈负相关,各浓度之间比较差异有统计学意义(P<0.01),说明L685458可以抑制 AFCs增殖,浓度越大,抑制效果越明显(见图2)。
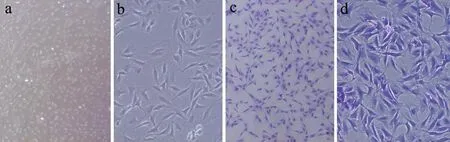
a: 倒置相差显微镜下细胞形态(×40)b: 倒置相差显微镜下细胞形态(×100)c:甲苯胺蓝染色后细胞形态(×40)d: 甲苯胺蓝染色后细胞形态(×100)
a: Morphology of AFCs under light microscope(×40)b: Morphology of AFCs under light microscope(×100)c:Morphology of AFCs under Toluidine blue staining(×40)d: Morphology of AFCs under Toluidine blue staining(×100)
图1第三代纤维环细胞镜下观察和甲苯胺蓝染色
Fig.1Light microscope and Toluidine blue staining of P3 annulus fibrosus cells
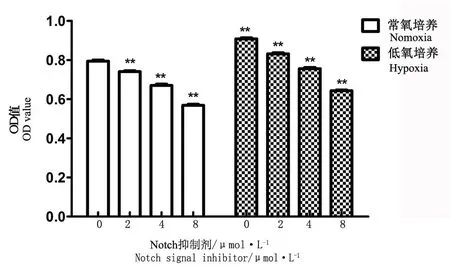
注:不同氧浓度培养条件下,各组加入不同浓度Notch抑制剂,空白对照组不加药物,各组测得的OD值比较,**与空白对照相比,P<0.01
Note: Annulus fibrosus cells were cultured under different concentration of O2, and were added with different concentration of Notch signal inhibitor(except control group),OD values were compared between different groups,**compared with control group,P<0.01
图2不同氧浓度及Notch抑制剂对纤维环细胞增殖影响
Fig.2Influences of different concentration of O2and Notch signal inhibitor on cell proliferation process of annulus fibrosus cells
2.3流式细胞仪检测结果
常氧培养条件下空白对照组AFCs处于G1期、S/G2期细胞所占百分比分别为(75.48±0.85)%、(24.52±0.85) %,而4 μmol/L Notch抑制剂干预后处于G1期、S/G2期细胞所占百分比为(83.09±1.65) %、(16.91±1.65) %,Notch抑制剂干预后处于G1期细胞所占百分比明显升高(P<0.01),处于S/G2期细胞所占百分比明显下降(P<0.01),各期两两比较差异有统计学意义(P<0.01)。低氧培养条件下空白对照组G1期、S/G2期细胞所占百分比为(71.93±1.57)%、(28.08±1.57)%,而4 μmol/L Notch抑制剂干预后处于G1期、S/G2期细胞所占百分比为(87.50±1.47)%、(12.50±1.47)%,Notch抑制剂干预后处于G1期细胞所占百分比明显升高(P<0.01),处于S/G2期细胞所占百分比明显下降(P<0.01),各期两两比较差异有统计学意义。与常氧培养相比,低氧培养条件下AFCs处于G1期细胞所占百分比明显下降(P<0.05),S/G2期细胞所占百分比明显升高(P<0.05),两者比较差异有统计学意义(P<0.05,见图3)。
2.4Notch信号荧光定量RT-PCR结果
以GAPDH作为内参,获得目的基因和GAPDH的Ct值,通过取两者差值ΔCt,再取2-ΔCt作为相对表达量的值,计算出各时间点Notch信号相关分子的相对表达量。结果发现AFCs表达Notch受体Notch1、Notch2、Notch4、Notch4,Notch配体Jagged1、Delta-like1、Delta-like3,Notch靶基因Hes1、Hes5、Hes7、Hey1、Hey2,而不表达Notch配体Jagged2、Delta-like4及靶基因Hes2(结果未列出)。AFCs在低氧干预8 h后,Notch4及Jagged1 mRNA表达水平上调,与常氧对照组相比差异有统计学意义(P<0.05),配体Delta-like3及靶基因Hes7 mRNA表达水平有上升趋势,但与常氧对照组相比差异无统计学意义(P>0.05);AFCs在低氧干预24 h后,Notch3、Notch4、Delta-like1、Delta-like3、Hes1、Hes5、Hes7 mRNA都有不同水平上调,与常氧对照组相比差异有统计学意义(P<0.05),而Hey2 mRNA表达水平明显下调,与常氧对照组相比差异有统计学意义(P<0.05)。不同氧浓度培养条件下,AFCsNotch1、Notch2及靶基因Hey1 mRNA表达水平无明显改变(见图4)。
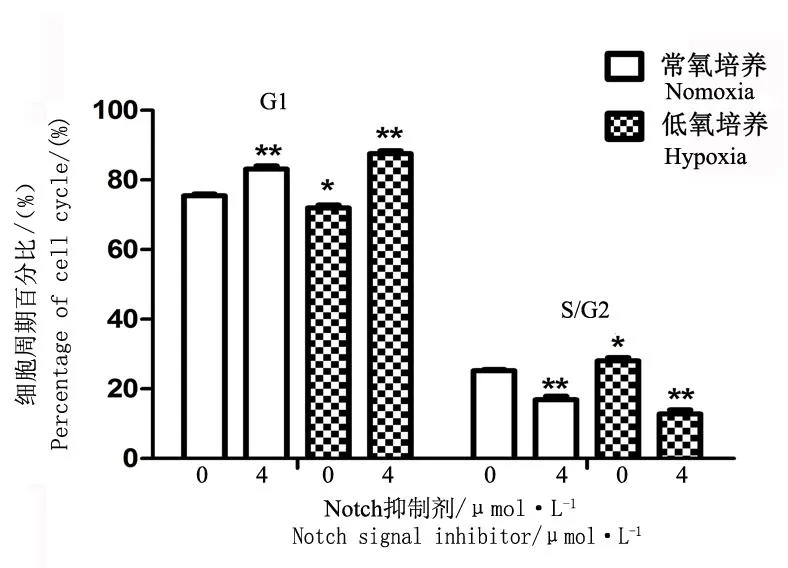
注:不同氧浓度培养条件下,各组加入4 μmol/L Notch抑制剂,空白对照组不加药物,测得各组细胞周期各期所占百分比比较,**与空白对照相比,P<0.01;*与空白对照相比,P<0.05
Note: Annulus fibrosus cells were cultured under different concentration of O2, and were added with 4 μmol/L Notch signal inhibitor(except control group), percentage of G1 and S/G2 phase were compared between different groups,** compared with control groupP<0.01;* compared with control groupP<0.05
图3不同氧浓度培养下Notch抑制剂对纤维环细胞细胞周期影响
Fig.3Influences of different concentration of O2and Notch signal inhibitor on cell cycle of annulus fibrosus cells
3讨论
研究椎间盘细胞增殖和细胞外基质合成的机制对延缓椎间盘退变有十分重要的意义。椎间盘中从外层纤维环到内层髓核,形成了一个氧浓度逐渐减低的浓度梯度,体内外局部的低氧环境对椎间盘细胞正常功能和基质代谢有重要的影响[7]。本实验通过CCK-8和流式细胞仪检测证实体外低氧微环境可以促进大鼠椎间盘纤维环细胞的增殖,这与Hiyama等[6]报道的结果是类似的。Yang等[8]也证实低氧培养更有利于人已退变的髓核细胞维持其增殖的潜能。Huang等[9]将来源于猴的椎间盘细胞置于不同氧浓度条件下培养,发现椎间盘细胞低氧培养(3.5%O2)时增殖率明显高于常氧培养(20% O2),但在连续培养10 d之后,椎间盘细胞凋亡率明显增加。Bertolo等[10]将人退变椎间盘细胞接种至海藻酸盐凝胶微球中培养,发现低氧条件(2%O2)并不能促进椎间盘细胞增殖。由此可见,氧浓度调节椎间盘细胞的增殖是一个相对复杂的过程,笔者推测上述实验之所以取得不同的结果,可能与各学者选择的细胞种属、细胞培养方法和氧浓度不同有关。

注:Nx,常氧培养;Hx,低氧培养;ns,与Nx组相比P>0.05;*与Nx组相比P<0.05
Note: Nx,21% O2; Hx,1% O2; ns, compared with control groupP>0.05; * compared with control groupP<0.05
图4不同氧浓度培养对纤维环细胞Notch信号mRNA表达影响
Fig.4Notch signal mRNA expression levels of annulus fibrosus cells under different concentration of O2
Notch信号通路是一个对低氧刺激敏感,调节干细胞、肿瘤细胞增殖分化的经典信号通路[3, 11]。Notch受体与配体结合后可以引起受体胞内段解离,从而激活下游靶基因,运用Notch信号抑制剂干预后可以阻断其受体胞内段解离,从而达到阻断Notch信号的目的。本实验中应用不同浓度Notch信号抑制剂干预AFCs后,发现AFCs增殖过程被抑制,且浓度越高,抑制效应越明显,说明Notch信号通路参与调节了AFCs的增殖过程。同时还发现,在低氧培养条件下,Notch抑制剂对AFCs增殖的抑制效果更明显。体内椎间盘细胞生活在一个低氧张力的环境中,因此有理由相信低氧可以通过激活Notch信号通路而参与调节椎间盘细胞增殖的过程。在一些神经干细胞中,局部低氧环境可促进低氧诱导因子-1α和Notch受体胞内段结合,促进Notch下游靶基因的转录,从而维持干细胞的未分化状态[11]。椎间盘细胞持续也表达低氧诱导因子-1α[12],但椎间盘细胞中低氧诱导因子-1α是否具有类似效应还不得而知。
鉴于Notch信号通路配体、受体、靶基因数目众多,为了筛选出参与调节AFCs增殖过程可能的信号分子及氧浓度对其表达水平的影响,本研究通过荧光定量PCR鉴定了AFCs在不同氧浓度培养条件下Notch信号表达水平变化。结果发现在低氧培养条件下,AFCs Notch受体Notch3、Notch4,配体Jagged1、Delta-like1、Delta-like3及靶基因Hes1、Hes5、Hes7 都有不同水平上调,其中以Hes5上升趋势最为明显。与此同时,靶基因Hey2 mRNA表达下调。AFCs中Notch信号表达水平与同样处于低氧环境中的关节软骨细胞类似,而在关节软骨细胞中,Hes5参与调节其增殖分化过程[4]。Hes1参与调节多种干细胞增殖分化的过程[13],低氧诱导因子-1α与Notch受体胞内段结合后再与Hes1基因启动子结合,维持干细胞的未分化状态[11]。Hes1也参与小鼠胚胎干细胞的分化过程,低水平Hes1促进胚胎干细胞向神经元细胞分化,而高水平的Hes1促进胚胎干细胞向中胚层细胞分化[14]。由此可知Notch信号通路靶基因在调节细胞增殖分化方面发挥着十分重要的作用。
本实验探讨了氧浓度及Notch信号对AFCs增殖的影响,证明体外低氧环境和Notch信号参与调节AFCs的增殖过程。在以自体椎间盘细胞为基础的针对椎间盘退变的细胞治疗中,如何在体外培养条件下获得较多的椎间盘细胞、维持细胞的正常表型是一个悬而未决的问题。有文献证实,在成人退变椎间盘中也存在成体干细胞,在合适诱导条件下可以向椎间盘细胞分化,不断补充椎间盘细胞的数目[1]。体外利用基因工程方法、某些生长因子的诱导作用、特殊的三维培养方法、培养条件的改良等都可以达到促进椎间盘细胞增殖、维持正常表型表达的目的。本实验结果显示,通过局部低氧环境的刺激或者通过基因工程方法使椎间盘细胞某些Notch靶基因(如Hes5)过表达,可能起到促进椎间盘细胞增殖的作用,这也为椎间盘退变的细胞学治疗提供了另一种可行的方法。当然,本实验仅在mRNA水平对不同氧浓度下AFCs Notch通路受体、配体和靶基因表达水平改变做了初步探讨,其蛋白质表达水平是否也具有一致的改变还不明确,Notch靶基因参与AFCs增殖调控的具体机制、低氧诱导因子-1α是否也参与这一过程还有待后续实验进一步证实。
参 考 文 献
[1] Risbud MV, Guttapalli A, Tsai TT, et al. Evidence for skeletal progenitor cells in the degenerate human intervertebral disc[J]. Spine (Phila Pa 1976), 2007, 32(23): 2537-2544.
[2] Risbud MV, Schipani E, Shapiro IM. Hypoxic regulation of nucleus pulposus cell survival: from niche to notch[J]. Am J Pathol, 2010, 176(4): 1577-1583.
[3] Silvan U, Díez-Torre A, Arluzea J, et al. Hypoxia and pluripotency in embryonic and embryonal carcinoma stem cell biology[J]. Differentiation, 2009, 78(2-3): 159-168.
[4] Karlsson C, Jonsson M, Asp J, et al. Notch and HES5 are regulated during human cartilage differentiation[J]. Cell Tissue Res, 2007, 327(3): 539-551.
[5] Xu N, Liu H, Qu F, et al. Hypoxia inhibits the differentiation of mesenchymal stem cells into osteoblasts by activation of Notch signaling[J]. Exp Mol Pathol, 2013, 94(1): 33-39.
[6] Hiyama A, Skubutyte R, Markova D, et al. Hypoxia activates the notch signaling pathway in cells of the intervertebral disc: implications in degenerative disc disease[J]. Arthritis Rheum, 2011, 63(5): 1355-1364.
[7] Chen JW, Li B, Yang YH, et al. Significance of hypoxia in the physiological function of intervertebral disc cells[J]. Crit Rev Eukaryot Gene Expr, 2014, 24(3): 193-204.
[8] Yang SH, Hu MH, Sun YH, et al. Differential phenotypic behaviors of human degenerative nucleus pulposus cells under normoxic and hypoxic conditions: influence of oxygen concentration during isolation, expansion, and cultivation[J]. Spine J,2013, 13(11): 1590-1596.
[9] Huang S, Leung VY, Long D, et al. Coupling of small leucine-rich proteoglycans to hypoxic survival of a progenitor cell-like subpopulation in Rhesus Macaque intervertebral disc[J]. Biomaterials, 2013, 34(28): 6548-6558.
[10]Bertolo A, Ettinger L, Aebli N, et al. The in vitro effects of dexamethasone, insulin and triiodothyronine on degenerative human intervertebral disc cells under normoxic and hypoxic conditions[J]. Eur Cell Mater, 2011, 21: 221-229.
[11]Gustafsson MV, Zheng X, Pereira T, et al. Hypoxia requires notch signaling to maintain the undifferentiated cell state[J]. Dev Cell, 2005, 9(5): 617-628.
[12]Risbud MV, Guttapalli A, Stokes DG, et al. Nucleus pulposus cells express HIF-1 alpha under normoxic culture conditions: a metabolic adaptation to the intervertebral disc microenvironment[J]. J Cell Biochem, 2006, 98(1): 152-159.
[13]Grogan SP, Olee T, Hiraoka K, et al. Repression of chondrogenesis through binding of notch signaling proteins HES-1 and HEY-1 to N-box domains in the COL2A1 enhancer site[J]. Arthritis Rheum, 2008, 58(9): 2754-2763.
[14]Kobayashi T, Mizuno H, Imayoshi I, et al. The cyclic gene Hes1 contributes to diverse differentiation responses of embryonic stem cells[J]. Genes Dev, 2009, 23(16): 1870-1875.
(本文编辑于倩)

