硫酸氨基葡萄糖标准样品的研制*
陈伟珠,张怡评,方华,易瑞灶,朱芮琳,洪专
(1.国家海洋局第三海洋研究所,国家海洋局海洋生物资源综合利用工程技术研究中心,福建厦门 361005;2.厦门大学化学化工学院 化学系,化学生物学福建省重点实验室,福建厦门 361005)
硫酸氨基葡萄糖是由虾、蟹甲壳降解分离得到的一种具有多种功能的高值产品,是一种分子结构明确的天然氨基糖类化合物,是人体合成软骨和关节液基质硫酸软骨素和胶原蛋白所必需的重要成分,可阻止关节软骨退变,延缓病情进展,减轻关节肿痛,促进功能恢复[1–2]。硫酸氨基葡萄糖在治疗骨关节炎症状方面达到了标准的非类固醇消炎药物(布洛芬、保泰松等)相同的治疗效果,还有病情控制作用,而没有非类固醇消炎药物的不良反应,是预防和治疗骨关节炎的特异性药物,还是增强免疫功能的健康食品。硫酸氨基葡萄糖为医食同源药物,长期服用安全可靠,在应用领域尚无已知的禁用规定,潜在着极大的医药开发价值。硫酸氨基葡萄糖目前是世界上公认的第一个预防骨关节炎发生、改善骨关节炎症状最为有效的膳食营养补充剂。欧洲抗风湿联盟(EOLAR)指南中将硫酸氨基葡萄糖列为最高证据级别的推荐药物[3]。
研究和开发与硫酸氨基葡萄糖相关的药品、保健食品等产品一直是硫酸氨基葡萄糖开发研究领域的热点和重点。目前市场上硫酸氨基葡萄糖相关产品品种繁多,含量参差不齐。产品中的有效成分硫酸氨基葡萄糖的含量高低是消费群体普遍关注的重点,也是产品研究开发方关注的重要技术问题。而硫酸氨基葡萄糖的含量测定需要有量值准确可靠的硫酸氨基葡萄糖标准样品作为检测基准,但目前国内外尚无硫酸氨基葡萄糖标准样品,为此笔者开展了硫酸氨基葡萄糖标准样品的研制工作。
1 主要仪器与试剂
高效液相色谱仪:Waters Alliances系列(Waters 2695 separations Module型,Waters 2424 ELS Detector型),美国Waters 公司;
紫外可见分光光度计:HP–8452型,美国惠普公司;
红外光谱仪:Nicolet Ftir-670型,美国Thermo Scientific 公司;
高分辨质谱仪:Lct PremierTMXE型,美国Waters公司;
天平:AL/104型,瑞士梅特勒–托利多集团;
纯水机:Milli-Q型,美国Milli-pore公司;
浓硫酸:分析纯,国药集团化学试剂有限公司;
乙腈:色谱纯,德国默克公司;
实验用水均由Milli–Q纯水系统制得。
2 硫酸氨基葡萄糖标准样品的制备
以盐酸氨基葡萄糖为原料,采用阴离子交换树脂将氯离子置换为硫酸根离子,获得硫酸氨基葡萄糖溶液,然后经浓缩、干燥,得到硫酸氨基葡萄糖单体。
打开西林瓶盖,称取50 mg硫酸氨基葡萄糖,用超纯水稀释至100 mL,得质量浓度为500 μg/mL的溶液,用色谱法进行纯度检测,每次进样10 μL,每个样品重复进样3 次。
3 定性分析
采用红外吸收光谱、高分辨质谱及核磁共振谱等对硫酸氨基葡萄糖标准样品进行定性分析。
3.1 红外光谱分析
硫酸氨基葡萄糖的红外光谱数据见表1。样品的红外光谱数据说明结构中存在羟基(-OH),亚甲基(-CH2),次甲基(-CH-),伯铵基(-NH3+),C-O,C-N,硫酸根离子等基团。
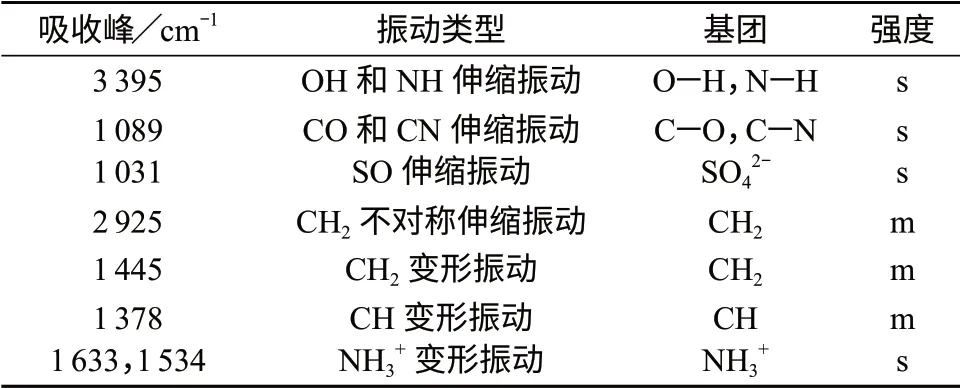
表1 硫酸氨基葡萄糖红外光谱数据
3.2 高分辨质谱分析
硫酸氨基葡萄糖中的氨基葡萄糖阳离子[C6H14NO5]+的理论精确质量数为180.086 7,高分辨质谱测得的硫酸氨基葡萄糖阳离子的精确质量数为180.087 0,与氨基葡萄糖阳离子数据基本一致。
另外,氨基葡萄糖阳离子脱水后碎片[C6H12NO4]+的理论精确质量数(162.076 1)与测得值(162.076 3)基本一致,双分子氨基葡萄糖的阳离子[C12H27N2O10]+的理论精确质量数(359.165 6)与测得值(359.166 7)也基本一致。
对该样品进行核磁共振测试,测试数据见表2。

表2 硫酸氨基葡萄糖的核磁共振数据
硫酸氨基葡萄糖在重水(D2O)中的核磁数据显示,δ5.31 (d,J=3.6 Hz)与δ4.82 (d,J=8.4 Hz)峰面积之比为3∶2,说明该化合物在水溶液中会发生α,β构型的转变,与文献[4]一致。硫酸氨基葡萄糖在水溶液中达到平衡时,α,β两种构型(图1)的比例为3∶2,这个数据决定了其它位置质子数比例也为3∶2。核磁共振氢谱、碳谱表明样品与硫酸氨基葡萄糖的结构一致。
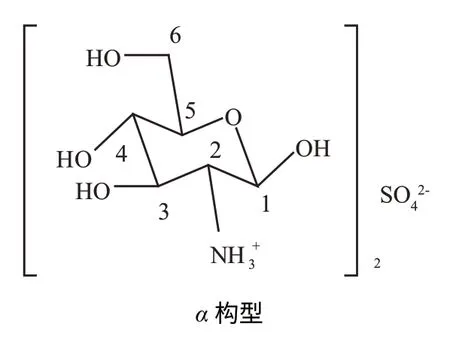
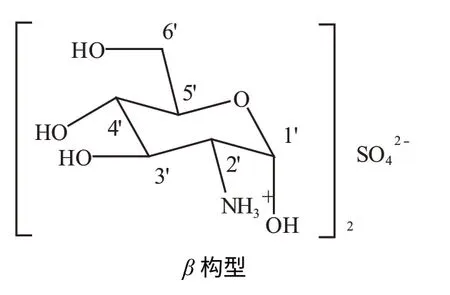
图1 硫酸氨基葡萄糖的α,β构型
综上所述,样品的红外光谱、高分辨质谱和核磁共振谱均证明了所研制的样品是硫酸氨基葡萄糖。
4 均匀性检验
标准样品均匀性是指特性量值在空间分布的均匀程度,它是对标准物质样品总体空间分布的评价,是标准样品的重要质量指标之一。将同一批制备的硫酸氨基葡萄糖样品进行分装,每瓶标准样品净重为200 mg,共分装200瓶。按照GB/T 15000.3–2008[5]规定,确定抽样数目为15个,采用单因素多水平试验方差分析法对硫酸氨基葡萄糖标准样品进行均匀性检验,测定方法为高效液相色谱–蒸发光散射法,每个样品重复测定3次。检测数据用方差分析法进行分析以判断标准样品的均匀性是否合格。在进行分装后,对硫酸氨基葡萄糖标准样品进行纯度均匀性检验,检验数据与方差分析结果分别见表3、表4。
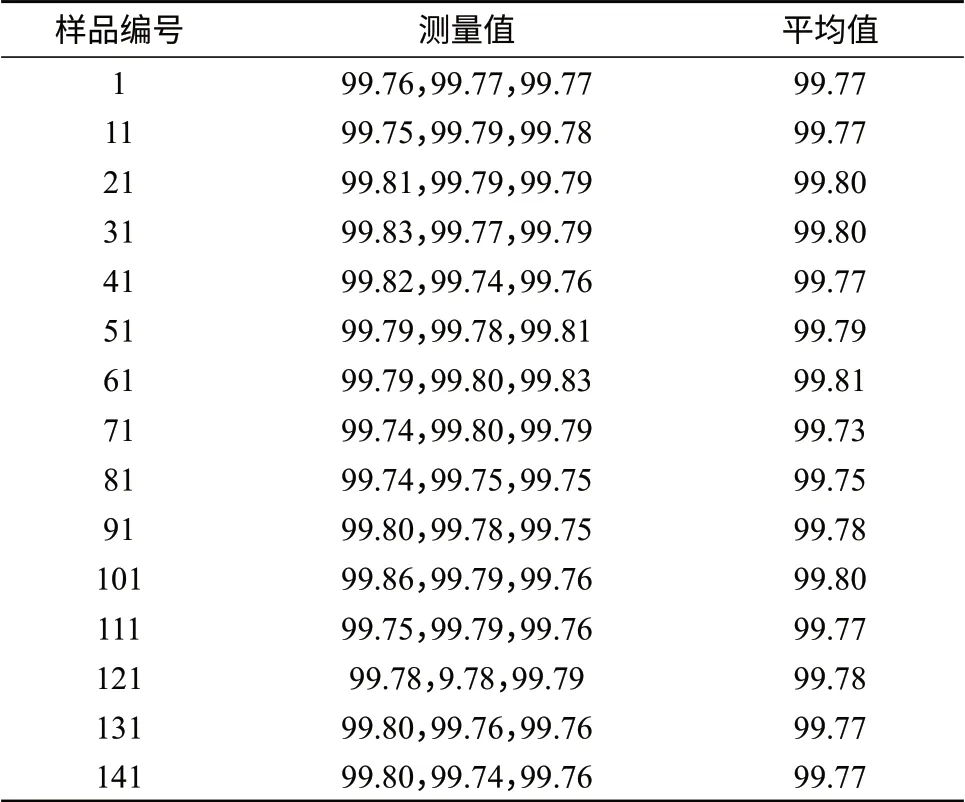
表3 硫酸氨基葡萄糖标准品纯度均匀性检验结果 %
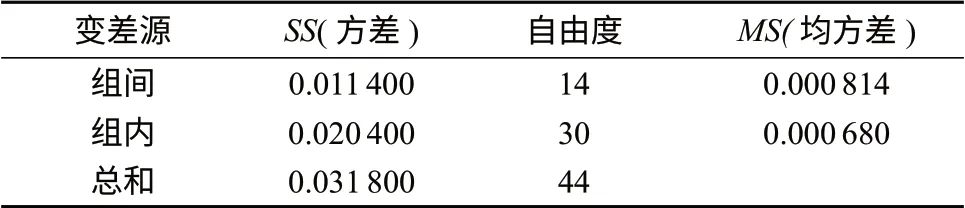
表4 方差分析结果
查 表 得F(0.05,14,30)=2.04,F=MS组间/MS组内=1.20,F 为了考察样品的稳定性,确定样品有效期,取本标准样品模拟上市包装,进行25℃条件下的12个月长期试验,分别于0,1,2,3,6,9,12个月取样,按稳定性重点考察项目检测,结果见表5。 表5 硫酸氨基葡萄糖样品稳定性试验结果(25℃储存) 根据GB/T 15000–2008 《标准样品工作导则(3) 标准样品定值的一般原则和统计方法》的要求,采用直线模型作为经验模型,对长期稳定性获得的数据进行分析,发现样品稳定性良好。 长期试验稳定性的不确定度贡献度ults=sbt=0.07%,稳定性试验结果表明,硫酸氨基葡萄糖在常温下保存1年仍然稳定。 标准样品定值通常采用技术有效并经过严谨认证的方法来完成。目前,硫酸氨基葡萄糖的含量一般利用检测其中氨基葡萄糖的含量来确定,常用检测方法有高效液相色谱–蒸发光散射法[6–7]、高效液相色谱–示差法[8–9]、高效液相色谱–紫外法[10–12]及液质联用法[13–14],尚无统一的国家标准或行业标准。笔者参考文献采用高效液相色谱–蒸发光散射法进行定值。 色谱柱:Prevail Carbohydrate ES柱(250 mm× 4.6 mm,5 μm);流 动 相:乙 腈–水(体 积 比 为70∶30),流量为0.8 mL/min;柱温:28℃;蒸发光散射;漂移管温度:80℃;气体压力:275.8 kPa;进样体积:10 μL。 按照GB/T 15000.3–2008标准要求,选择获得国家或部门认可、具备资质的8家实验室对本标准样品进行定值。随机抽取8瓶样品,每个定值实验室送样1瓶,各实验室均采用高效液相色谱–蒸发光散射法进行测定,应用色谱峰面积归一法进行定值,定值结果见表6。 表6 定值结果汇总表 % 汇集各家实验室的检测数据后,对每家实验室的数据按大小顺序排列,用Grubb’s法和峰度法正态性检验组内数据,没有异常值,所有数据进行下一步统计,再用Grubb’s法对每家实验室所得结果的平均值进行检验,将其看成一组测定值进行异常值检验,结果表明无异常值。因此将各家实验室测得的数据作为无偏估计值,计算8家测定结果的平均值及标准偏差。然后对各实验室测定结果的标准偏差s进行Cochran检验,按照式(1)计算统计量C: 式中:smax——si中的最大值; si——各实验室测定结果的标准偏差。 查 表 知C8,6(0.05)=0.362,计 算 得C=0.362,C > C8,3(0.05),表明各实验室间的测量不属于等精度测量,计算加权平均值为99.84%,作为硫酸氨基葡萄糖标准样品的定值结果。 根据GB/T 15000.3–2008规定,定值结果由标准值和不确定度组成。标准样品特性标准值的测量不确定度UCRM由标准值定值试验的不确定度U(x)、均匀性检验的不确定度Ubb和稳定性检验的不确定度Ults组成。依据全部测定结果,计算硫酸氨基葡萄糖标准样品的特性标准值和不确定度。各不确定度分量见表7。 表7 标准样品标准值不确定度分量 标准值的合成不确定度按照式(2)计算: 将表7中数据代入式(2)得u=0.09%,扩展不确定度U95=ku=0.18%(k=2)。 经过上述统计学数据处理,硫酸氨基葡萄糖标准样品的特性值定值结果为99.84%,置信度为95%的扩展不确定度为0.18%(k=2)。 所研制的硫酸氨基葡萄糖标准样品经过均匀性检验和稳定性考察,结果表明该标准样品符合标准样品制备要求,特性值定值结果为99.84%,扩展不确定度为0.18%(k=2)。该标准样品已通过全国标准样品技术委员会的评审。硫酸氨基葡萄糖标准样品为食品安全、环境监测、卫生检验检疫等方面的测量和科学研究提供了技术支撑和量值溯源保证。 [1]Piperno M,Reboul P,Hellio Le Graverand M P,et al. Glucosamine sulfate modulates dysregulated activities of human osteoarthritic chondrocytes in vitro[J]. Osteoarthritis and Cartilage,2000(8): 207–212. [2]Hungerford D S,Jones L C.Glucosamine and chondroitin sulfate are effective in the management of osteoarthritis[J]. The Journal of Arthroplasty,2003,18(3): 5–9. [3]Largo R,Alvarez-Soria M A,Díez-Ortego I,et al. Glucosamine Inhibits IL–1 beta-induced NFkappaB activation in human osteoarthritic chondrocytes[J]. Osteoarthritis Cartilage,2003,11(4): 290–298. [4]Der-Lii M T. A Solid-state NMR Application of the anomeric effect in carbohydrates:galactosamine,glucosamine,and n-acetylglucosamine[J]. Solid State Nuclear Magnetic Resonance,2005,27: 209–214. [5]GB/T 15000.3–2008 标准样品工作导则(3) 标准样品定值的一般原则和统计方法[S]. [6]吴虹,顾宏霞,王效山,等. HPLC–ELSD测定盐酸氨基葡萄糖含量[J].安徽中医学院学报,2008,27(2): 41–43. [7]李海英. HPLC–ELSD检测盐酸氨基葡萄糖中的有关物质[J].华西药学杂志,2008,23(2): 229–230. [8]Wang X M,Zhang R L,Lv Z H,et al. Determination of glucosamine and lactose in milk-based formulae by highperformance liquid chromatography[J]. Journal of Food Composition and Analysis,2008,21: 255–258. [9]Pun’ın Crespo M O,Vilasoa Mart’ınez M,L’opez Hern’andez J,et al. High-performance liquid chromatographic determination of chitin in the snow crab,chionoecetes opilio[J]. Journal of Chromatography A,2006,1 116: 189–192. [10]缪小亮,彭秀,马彪,等.硫酸氨基葡萄糖的HPLC法测定[J].中国医药工业杂志,2012,43(6): 466–467. [11]黄鑫,陈清松,许建中,等.反相高效液相色谱法测定氨基葡萄糖硫酸盐[J].福建师范大学学报:自然科学版,2009,25(3): 80–81. [12]初立梅,徐家根,霍立茹.反相高效液相色谱法测定硫酸氨基葡萄糖泡腾片中硫酸氨基葡萄糖的含量[J].儿科药学杂志,2012,18(3): 40–42. [13]栗艳,田云,关月,等. LC–MS/MS法测定人血浆中硫酸氨基葡萄糖浓度及其药动学研究[J].中国药房,2011,22(14): 1 284–1 285. [14]Hubert C,Houari S,Lecomte F,et al. Development and validation of a sensitive solid phase extraction/hydrophilic interaction liquid chromatography/mass spectrometry method for the accurate determination of glucosamine in dog plasma[J].Journal of Chromatography A,2010,1 217: 3 275–3 281.5 稳定性检验

6 定值分析
6.1 定值方法
6.2 色谱条件
7 定值结果及其不确定度
7.1 定值结果
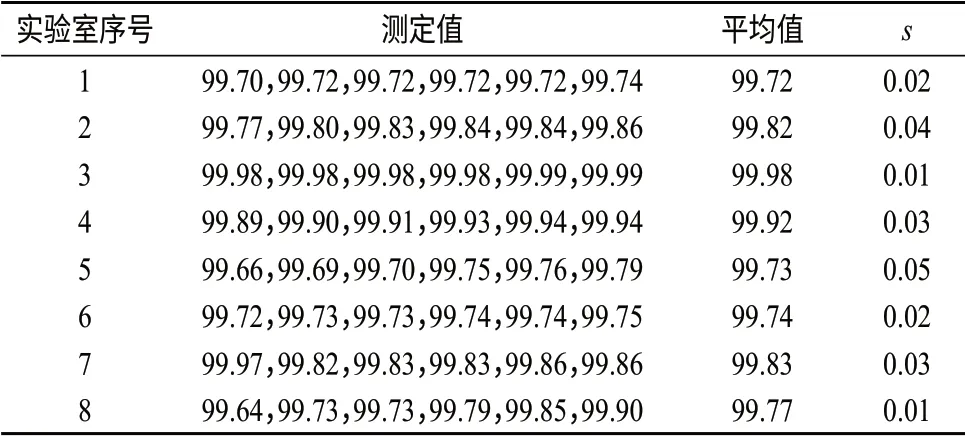

7.2 定值结果的不确定度

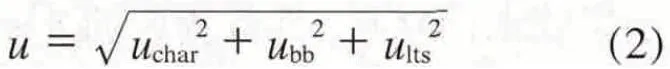
8 结语

