吲哚乙酸(IAA)对黑脉羊肚菌胞外SOD活性的影响*
李飞翔,张 丽,吴素蕊,赵天瑞,张 鑫
(1.昆明理工大学云南省食品安全研究院,云南 昆明 650500;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650221)
吲哚乙酸(IAA)对黑脉羊肚菌胞外SOD活性的影响*
李飞翔1,张 丽1,吴素蕊2**,赵天瑞1,张 鑫2
(1.昆明理工大学云南省食品安全研究院,云南 昆明 650500;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650221)
为了优化液体发酵环境条件,通过向培养基中添加吲哚乙酸(IAA),改变培养基成分组成的方法,研究吲哚乙酸对黑脉羊肚菌发酵培养产胞外SOD酶以及菌丝体生长的影响。结果表明,黑脉羊肚菌发酵培养过程中,最适菌丝体生长的培养条件为温度28℃,初始pH7,培养时间9 d;最适产酶的培养条件为温度20℃,初始pH5.5,培养时间5 d;IAA添加浓度为1.0 μg·mL-1时,菌丝体重量最大为14.03 g·L-1,浓度为2.5 μg·mL-1时,相对酶活性达到最高。
IAA;黑脉羊肚菌;胞外SOD;酶活
羊肚菌(Morchella)又名为羊肚菜,因其菌盖呈褶皱网状,极似羊肚而得名,是珍贵的野生食、药兼用真菌,其营养丰富、味道鲜美,具有重要的开发利用价值。在生物学分类上,羊肚菌属于子囊菌亚门(Ascomycotina)、盘菌目(Pezizales)、羊肚菌科(Gorchellaceae)、羊肚菌属(Morchella) 八类食用菌的总称,主要包括羊肚菌(M.esculenta)、高羊肚菌(M.elata)、小羊肚菌(M.deliciosa)和黑脉羊肚菌(M.angusticeps)[1]。
羊肚菌富含营养成分,同时又具有大量的生物活性物质。据张广伦等[2-3]对新疆野生粗柄羊肚菌的研究结果得知,粗柄羊肚菌子实体含水分12.86%、灰分5.21%、粗脂肪3.82%;粗柄羊肚菌中的粗脂肪由4种脂肪酸组成,其中亚油酸占56.0%,油酸占28.41%,硬脂酸占2.02%,软脂酸占13.54%。研究表明,油酸和亚油酸具有升高高密度脂蛋白(HDL),降低低密度脂蛋白(LDL)和人体胆固醇浓度的生物学功能,能够帮助机体预防动脉硬化[4],是重要的药用成分。因此,高含量的亚油酸和油酸是羊肚菌具有药用价值的重要原因之一[5]。吴素蕊等[6]对云南滇西北地区的4种黑脉羊肚菌营养成分进行分析,结果显示,黑脉羊肚菌富含多种营养成分,其粗蛋白含量约为7.87 g/100g~9.79 g/100g,粗纤维含量约17.93 g/100g~24.81 g/100g,粗脂肪含量约5.44 g/100g~6.30 g/100g,灰分含量约8.18 g/100g~10.17 g/100g;黑脉羊肚菌中总氨基酸含量在16.19 g/100g~19.50 g/100g之间,其中含人体必需的氨基酸7种,必需氨基酸含量占总氨基酸的比值约为34.97%~37.99%,每种必需氨基酸与非必需氨基酸比值(E/N)达到0.54~0.61,基本接近FAO/WHO推荐的模式,是优质的蛋白源。
超氧化物歧化酶(SOD)广泛存在于动物、植物、微生物等多种生物体内,是一类非常重要且应用较多的金属酶。Mann和Keilin[7]于1938年首次从牛红细胞中分离得到这种蓝色的含铜蛋白。随后,McCord及Fridovich[8]发现该蛋白有催化超氧阴离子自由基(·O2-),发生歧化反应的功能,证实SOD是一种极其有效的氧自由基清除剂,可平衡机体的氧自由基。在临床上,SOD已用于一些炎症、肿瘤、皮肤病、心血管病等疾病的治疗和防护。在国外,已有相关专利用于生产含SOD化妆品制剂、SOD消炎药、治疗局部缺血症SOD制剂、抗辐射SOD胶囊产品等,美、日以及西欧一些国家早已有研究人员开发人SOD药物,甚至有的已进入了Ⅱ期和III期临床试验,因而SOD是一种很有用途的药用酶,引起了国内外学者的广泛兴趣[9]。
由于特殊的生长环境,黑脉羊肚菌目前还不能进行人工栽培,无法大规模产业化种植[10],因此资源生物量十分有限。而利用野生黑脉羊肚菌子实体进行SOD的提取和利用,生产成本会非常巨大。有研究表明,利用现代发酵技术生产的羊肚菌菌丝体及其液体发酵产物,与天然生长的子实体中的营养成分和生物活性物质非常相似[11],还能大大提高产量,因此利用发酵法生产SOD是一条经济可行的途径。本文对液体培养黑脉羊肚菌胞外产SOD的培养条件,以及IAA对液体发酵培养黑脉羊肚菌胞外产SOD的影响进行了研究,期冀为羊肚菌进一步研究提供充分的理论基础,以及为日后生产奠定必要的技术依据。
1 材料与方法
1.1材料、试剂与仪器
黑脉羊肚菌菌种:由中华全国供销合作总社昆明食用菌研究所提供。
试剂:石英砂、邻苯三酚、NaH2PO3、Na2HPO3、KH2PO3、MgSO4·7H2O、EDTA·Na2、三羟甲基氨基甲烷(Tris)、盐酸、IAA,均为国产分析纯或化学纯。
培养基:麦麸、葡萄糖、蛋白胨、可溶性淀粉、黄豆粉、琼脂。
仪器:DHP-360型恒温培养箱,北京光明医疗仪器厂;ES-315型高压灭菌锅,TOMY KOGYO CO. LTD;SW-CJ-ID净化工作台,蘇州净化厂生产;HZQ-F16可控温双层震荡培养箱,太仓市豪成实验仪器制造有限公司;TU1901型双光束紫外可见光分光光度计,北京普析通用仪器有限责任公司;FE20 pH计,梅特勒—托利仪器(上海)有限公司;TGL-16G飞鸽牌冷冻离心机,上海安亭科学仪器厂;AL204型分析天平,梅特勒-托利多仪器(上海)有限公司。
1.2试验方法
1.2.1 培养基配制
(1)PDA培养基
马铃薯煮汁20%、葡萄糖2%、蛋白胨0.3%、MgSO4·7H2O 0.05%、KH2PO40.1%、琼脂2%,pH为自然。
(2)液体发酵培养基
麦麸4%(将干麦麸以蒸馏水煮沸30 min,过滤并取其汁液)、葡萄糖1%、黄豆粉1%、可溶性淀粉2%。
1.2.2 接种与培养
(1)菌种活化
无菌环境下,在超净台内将供试菌种接种于PDA培养基上,再将接入菌种的平板放入25℃恒温培养箱中培养3 d,菌丝可长满平板。
(2)发酵培养
无菌操作,在净化工作台内将活化后的菌种用内径为0.5 cm打孔器打孔,接种6块(0.1 cm2·块-1)液体培养基中,250 mL三角瓶装液量为100 mL,后将其置于可控温双层摇床中进行摇瓶培养,转速160 r·min-1,每组3个平行。
1.2.3 菌丝体湿重测定
待发酵结束后,将发酵液过滤,取菌丝体,将其用蒸馏水反复冲洗3遍,挤干水分并称量菌丝体湿重。
1.2.4 胞外SOD提取测定
提取胞外SOD:无菌操作,在超净台内将菌悬液过滤并均匀地取适量发酵液,4℃下8 000 r·min-1冷冻离心15 min,取上清液即为粗酶液。
测定胞外SOD活性:SOD酶活性测定采用改进的邻苯三酚自氧化法测定[12]。
(1)邻苯三酚自氧化速率测定
室温25℃左右,将pH8.0的0.1 mol·L-1Tris-HCl缓冲液(含有1 mmol·L-1EDTA·Na2) 2.25 mL,蒸馏水2.0 mL,4.5 mmol·L-1邻苯三酚盐酸溶液0.15 mL依次加入10 mL的离心管中。当将邻苯三酚盐酸溶液加入离心管中之后,立即将其混合并倒入比色皿中,测定混合液在325 nm条件下的吸光值,记录每30秒OD值随时间的变化,共记录330 s。计算在线性范围内每分钟吸光度值的增加量(△A325),即为邻苯三酚自氧化速率ΔA325(min)。
(2)SOD酶液抑制邻苯三酚自氧化速率测定
步骤同(1),加入0.05 mL粗酶液与邻苯三酚反应,抑制其自氧化,测定在325 nm下的吸光值,记录每30秒OD值随时间的变化,共记录330 s。每分钟吸光值的变化率ΔA’325(min),即为粗酶液对邻苯三酚自氧化速率的抑制。以缓冲液替代粗酶液作为空白对照。每组3个平行。酶活定义为25℃时邻苯三酚自氧化速率被抑制50%时所需要SOD的量为一个活力单位。SOD活力(S,U·mL-1)公式为:
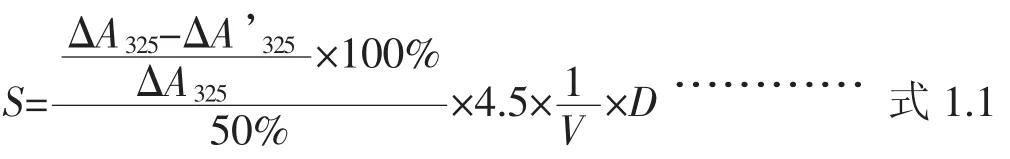
式中:△A325为邻苯三酚自氧化速率;△A’325为加入SOD粗酶液时邻苯三酚自氧化速率;V为加入粗酶液的体积(mL);D为对粗酶液的稀释倍数;4.5为反应液的总体积(mL)。
1.2.5 蛋白质含量测定
(1)绘制标准曲线
取7支试管并进行编号0~6,按表1所示加入试剂。加入碱性硫酸铜溶液后将溶液混匀,室温下放置10 min,再加入Folin-酚试剂,立即将溶液混合均匀。从第1管Folin-酚试剂加入时开始计时,共计30 min,完成后在500 nm处测光密度值,0号为空白对照管,其他每管做3个平行,取平均值。

表1 测定蛋白质含量标准曲线的试剂用量表Tab.1 Determination of the protein content of the standard curve reagent scale
以蛋白质浓度作为横坐标,所测吸光度值作为纵坐标,绘制标准曲线,如图1所示。
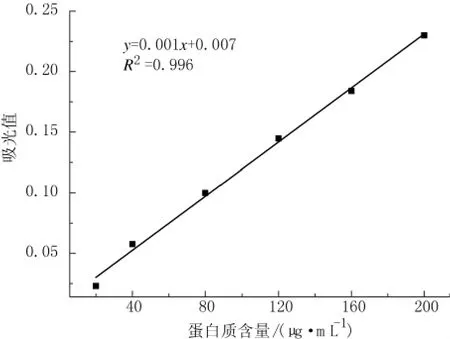
图1 蛋白质浓度标准曲线Fig.1 The standard curve of Protein density
(2)样品的测定
按照样液0.5 mL、蒸馏水0.5 mL、碱性硫酸铜溶液5 mL、Folin-酚试剂0.5 mL加样,方法同上。
SOD比活力(S0,U·mL-1)的计算公式为:

式中:S表示SOD酶液活力(U·mL-1);M表示酶液蛋白质含量(mg·mL-1)。
2 结果与讨论
2.1培养温度对SOD活性的影响
在影响真菌菌丝生长发育及中间代谢产物积累的各项物理因素中,温度是最为重要的一个[13],也是诱发活性氧产生的一个重要因素[14]。菌丝体的生长代谢及次生产物的合成都是在各种酶的催化下进行的,而适宜的温度有助于酶发挥最大的催化活性,故探寻菌丝体的最适生长温度,对于优化工艺条件有重要意义。
将接种好的液体发酵培养基分别置于10℃、15℃、20℃、25℃、28℃、30℃温度下,初始pH值为自然pH,160 r·min-1摇瓶培养,按1.2.4对胞外SOD进行提取测定并计算SOD比活力,按1.2.3称量菌丝体湿重。结果见图2。

图2 发酵培养温度对产胞外SOD的影响Fig.2 Effect of temperature on extracellular SOD produced
在15℃~35℃下对黑脉羊肚菌进行摇瓶培养,不同温度下菌丝体的生长情况以及产胞外SOD的情况如图2所示,从图2(a)可以看出在20℃下发酵培养,胞外SOD活性显示最高。图2(b)可以看出菌丝体在发酵温度为20℃~30℃的条件下生长较好,低于20℃和高于30℃时,所得菌丝体重量都较小,低温使得菌丝体生长缓慢,延长了发酵周期,高温会使部分蛋白质、核酸等活性物质发生变性,导致菌丝体的代谢功能衰退,发酵产量下降。在20℃下发酵培养时,胞外SOD酶的比活力显示最高,和菌丝体的最适生长温度(28℃)不一致,造成这种现象的原因是当培养温度适宜菌丝体生长时,菌丝体生长代谢速度加快,菌丝体的生长优于代谢产物的分泌。因此,选择20℃作为黑脉羊肚菌发酵产胞外SOD的培养温度。
2.2初始pH对SOD活性的影响
液体培养基作为菌丝体生活的外部环境,pH值的高低直接影响菌丝体的生长和产物的合成,引起各种酶活力的改变,从而影响菌丝体对培养基中营养物质的利用速率,菌丝体的生长代谢和所需产物的合成积累因此受到影响或抑制[15]。
用10%的盐酸和5%的氢氧化钠调解液体培养基的初始pH值分别为5.0、5.5、6.0、6.5、7.0,在不同初始pH值的液体培养基中20℃、160 r·min-1摇瓶培养,按1.2.4对胞外SOD进行提取测定并计算SOD比活力,按1.2.3称量菌丝体湿重。结果见图3。
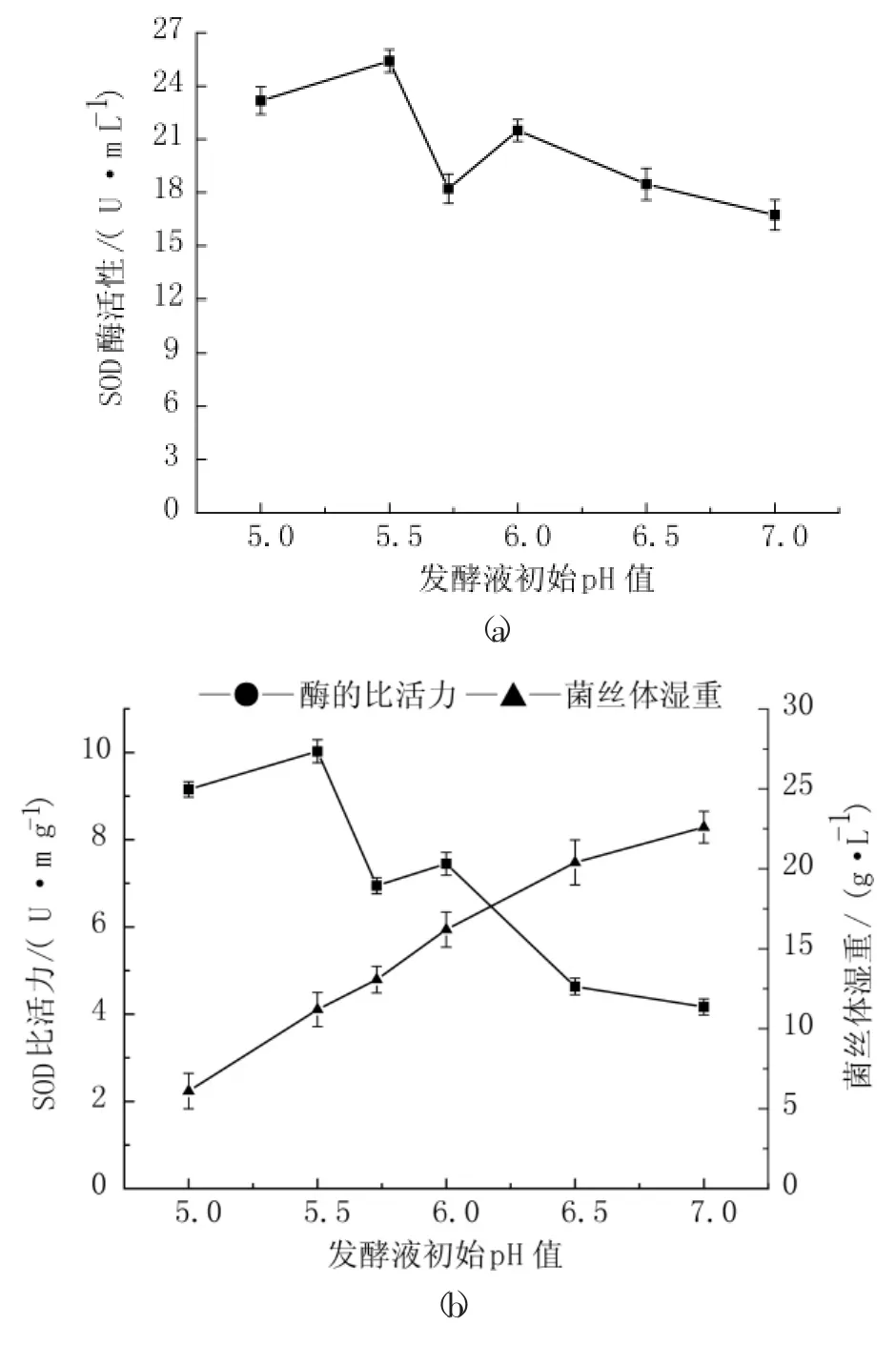
图3 发酵液初始pH对产胞外SOD的影响Fig.3 Effect of pH on extracellular SOD produced
图3(a)表明,pH5.5时,胞外SOD活力显示最高,随着pH值增大,胞外SOD活力呈下降趋势,说明偏酸的环境更能刺激胞外SOD的分泌。图3(b)表明,随着pH值增大,胞外SOD的比活力呈下降趋势。随着pH值的增大,菌丝体重量逐渐增大,在pH7时,菌丝体生长情况最好,此时菌丝体生长的最适初始pH值与产酶最适初始pH值不一致,因为实验考察的是发酵产酶情况,所以选择pH5.5作为初始pH值。
2.3培养时间对SOD活性的影响
将接种好的发酵培养基,初始pH值调至5.5,于20℃、160 r·min-1摇瓶培养不同时间,每隔1 d取样,按1.2.4对胞外SOD进行提取测定并计算SOD比活力,按1.2.3称量菌丝体湿重。结果见图4。

图4 发酵培养时间对产胞外SOD的影响Fig.4 Effect of time on extracellular SOD produced
由图4(a)可知,随着发酵时间的延长,黑脉羊肚菌发酵培养产胞外SOD的酶活性逐渐升高,至发酵第5天时,所得酶活性最高,继续延长发酵时间,酶活性反而降低了。图4(b)发现发酵第2天起菌丝开始缓慢生长,2 d~4 d为延滞期,此阶段菌丝生长较缓慢,表明此阶段细胞还处于对培养环境条件改变的适应阶段,4 d~8 d为指数期,属于菌丝体快速增长阶段,以后进入稳定期和衰亡期,菌丝体重量在第9天达到最大值,到第10天开始出现自溶现象,菌丝体重量有所下降。胞外SOD比活力也在发酵第5天时呈现最高,达到11.4 U·mg-1。因此虽然随着发酵的继续进行,菌丝体重量仍然继续增加,但从试验的目标性来考虑,主要是考察黑脉羊肚菌发酵培养产胞外SOD的情况,所以将发酵产酶的最适周期定为5 d。
2.4IAA对SOD酶活的影响
配制1 mg·mL-1的IAA标准溶液,添加到上述液体培养基中,使IAA浓度分别为0 μg·mL-1、1.0 μg·mL-1、1.5 μg·mL-1、2.0 μg·mL-1、2.5 μg·mL-1、3.0 μg·mL-1、5.0 μg·mL-1。实验考察了不同浓度的激素IAA对黑脉羊肚菌液体发酵培养产胞外SOD的影响,同时检测不同浓度的IAA对黑脉羊肚菌菌丝体生长情况的影响。结果见图5。

图5 激素对产胞外SOD的影响Fig.5 Effect of hormone on extracellular SOD produced
由图5可知,以不添加IAA作为对照,在基础培养基中添加激素IAA后,对菌丝体的生长以及胞外SOD活性均有影响,当添加浓度为1.0 μg·mL-1时,菌丝体重量达到最大,为14.03 g·L-1,与对照相比增加了30.2%,增大IAA的添加浓度,菌丝体重量仍然比对照大,但却相比低浓度(1.0 μg·mL-1)添加时的菌丝体重量减小了,当添加的浓度为5.0 μg·mL-1时,菌丝体重量减小为7.57 g·L-1,比对照组减少了29.77%,说明此时IAA的添加浓度抑制了菌丝体的生长。从原理上分析,IAA是生长素类激素,生长素的基因活化理论概述了生长素与受体结合后诱导受体构象改变,“IAA-受体”可转移到细胞核内(信号传递),使某些特定基因转录、表达,产生原初反应蛋白质(IAA信号放大),原初反应蛋白继而激活细胞壁水解酶基因,使其表达产生纤维素酶、果胶酶等,导致细胞壁中连接木葡聚糖与纤维素微纤丝之间的键断裂,使细胞壁面积扩张而松弛,增强了细胞壁的伸展性以及可塑性,细胞体积及其重量增加,最终发生不可逆增长[16]。但对于生长素类激素,浓度不同促进作用也会不同,适用浓度的范围随不同的生物而有所变化。若浓度过高,不仅不能促进其生长,反而会刺激细胞产生乙烯,引起细胞老化死亡[17]。随着IAA添加浓度的增大,胞外SOD的相对活性先升高后减小,在添加浓度为2.5 μg·mL-1,相对酶活性达到最高,比对照组增大了109.26%。
3 结论
激素利用在食用菌上的研究很多,激素可以促进菌丝体的生长,缩短其生长周期,同时也会对代谢产物的合成产生特殊的调节作用,本文考察了不同浓度的IAA对黑脉羊肚菌发酵培养产胞外SOD以及菌丝体生长的影响。实验结果表明,当在基础培养基中添加浓度为1.0 μg·mL-1IAA时,菌丝体重量增大为14.03 g·L-1,与对照相比增加了30.2%,当添加浓度为5.0 μg·mL-1时,菌丝体重量减小为7.57 g·L-1,比对照组减少了29.77%,说明适当浓度的激素能够促进菌丝体的生长,而当激素浓度过大时,会反过来抑制菌丝体的生长。随着IAA添加浓度的增大,胞外SOD的相对活性呈现先升高后减小的趋势,在添加浓度为2.5 μg·mL-1,相对酶活性达到最高,比对照组增大了109.26%。所以适当添加IAA可获得更多SOD酶量。
[1]胡克兴,董雪,范黎.羊肚菌属分子系统学研究进展[J].微生物学通报,2004,31(6):115-119.
[2]李华.羊肚菌子实体部分化学成分研究[D].吉林:吉林农业大学,2006.
[3]张广伦,肖正春.新疆野生粗炳羊肚菌的化学成分分析[J].江苏食用菌,1992(5):21-22.
[4]Cavazzoni V,Adami A,Aragozzini F.Meddpharm scientific[J]. Publishers,1994(2):119-127.
[5]张广伦,张卫明,李皞.羊肚菌的研究与利用[J].中国野生植物资源,1999,18(1):1-3.
[6]吴素蕊,侯波,郭相,等.黑脉羊肚菌营养成分分析比较[J].食品科技,2011,36(7):65-66.
[7]MannT,Keilin D.Haemocuprein and hepatoeuprein,copperprotein compounds of blood and liver in mammals[J].Proc R Soc B,1938,126(844):303-315.
[8]McCord JM,Fridovich I.Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein)[J].Journal of Biological chemistry,1969,244(22):6049-6055.
[9]盛良全,刘少民,宋增涛,等.烟草CuZnSOD同工酶的分离纯化与鉴定[J].分析测试学报,2004,23(1):23-27.
[10]陈向东,朱戎,兰进.羊肚菌研究进展[J].食用菌学报,2002,9(2):56-61.
[11]李华,包海鹰,李玉.羊肚菌研究进展[J].菌物研究,2004,2(4):53-60.
[12]邹国林,桂兴芬,钟晓凌.一种SOD的测活方法-邻苯三酚自氧化法的改进[J].生物化学与生物物理进展,1986,4(4):71-73.
[13]骆婷.桑黄生物学特性及其发酵培养条件的优化[D].合肥:安徽农业大学,2009.
[14]Bai Z,Harvey L M,McNeil B.Elevated temperature effects on the oxidant/antioxidant balance in submerged batch cultures of the filamentous fungus Aspergillus niger B1-D[J]. Biotechnology and bioengineering,2003,83(7):772-779.
[15]付天宇.基于深层发酵的羊肚菌功能性食品研究[D].吉林:吉林大学,2013.
[16]孟庆杰,王光全.植物激素及其在农业生产中的应用[J].河南农业科学,2006(4):9-12.
[17]王婉婉,季静,王罡,等.植物激素在月季中的作用及其应用[J].天津农业科学,2009,15(3):29-31.
天麻平息肝风
1平肝息风。天麻质润多液,能够养血息风,可以治疗血虚肝风内动的头痛、眩晕,亦可用于小儿惊风、癫痫、破伤风。
2祛风止痛。用于风痰引起的眩晕、偏正头痛、肢体麻木、半身不遂。
天麻适合用于内风所致的头晕。内风引起头痛的三种类型:一是肝阳上亢型,表现症状为头痛头晕同时出现;二是、痰浊中阻,表现症状为经常感觉头偏沉;三是肾虚病人,表现症状为头痛头晕同时伴有记忆力减退的症状。天麻对感冒引起的头痛、头晕不合适。
天麻有镇静、镇痛、抗惊厥作用;能增加脑血流量,降低脑血管阻力,轻度收缩脑血管,增加冠状血管流量;能降低血压,减慢心率,对心肌缺血有保护作用;天麻多糖有免疫活性。
中国食用菌商务网 2015.04.30
Effect of Indole Acetic Acid(IAA)on Extracellular SOD Activity of M.angusticeps
LI Fei-xiang1,ZHANG Li1,WU Su-rui2,ZHAO Tian-rui1,ZHANG Xin2
(1.Yunnan Institute of Food Safety,Kunming University of Science and Technology,Kunming 650500,China; 2.Kunming Edible Fungi Institute of All China Federation of Supply and Marketing Cooperatives,Kunming 650221,China)
By optimizing the liquid fermentation medium of environmental conditions,and indole acetic acid (IAA) were added in the medium to study the effects of IAA in fermentation production on the extracellular SOD and the growth of mycelial of M.angusticeps.The results showed that in the process of fermentation,the optimal culture conditions for mycelial growth was that:temperature 28℃,initial pH7,culture time 9 d.The optimal culture conditions for enzyme production was that:temperature 20℃,initial pH5.5,culture time 5 d.When the concentration of IAA added was 1.0 μg·mL-1,the maximum weight of mycelium was 14.03 g·L-1,and when it was 2.5 μg·mL-1,the relative enzymatic activity was the highest.
IAA;M.angusticeps;extracellular SOD;enzymatic activity
S646.9
A
1003-8310(2015)03-0051-06
10.13629/j.cnki.53-1054.2015.03.013
“十二五”国家科技支撑计划课题(2013BAD16B01);云南省科技厅对外科技合作计划省院省校科技合作专项资助项目(2012IB008)。
李飞翔(1988-),男,在读硕士研究生,研究方向:轻工技术与工程。E-mail:lifeixiang888@126.com
**通信作者:吴素蕊(1978-),女,硕士,副研究员,主要从事食用菌精深加工与开发利用方面研究。E-mail:wusurui@163.com
2015-03-10

