38株灵芝子实体抗肿瘤质量的生物评价*
余梦瑶,许晓燕,魏 巍,江 南,邱欣玉,2,罗 霞**
(1.四川省中医药科学院,四川 成都 610041;2.四川大学 生命科学学院,四川 成都 610041)
〈生理生化〉
38株灵芝子实体抗肿瘤质量的生物评价*
余梦瑶1,许晓燕1,魏 巍1,江 南1,邱欣玉1,2,罗 霞1**
(1.四川省中医药科学院,四川 成都 610041;2.四川大学 生命科学学院,四川 成都 610041)
针对38株灵芝子实体样品,开展醇提物抑制HeLa、SK-OV-3肿瘤细胞增殖活性和三萜含量测定研究,对其抗肿瘤质量进行评价,筛选具有开发抗肿瘤产品潜力的优质菌株。实验结果表明,33号、34号2株灵芝对HeLa细胞和SK-OV-3细胞均具有较强的杀伤作用,对2株细胞增殖抑制IC50分别为16.55 μg·mL-1、10.2 μg·mL-1和31.9 μg·mL-1、30.64 μg·mL-1,可作为优质资源进行进一步开发。各菌株灵芝子实体的三萜含量在1.372 mg·g-1~6.184 mg·g-1之间,不同菌株子实体间三萜含量差异较大,细胞增殖抑制活性与三萜含量间不具有相关性,提示灵芝抗肿瘤原料质量评价宜考虑补充生物质量评价方法。
灵芝;抗肿瘤;三萜;生物评价
灵芝属真菌具有广泛的药理活性,具有悠久的药用历史,广泛收录于《神农本草经》、《名医别录》、《本草纲目》等历代典籍之中。临床研究表明,灵芝在肿瘤辅助治疗方面具有较好的疗效[1]。药理研究表明,灵芝抗肿瘤有效组分主要为灵芝多糖和灵芝三萜[2],其中灵芝三萜类成分具有直接杀伤肿瘤细胞的作用[3],其作用与诱导细胞凋亡等机制有关[4]。
目前,对灵芝药材质量控制的主要方法是测定其总多糖和总三萜含量。但是,由于栽培菌株繁多,栽培条件难以精确控制,灵芝作为真菌这一“高创造系数”的生物资源[5],次生代谢产物的生成受到遗传、发育阶段、环境的三重影响,其总三萜的产量和组分比例变化巨大[6]。尽管研究报道,采用指纹图谱技术构建了灵芝三萜的指纹特征与其肿瘤抑制率之间的关联系数和关联度[7],但由于缺乏内控指标、方法较为复杂、易受操作影响等,其应用尚不广泛。
中药质量的生物活性评价具有整体可控、药效相关等技术优势,作为符合中医药特点的适用质量控制模式及方法,逐渐成为中药质量控制和评价的重要发展方向之一[8]。如板蓝根颗粒已建立基于化学组分分析—生物测定关联分析的质量控制方法[9]。
本研究针对38株栽培灵芝子实体,分别测定其醇提物对HeLa、SK-OV-3细胞增殖抑制IC50和总三萜含量,以期评价不同灵芝子实体的药材质量,为后续相关产品开发提供优质资源,同时为今后灵芝抗肿瘤质量的生物评价方法的建立奠定基础。
1 材料与方法
1.1材料
1.1.1 灵芝
灵芝菌株38株,由山东省泰安市农科院食用菌研究所在统一条件下袋料栽培,其编号及名称详见表1。

表1 38个灵芝菌株编号及名称Tab.1 The list of 38 Ganoderma lucidum strains
1.1.2 细胞
人宫颈癌细胞株HeLa、人卵巢癌细胞株SKOV-3购自中科院上海细胞库。细胞以含10%胎牛血清的DMEM高糖培养液(含NaHCO31.5 g·L-1、青霉素100 U·mL-1、链霉素100 U·mL-1) 置于37℃,5%CO2细胞培养箱中培养,每隔2 d~3 d传代1次。
1.1.3 试剂
DMEM培养基购自Gibco公司;胎牛血清购自Hyclone公司;MTT、胰酶、EDTA购自Sigma公司;齐墩果酸购自中国药检所,其余试剂均为国产分析纯。
1.2方法
1.2.1 样品制备
各灵芝子实体粉碎后,置于50℃的烘箱中烘干。准确称取10 g灵芝粉末,加入20倍体积95%乙醇,50℃超声提取1 h,过滤,重复提取1次,合并滤液,将滤液减压蒸干,获得灵芝乙醇提取物。称取灵芝乙醇提取物,以DMSO准确配制成100 mg·mL-1溶液,分装,-20℃保存备用。
1.2.2 灵芝乙醇提取物对肿瘤细胞增殖抑制的影响
取处于对数生长期肿瘤细胞,胰酶消化,制备细胞悬液。调整细胞浓度,每孔加入细胞悬液180 μL,每孔接种6×103个细胞,置于细胞培养箱中培养过夜。加入灵芝乙醇提取物溶液20 μL,使样品终浓度分别为100 μg·mL-1、31.6 μg·mL-1、10 μg·mL-1、3.16 μg·mL-1、1 μg·mL-1,同时设置空白孔和对照孔,每个处理设3个复孔。细胞板继续培养48 h后,吸去培养液,加入100 μL PBS溶液和10 μL MTT溶液(5 mg·mL-1),继续培养4 h后,加入100 μL10%SDS溶液(0.01 mol·L-1HCl配制),待甲臢结晶溶解后,570 nm处测定吸光度。按以下公式计算抑制率(P,%):
P=(OD1-OD2)×100%/(OD1-OD3)
式中:OD1表示对照组OD值;OD2表示样品组OD值;OD3表示空白组OD值。
采用Curve Expert软件,计算各株灵芝子实体乙醇提取物对肿瘤细胞增殖抑制IC50。
1.2.3 灵芝三萜的测定
灵芝三萜含量参照文献 [10]方法测定。
1.2.4 相关性分析
选择肿瘤细胞增殖抑制IC50<100 μg·mL-1的样品,对其肿瘤细胞增殖抑制IC50与三萜含量,采用SPSS 18.0软件进行相关性分析。
2 实验结果
2.1灵芝乙醇提取物对肿瘤细胞增殖抑制的影响
灵芝乙醇提取物对肿瘤细胞增殖抑制IC50与子实体三萜含量见表2。

表2 灵芝乙醇提取物对肿瘤细胞增殖抑制IC50与子实体三萜含量Tab.2 The IC50of ethanol extracts on tumor cells proliferativeinhibition and the triterpene content of 38 Ganoderma lucidum strains
在肿瘤细胞培养体系中加入不同灵芝子实体乙醇提取物后,HeLa和SK-OV-3细胞增殖均出现抑制现象,显微镜下观察可见细胞形态变化,折光度减弱,细胞数量减少,并呈现剂量依赖关系,但不同样品的抑制效果有明显差异。经对肿瘤细胞增殖抑制IC50计算发现,38个灵芝样品中,有23个样品对 HeLa增殖抑制 IC50<100 μg·mL-1,占总数的60.53%;有8个灵芝样品对SK-OV-3细胞增殖抑制IC50<100 μg·mL-1,占总数的21.05%。所有样品中,33号、34号2株灵芝对HeLa细胞和SK-OV-3细胞均具有较强的杀伤作用,对2株细胞增殖抑制IC50分别为16.55 μg·mL-1、10.2 μg·mL-1和31.9 μg·mL-1、30.64 μg·mL-1。
2.2灵芝子实体三萜含量
灵芝子实体三萜含量测定结果如表2所示,各灵芝子实体的三萜含量在1.372 mg·g-1~6.184 mg·g-1之间,不同菌株子实体间三萜含量差异较大,含量最低的34号与含量最高的40号样品之间,三萜含量相差达4.5倍。
2.3相关性分析
从表2中可以看出,38个灵芝样品的三萜含量与乙醇提取物对肿瘤细胞增殖抑制IC50间无明显必然联系,肿瘤增殖抑制活性最高的33号、34号2个样品,其三萜含量仅为2.778 mg·g-1和1.372 mg·g-1,而三萜含量较高的27号样品,其对HeLa和SKOV-3细胞增殖抑制IC50均超过了100 μg·mL-1。肿瘤细胞增殖IC50与三萜含量相关性分析见图1。
选择IC50<100 μg·mL-1的样品进行IC50与三萜含量的相关性分析发现,其散点图呈散布式分布,统计发现HeLa细胞和SK-OV-3细胞增殖抑制IC50与三萜含量间的相关系数分别为0.124和0.253,但其无统计学意义(p>0.05),表明肿瘤细胞增殖抑制IC50与三萜含量间不存在相关性。
3 讨论
灵芝在肿瘤辅助治疗方面的疗效,在临床已得到普遍认同[11],并得到大量体内外药理研究证实[12]。本研究通过对38株灵芝子实体开展其醇提物对HeLa、SK-OV-3细胞增殖抑制活性和总三萜含量的测定研究,筛选获得33号、34号2株具有显著体外肿瘤细胞增殖抑制的菌株,可为后续相关产品的开发提供优质的种质资源。
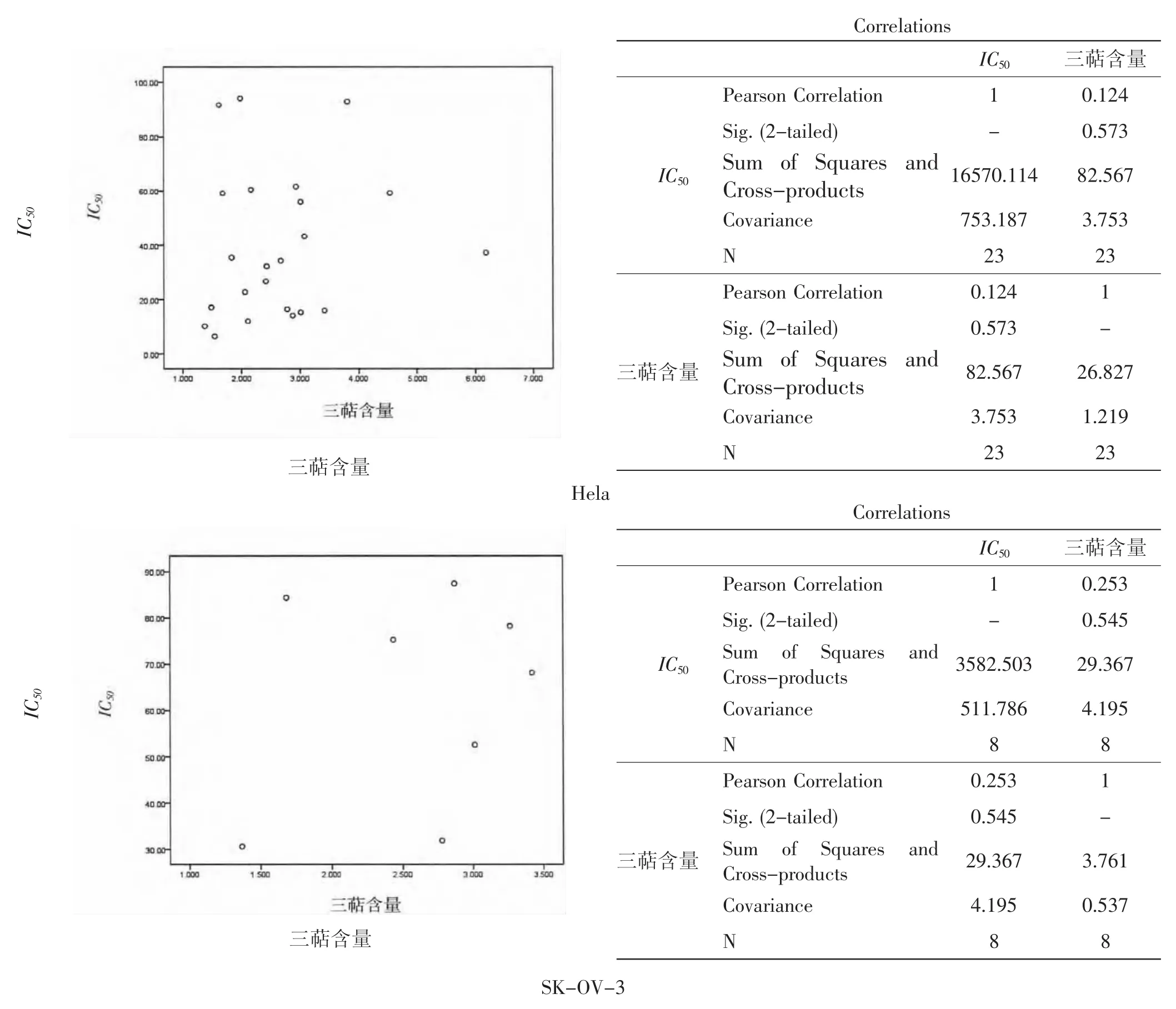
图1 肿瘤细胞增殖抑制IC50与三萜含量相关性分析Fig.1 Correlation analysis on the IC50of tumor cells proliferative inhibition and the triterpene content
本研究采用体外细胞试验,观察灵芝醇提物对HeLa、SK-OV-3细胞增殖抑制作用,结果发现灵芝子实体醇提物对2种细胞株增殖均有抑制作用,与前人结果相符。同时也发现,灵芝子实体醇提物对肿瘤细胞增殖抑制的作用强弱有较大差异,HeLa细胞对灵芝醇提物更为敏感,提示灵芝抗肿瘤作用可能存在一定的组织来源差异性。
本研究对在相同条件下栽培的不同灵芝菌株子实体三萜含量测定发现,其三萜含量存在明显差异,表明灵芝的遗传背景与三萜形成密切相关。同时研究也发现,灵芝子实体总三萜含量与肿瘤细胞增殖抑制效应间无相关性,分析可能原因可能为:一是灵芝子实体中除三萜类成分外,还含有其他的抗肿瘤活性成分,如生物碱、甾醇类成分[13];二是不同三萜单体抗肿瘤活性差异较大,而不同灵芝子实体所含具有高抗肿瘤活性的三萜成分含量差异较大;三是一些三萜单体可能具有配伍效应,而不同灵芝子实体三萜单体组成差异不同导致抗肿瘤活性差异。现有灵芝质量评价标准仍以总多糖和总三萜含量为主。本研究发现,就灵芝抗肿瘤产品开发需求而言,总三萜的评价标准难以适应产品对原料的质量要求。生物质量评价能够直接反应药物的疗效,通过生物质量评价与先进药物分析技术的结合,能够建立更为全面合理的中药质量标准[14]。本研究初步发现,肿瘤细胞增殖抑制IC50测定方法相对简便,重复性高,可作为灵芝生物质量评价的一个候选方法。该方法可进一步与指纹图谱等技术相结合,建立灵芝抗肿瘤原料—中间物—产品的质量标准,为灵芝产品的现代化、国际化发展奠定良好的基础。
[1]王圣忠.双灵固本散对肿瘤放疗的增效减毒作用[J].浙江中医杂志,2006,41(8):494-495.
[2]Lin ZB,Zhang HN.Anti-tumor and immunoregulatory activities of Ganoderma lucidum and its possible mechanisms[J]. Acta Pharmacol Sin.,2004,25(11):1387-1395.
[3]魏晓霞,李鹏,许建华,等.灵芝三萜组分GLA体内外抗肿瘤作用的研究 [J].福建医科大学学报,2010(6):417-420.
[4]Feng L,Yuan L,Du M,et al.Anti-lung cancer activity through enhancement of immunomodulation and induction of cell apoptosis of total triterpenes extracted from Ganoderma luncidum (Leyss.ex Fr.)Karst[J].Molecules,2013,18(8): 9966-9981.
[5]Bode HB,Bethe B,Hofs R,et al.Big effects from small changes:possible ways to explore nature’s chemical diversity [J].Chem Bio Chem,2002(3):619-627.
[6]张劲松,贾薇,唐传红,等.中国栽培灵芝的研究 [C]//国际灵芝研究学术会议论文集.北京:中国药理学会,2011.
[7]史先敏.中国栽培灵芝三萜成分的高效液相指纹图谱研究[D].南京:南京农业大学,2008.
[8]肖小河,鄢丹,王伽伯,等.关于中药质量生物检定的几点商榷[J].世界科学技术—中医药现代化,2009,11(4):504-508.
[9]谭曼容,鄢丹,邱玲玲,等.中药生产过程中质量生物评控方法研究//以板蓝根颗粒为例 [J].中国中药杂志,2012,37(8):1122-1126.
[10]王伟,尚德静,温磊.灵芝发酵菌丝三萜类化合物含量的测定[J].中国食用菌,2006,25(1):30-32.
[11]Jin X,Ruiz Beguerie J,Sze DM,et al.Ganoderma lucidum (Reishi mushroom) for cancer treatment[J].Cochrane Database Syst Rev.,2012(6):CD007731.
[12]Wu GS,Guo JJ,Bao JL.Anti-cancer properties of triterpenoids isolated from Ganoderma lucidum-a review[J]. Expert Opin Investig Drugs,2013,22(8):981-992.
[13]Lee MK,Hung TM,Cuong TD.Ergosta-7,22-diene-2β,3α, 9α-triol from the fruit bodies of Ganoderma lucidum induces apoptosis in human myelocytic HL-60 cells[J].Phytother Res.,2011,25(11):1579-1585.
[14]肖贵南,李瑾翡,陈浩桉.生物活性测定在中药质量标准中应用的可行性及研究思路 [J].中药材,2008,31(4):473-475.
The Bio-assay on Anti-tumor Quality Evaluation of the Fruit Bodies of 38 Ganoderma lucidum Strains
YU Meng-yao1,XU Xiao-yan1,WEI Wei1,JIANG Nan1,QIU Xin-yu1,2,LUO Xia1
(1.Sichuan Academy of Chinese Medicine Sciences,Chengdu 610041,China; 2.College of Life Science,Sichuan University,Chengdu 610041,China)
In order to evaluate the anti-tumor quality of the fruit bodies of 38 Ganoderma lucidum strains,the IC50of proliferative inhibition on HeLa and SK-OV-3 cells and the triterpene content was measured.The IC50of two strains,No.33 and No.34, on HeLa and SK-OV-3 cells was 16.55 μg·mL-1,10.2 μg·mL-1and 31.9 μg·mL-1,30.64 μg·mL-1,respectively,which were identified as the potential materials for anti-tumor products developing.The triterpene content of the Ganoderma lucidum fruit bodies was between 1.372 mg·g-1to 6.184 mg·g-1,and was varied extensively in different strains.Meanwhile,the relationship between the activities of anti-tumor and triterpene content was not found.And it suggested that the bio-assay may be taken into consideration in the further anti-tumor quality evaluation of Ganoderma lucidum.
Ganoderma lucidum;anti-tumor;triterpene;bioassay evaluation
S646.9
A
1003-8310(2015)02-0047-05
10.13629/j.cnki.53-1054.2015.02.013
菌类药材研究与开发四川省科技创新团队(2011JTD0021);四川省科技支撑计划项目(2013NZ0029);四川省十二五育种攻关项目(2011NZ0098-12-04);四川省食用菌精深加工研究岗位建设项目 [川农业(2009)75号];四川省微生物资源共享平台——农业微生物平台项目;四川省重大科技计划项目(2012NZ0003)。
余梦瑶(1981-),男,博士,副研究员,主要从事菌类药材方面研究。E-mail:yumengyao@gmail.com
**通信作者:罗霞(1974-),女,博士,研究员,主要从事菌类药材方面研究。E-mail:lx1443_cn@sina.com
2014-12-19

