黄树莓离体培养及脱毒技术研究
田新华,翁海龙,曹焱,郭树平(黑龙江省林业科学研究所,黑龙江哈尔滨150081)
黄树莓果实营养丰富,含有多种维生素、氨基酸和矿质元素、鞣化酸、超氧化物岐化酶(SOD)等特殊生理活性物质[1-2]。果实鲜黄,气味芳香,入口先酸后甜,深受欧美等国欢迎,既可鲜食果品,又可加工成果汁、罐头等多种食品。同时黄树莓叶片提取物粗黄酮是一种良好的天然抗氧化剂,具有降血糖、降血脂、抗氧化高效性与低毒性等生理活性[3]。
然而植株受病毒感染积累,导致叶片黄化、产量下降,果实品质变劣且可遗传给后代,给生产造成重大的经济损失,严重影响了黄树莓优良品种的推广。
国外采用组织培养方法进行苗木的脱毒快繁[4],既可保持植物的优良特性和性状,又防止品种过快退化,生产上己实现了无毒苗良种化[5]。目前,黄树莓优质苗木的快速生产与无毒苗的大力推广己成为制约我国黄树莓产业发展的瓶颈因素。因此,笔者对引进优质黄树莓品种展开组培脱毒快繁技术研究,旨在提出一套完整的苗木脱毒培养技术体系,为无毒苗木的生产提供技术支持。
1 材料与方法
1.1 试验材料及处理 供试材料为黑龙江省园艺分院引进的美国黄树莓,采集一年生枝条为外植体,用刀片切去叶片及部分叶柄,先用洗涤剂清洗一遍,然后流水冲洗30 min,剪取长1.0~2.0 cm的带芽茎段,在超净工作台上用0.1%氯化汞溶液表面灭菌,灭菌时间分别为4、6、8 min 3种处理,灭菌后用无菌水冲洗3次,并于无菌水中浸泡40~60 min后取出用无菌滤纸吸干材料表面多余水分,备用。
1.2 试验方法
1.2.1 诱导侧芽萌发。剪去茎段两端多余部分后,在无菌条件下将单芽茎段接种于MS+6-BA 1.0 mg/L+IBA 0.1 mg/L+GA30.5 mg/L培养基中,诱导侧芽萌发生长。
1.2.2 正交试验设计筛选芽增殖培养基。待茎段腋芽伸长后,分别转接于以MS为基本培养基,以6-苄基腺嘌呤(6-BA)、赤霉素(GA3)、萘乙酸(NAA)为3个因素,每因素设置3个水平,采用正交试验设计L9(34)进行芽增殖培养基筛选(表1)。每个处理2次重复,每个重复接种10瓶,培养35 d后调查结果。
1.2.3 单因素试验设计筛选生根培养基。剪取苗高1.5~2.0 cm的单芽茎段,分别转接于以下5种生根培养基:①1/2MS+IBA 0.2 mg/L;②1/2MS+IBA 0.4 mg/L;③1/2MS+NAA 0.2 mg/L;④1/2MS+NAA 0.4 mg/L;⑤1/2MS+IBA 0.2 mg/L+NAA 0.2 mg/L中进行试管苗生根培养,培养30 d后调查结果。每个处理2次重复,每个重复接种10瓶。上述培养基均加蔗糖30 g/L,日产琼脂粉6 g/L,pH调至5.8。
以上培养条件均为:白天温度(25±1)℃,夜间温度(20±1)℃,光照强度2 000 lx,光照时间12 h/d。
1.2.4 试管苗移栽试验。将已经生根的黄树莓试管苗在常温、自然光下逐渐揭开封口膜,炼苗3~5 d,初期每天喷雾4次,逐渐减少喷雾次数。然后将苗取出,用清水洗去根部培养基,再用0.1%的代森锌溶液浸泡15 min,移栽到用0.5%高锰酸钾溶液消毒的以下基质中:①草炭;②树皮+阔叶(1∶1);③针叶+树皮+草腐菌菌糠(1∶1∶1);④草炭+稻壳+树皮(1∶1∶1);⑤针叶+锯末(1∶1)中。用塑料膜覆盖7 d保持空气相对湿度在75%左右,适当喷水。每个处理栽种30株,重复3次。30 d后统计成活率及苗木生长状况。
1.2.5 黄树莓茎尖脱毒试验
1.2.5.1 微茎尖脱毒培养试验。将生长良好的试管苗切成单芽茎段,在100×显微镜下用解剖针剥取鳞片和叶原基(解剖针放入0.1%的HgCl2溶液中灭菌10 min,然后用无菌水反复冲洗干净),当形状为一个闪亮半圆球的顶端分生组织充分暴露出来时,用手术刀片将茎尖分生组织切下,分别切取 0.1、0.2、0.5 mm 微茎尖接入培养基中,培养 30、80、130 d分别观察并记录。
1.2.5.2 微茎尖脱毒培养基础上的热处理试验。将继代或生根的茎尖脱毒苗置于光照培养箱中,用热空气处理脱毒。相对湿度保持75% ~85%,光照强度为2 500~3 000 lx,光周期14 h/10 h(光照/黑暗)。然后通过初始25℃,25~36℃每天增加0.5℃,36~38℃时每2 d增加0.5℃,38℃时保持7 d,此后再每2 d增加0.5℃,随时观察记录结果,当有植株出现严重烫伤症状或枯死时停止加温,准备二次切取茎尖。供试苗木10株,重复2次,记录热处理效果。
1.2.5.3 热处理脱毒基础上的二次微茎尖脱毒试验。将经过热处理且生长较好的试管苗放在超净工作台上,置于100×显微镜下,剥取微茎尖,方法与“1.2.5.2”同。此次剥取0.5 mm的长度进行二次微茎尖培养,30、60、90 d分别观察结果并记录。
1.2.5.4 病毒检测。运用酶联检测仪(ELISA)进行脱毒结果检测。
1.2.5.5 脱毒苗增殖和生根试验。将经病毒检测后的黄树莓脱毒苗参照上述增殖、生根培养试验所得出的最佳培养方法,重复扩繁生根培养。
1.3 数据统计与分析 采用数据统计软件DPS7.05对试验结果进行方差分析和差异显著性测验(SSR法)[6]。
2 结果与分析
2.1 不同灭菌时间对黄树莓外植体的影响 在接种后第3天观察外植体,发现灭菌不彻底的茎段开始出现污染现象。经氯化汞灭菌4 min的试材污染率较高;灭菌4 min和6 min的试材均无褐化现象,灭菌8 min的试材无污染但部分外植体切口处出现褐化。这说明氯化汞灭菌6 min可以达到灭菌的目的,且对黄树莓外植体无损伤(表2)。
2.2 诱导黄树莓侧芽生长情况 观察表明,腋芽在初代培养基上培养3 d开始萌动,培养7 d节间伸长,小叶片展开。
2.3 不同处理对黄树莓苗木增殖的影响 将伸长的茎梢切成茎段,单芽茎段转入增殖培养基。对不同处理增殖培养35 d的试管苗进行极差分析,结果表明,对于株高影响最大的因素是GA3(B),说明赤霉素的含量直接影响试管苗的向上生长速度,在该试验所选定的浓度范围内,试管苗的株高随赤霉素含量的升高而增加;6-BA(A)是影响试管苗增殖培养的主要因素,且在该试验所选定的浓度范围内,试管苗的增殖分化数随6-BA含量的增加而增加。方差分析结果表明,A、B、C因素间差异极显著(P<0.01)。植株上部生长情况的多重比较结果显示,以处理③培养的试管苗向高生长最快,且处理间差异显著;以处理⑧培养的试管苗分化增殖苗数最多,且与其他处理间差异显著(P<0.05)。对于分化增殖培养而言,在保证试管苗增殖率的前提下,应选择苗木生长旺盛的处理。因此,选择培养基(即处理⑧)MS+6-BA 2.0 mg/L+GA30.5 mg/L+NAA 0.05 mg/L 为黄树莓的分化增殖培养基,分化苗数较多,植株生长健壮(表3)。
2.4 不同处理对黄树莓试管苗生根的影响 当苗高1.5~2.0 cm时,切取单芽分别转接于生根培养基进行培养。培养10 d左右开始长出白色的根,根较细,但根系密集,分支较多。对培养30 d的试管苗进行方差分析,结果表明无论从生根数量还是根长方面,各处理间差异极显著(P<0.01)。经SSR法多重比较结果(表4)表明,无论从生根数量还是根长,均以处理①最好,经处理①培养30 d的试管苗平均生根9.48条,长度达2.0 cm。生根速度快,根系生长旺盛,分支多,吸收能力强,有利于提高移栽成活率。因此,选择培养基(即处理①)即1/2MS+IBA 0.2 mg/L为黄树莓的生根培养基。

表4 不同处理苗木生根数量和生根长度
2.5 黄树莓试管苗移栽 由表5可知,处理③[即针叶+树皮+草腐菌菌糠(1∶1∶1)]培养的苗木长势较好,茎杆相对粗壮,有效光合叶片数较多,易于有机物的合成与积累,有利于苗木进一步生长繁殖。

表5 移栽苗长势情况
2.6 黄树莓茎尖脱毒培养研究
2.6.1 微茎尖脱毒培养效果。由于病毒在植物体内分布不均性,茎尖没有病毒或浓度较低。因此该试验采用生长发育快的试管苗进行茎尖脱毒培养。结果表明,不同规格的茎尖其显绿时间、成苗时间和成苗率不同(表6)。
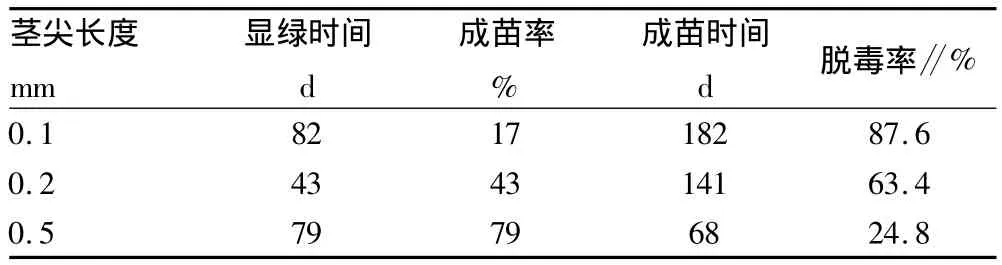
表6 微茎尖脱毒培养生长情况
采用不同程度的微茎尖脱毒处理,理论上茎尖越小带毒概率越低,但综合考虑苗木脱毒效率、成活率和成苗时间等因素,故采用0.2 mm作为微茎尖处理的最适长度。0.5 mm茎尖的成苗率最高,但脱毒效果不好;0.1 mm的茎尖剥取困难,且成苗率低。
2.6.2 微茎尖脱毒培养基础上的热处理脱毒效果。通过不同温度处理的预试验与资料参考[7],确定试管苗的耐热温度与极限温度的保持时间,从而筛选出黄树莓合理有效的热处理脱毒途径。
试验结果表明,通过初始25℃培养,然后采取温度逐渐上升的方式,在38~40℃保持时间较长;继代苗、生根苗所能承受的极限温度也不同,分别为37.2和40.8℃,保持时间分别为13和15 d,此时导致病毒致死或钝化。同时生根苗在各个温度梯度的抗热性明显优于继代苗。
2.6.3 热处理基础上的二次微茎尖脱毒研究。由表7可知,利用腋芽进行二次微茎尖处理比顶芽茎尖效果好,由于在极限温度下,顶芽处于细胞分裂生长时期,极限温度导致其愈伤组织生理发生变异,玻璃化现象明显,而腋芽在温度适宜时形成,以后基本处于分化停滞阶段,培养环境的剧烈温度变化对其伤害相对较小。

表7 二次微茎尖脱毒培养生长情况
经过上述脱毒培养的试管苗按照筛选出的苗木扩繁、生根培养基配方培养,获得脱毒组培苗木(图1)。
3 结论与讨论
(1)增殖培养是试管苗快速繁育的基础,只有选择合适的激素及浓度才有利于黄树莓组培苗的生长繁育。该试验结果表明,美国黄树莓的最适增殖培养基配方为MS+6-BA 2.0 mg/L+GA30.5 mg/L+NAA 0.05 mg/L,分化苗数较多,叶色深绿,植株生长健壮。以1/2MS+IBA 0.2 mg/L为黄树莓的生根培养基,生根率较高,生根速度快,根系生长旺盛,分支多,吸收能力强,有利于提高移栽成活率。对于黄树莓而言,激素IBA、NAA均可促进其生根,说明它对于生根激素的要求较宽泛。
(2)该研究应用二次微茎尖脱毒和热处理脱毒相结合的脱毒措施对美国引进黄树莓进行了研究,揭示了对黄树莓用0.2、0.5 mm微茎尖进行二次茎尖脱毒并结合热处理的最佳脱毒方法,应用ELISA特异性植物病毒检测法对其脱毒效果进行了检测。该研究建立了黄树莓全程脱毒苗工厂化育苗的快繁体系,应用此技术模式可大规模进行脱毒苗工厂化育苗,解决了目前制约我国黄树莓产业快速发展的瓶颈问题,为快速建立我国黄树莓产业基地与无毒苗良种化的大面积推广起到了推动作用。
(3)对于移栽试验而言,掺有稻壳的基质黄树莓试管苗成活率低,且此类基质保水性差,极易失水,造成苗木萎蔫,不建议使用稻壳作为试管苗移栽基质组成成分。
[1]张建成,屈红征.树莓的栽培利用及发展前景[J].河北林果研究,2004,19(4):387 -391.
[2]桑建忠,顾姻.中国东南部部分悬钩子果实的营养成分[J].植物资源与环境学报,1995,4(2):22 -26.
[3]徐雅琴,李淑芹,付红.黄树莓叶片中黄酮类物质的提取及抗氧化性[J].化学研究与应用,2002,14(6):739 -741.
[4]傅润民.果树无病毒苗与无病毒栽培技术[M].北京:中国农业出版社,1997.
[5]PAULIINA P.Changes in carbonhydrates and freezing tolnrance during cold acclimation of red raspberry cultivars grown in vitro an in vivor[J].Physiologya Plantarum,2001,110:393 -401.
[6]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002.
[7]贺立恒.美国红树莓和黑树莓脱毒快繁及工厂化育苗研究[D].北京:中国农业大学,2005:36-37.

