贝伐珠单抗联合化疗治疗44例晚期持续//复发性子宫肉瘤△
韩瑛 李淑敏白萍 张蓉
北京协和医学院中国医学科学院肿瘤医院妇瘤科,北京100021
子宫肉瘤是一种较少见的女性生殖系统恶性肿瘤,其在女性人群中的发病率为1.23~1.7/10万[1-2],占妇科恶性肿瘤的1%~3%,占子宫体恶性肿瘤的3%~5%[3]。子宫肉瘤的生物学行为具有高度的侵袭性,即使早期患者也常发生局部复发和远处转移。全子宫切除是目前治疗早期子宫肉瘤的标准术式,而晚期持续/复发性子宫肉瘤治疗困难,多采用以化疗为主的综合治疗,但其化疗的有效率低,接受一线化疗的患者其有效率也仅为30%[3]。因此,有必要探寻治疗晚期持续/复发性子宫肉瘤的有效药物和方法。本文回顾性分析我院接受BEV联合化疗治疗的4例晚期持续/复发性子宫肉瘤患者,并结合文献探讨BEV联合化疗治疗子宫肉瘤的疗效和安全性。
1 资料与方法
1.1 资料来源
回顾性分析中国医学科学院肿瘤医院2006年5月至2014年5月间接受BEV联合化疗治疗的4例晚期持续/复发性子宫肉瘤患者资料,包括2例晚期(Ⅳ期)持续性子宫肉瘤患者(1例BEV一线治疗,1例BEV二线治疗),2例治疗后复发的子宫肉瘤患者(1例BEV二线治疗,1例BEV三线治疗)。4例患者的病理类型分别为:未分化子宫肉瘤1例、癌肉瘤2例、平滑肌肉瘤1例。患者年龄为44~79岁,平均年龄为61岁。治疗前患者的Karnofsky评分均≥80分。具体见表1。
1.2 治疗方法
BEV7.5 mg/kg,加入 100 ml 0.9%NaCl中,于化疗开始前1 h或化疗结束后1 h静脉滴注60 min,每2周或3周1次。用药过程中注意监测血压和心率变化,首次用药前可用地塞米松10 mg静脉入壶进行预处理。同时联用的化疗药物包括:达卡巴嗪(DTIC)、顺铂(DDP)、依托泊苷(VP-16)、表阿霉素(EPI)、紫杉醇(T)、卡铂(CBP)。所有患者开始BEV联合化疗前均停止治疗至少4周以上,开始化疗前检查肝肾功能、血常规、尿常规和心电图均正常,并进行腹部和盆腔CT扫描,必要时还扫描胸部CT以评价肿瘤情况。治疗前所有患者均签署知情同意书。4例患者接受BEV治疗的次数为4~12次,平均8.3次;与化疗联合完成的周期数为4~8个周期,平均6个周期。其中1例患者接受BEV 7.5 mg/kg静脉滴注,每2周1次,共12次(每4周为1个周期),其余3例患者均为BEV 7.5 mg/kg静脉滴注,每3周1次,联合化疗同步。但有1例患者因联合化疗8个周期后,不能耐受Ⅳ度骨髓抑制(血小板为13×109g/L),而改用单药BEV维持治疗3次(每3周1次)。
1.3 疗效评价
所有患者均接受2个周期以上的BEV治疗后疗效评价。采用WHO实体瘤疗效评价标准(RECIST 1.1版,2009年)进行判断,分为:肿瘤完全缓解(complete response,CR);部分缓解(partial response,PR),稳定(stable disease,SD)和疾病进展(progressive disease,PD)。临床化疗总有效率=CR+PR,临床获益率=CR+PR+SD。
1.4 毒性评价
按照美国国立癌症研究所(NCI)的常见毒性标准评价BEV联合化疗的相关毒性,患者接受1个周期的BEV治疗后即开始评价其毒性。用血压计、心电监测仪及心电图检查判断心血管毒性,泌尿系统的毒性经尿常规和肾功能检查评判。毒性分级为0~4级。
1.5 随访
采用门诊或电话随访,末次随访时间为2014年10月或患者死亡。采用SPSS 19.0软件进行统计学分析。计数资料采用χ2检验;PFS以Kaplan-Meier法计算,采用log-rank法检验。
2 结果
2.1 客观疗效
截至末次随访时有3例患者死亡,均死于肿瘤进展。PFS分别为96个月(至2014年10月仍生存)、13个月、9个月和3个月;OS分别为96个月、25个月、24个月和9个月(表1)。
BEV与化疗联合治疗4例晚期持续/复发性子宫肉瘤的总有效率为50%(2/4),临床获益率为75%(3/4)。4例患者的疗效评价为:1例为CR、1例为PR、1例为SD、1例为PD。平均PFS为30.25个月,平均OS为38.5个月。图1为1例经治疗后达CR的患者治疗前后CT扫描对比。
2.2 毒副反应
主要的毒性反应为血液学毒性,其中1例患者为4度血液学毒性(血小板减少,最低为13×109/L),其余3例为2度骨髓抑制(白细胞减少,最低为2.6×109/L);非血液学毒性主要是胃肠道反应(恶心、呕吐),其中2例患者为2度胃肠道反应,2例患者为1度胃肠道反应。
3 讨论
子宫肉瘤是来源于子宫间叶组织的一组非均质恶性肿瘤,其包括子宫平滑肌肉瘤、子宫内膜间质肉瘤、子宫腺肉瘤、子宫癌肉瘤等,目前将子宫癌肉瘤归类于子宫内膜癌。子宫肉瘤患者的预后差,5年生存率仅为30%[4],主要因为这类患者初次治疗后容易复发和转移,甚至部分患者发现时即为晚期(伴有远处转移),其5年生存率还不到15%[5]。而晚期持续/复发性子宫肉瘤的治疗效果差,尤其是经过化疗治疗失败后的患者,再接受二线以上单药或联合化疗(包括异环磷酰胺、柔红霉素、顺铂、拓扑替康、紫杉醇、多西他赛、吉西他滨和吉西他滨联合多西他赛)的有效率仅为5%~27%[6-8]。近年,国外多个肿瘤治疗中心仍在积极寻找治疗子宫肉瘤的新方法、新的化疗药物及分子靶向治疗药物,但结果均不理想。Bernstein-Molho等[9]报道用曲贝替定二线/三线治疗转移性子宫平滑肌肉瘤的总有效率为0,SD为60%。Aghajanian等[10]报道伊尼帕尼联合紫杉醇+卡铂治疗17例晚期持续/复发性子宫癌肉瘤的总有效率为23.5%(4/17),但有35.3%(6/17)的患者获得SD。Hensley等[11]等报道了美国妇科肿瘤学组(GOG)采用舒尼替尼单药治疗治疗持续/复发性子宫平滑肌肉瘤患者的Ⅱ期临床研究结果:PR为8.7%(2/23),且3级血液学毒性达17.4%,3~4级的非血液学毒性高达30%。因此,继续探索治疗子宫肉瘤的有效药物仍是目前妇科肿瘤医生的迫切需求。
阻断血管内皮生长因子(the vascular endothelial growth factor,VEGF)通路是近年治疗恶性肿瘤的新方法。BEV是一种人源化的重组抗VEGF的单克隆抗体,且已有大量的研究证实BEV对结直肠癌、肺癌、乳腺癌和卵巢癌等多种实体瘤有效,但BEV治疗子宫肉瘤或其他软组织肉瘤的报道非常少,有研究[12]显示VEGF在子宫癌肉瘤的上皮和间质中高表达,GOG目前正在进行一项Ⅲ期临床随机研究[12]:观察吉西他滨联合多西他赛加或不加BEV治疗晚期持续/复发性子宫平滑肌肉瘤患者的疗效。本研究中4例接受BEV联合化疗的子宫肉瘤患者,2例为晚期(Ⅳ期)持续性子宫肉瘤患者(1例BEV一线治疗,1例BEV二线治疗),另外2例为治疗后复发的子宫肉瘤患者(1例BEV二线治疗,1例BEV三线治疗),其治疗的总有效率为50%(2/4),明显高于文献报道的其他化疗药物的有效率(5%~27%)[6-8];治疗的临床获益率为75%(3/4),包括CR、PR、SD各1例,与Olawalye等[13]报道的结果一致:1例复发性子宫上皮样血管肉瘤患者经BEV与化疗联合治疗6个周期后获得CR,截至报告时已无瘤生存12个月。本研究的4例患者中,疗效达CR和PR的2例患者均接受了6个周期以上的BEV和DTIC+VP-16+DDP联合化疗,分别获得长达96个月和13个月的PFS及96个月(目前仍健在)和25个月的OS;即使1例经BEV联合化疗4个周期后临床疗效总体评价为SD的患者,其盆腔复发肿瘤经治疗后完全消失,而双侧肺内的多发转移瘤评价为SD,也获得了9个月的PFS,后因患者改变治疗方案致肿瘤进展而死于并发症(肾衰竭)。本研究中的4例患者的平均PFS为30.25个月,平均OS达38.5个月,远远长于文献报道的晚期持续/复发性子宫肉瘤化疗后获得平均OS的4.9个月,以及的平均PFS的1.8个月[6]。说明BEV联合化疗治疗晚期持续/复发性子宫肉瘤有一定的价值,有可能成为晚期持续/复发性子宫肉瘤患者有效的二线/三线治疗方案。若给予BEV适当的药物剂量和给药间隔,并且联合适宜的化疗方案治疗持续/复发性子宫肉瘤,疗效可达到CR,患者甚至可获得长达96个月的PFS。经BEV联合化疗后肿瘤进展,可能与患者的子宫肉瘤发生在宫颈癌根治性放射治疗后,因子宫及其周围组织纤维化,导致肿瘤血管的分布或形成与仅进行化疗的患者不同,以及患者的肉瘤成分复杂(包括横纹肌肉瘤、软骨肉瘤和子宫内膜间质肉瘤)有关,从而导致BEV联合化疗无效。此外,本研究中的4例患者经过平均8.3次的BEV治疗后,仅有1例患者出现4度血小板减少(血小板 13×109/L),而其余3例患者均未发生3级以上的化疗毒副反应,可能与该患者的年龄较高(63岁)且经过多达13个周期(三线)的化疗有关。但无1例患者发生文献报道的与BEV治疗相关的胃肠穿孔、出血或血管栓塞、高血压及重度蛋白尿等严重不良反应[14]。因此,BEV联合化疗治疗晚期持续/复发性子宫肉瘤安全、有效。
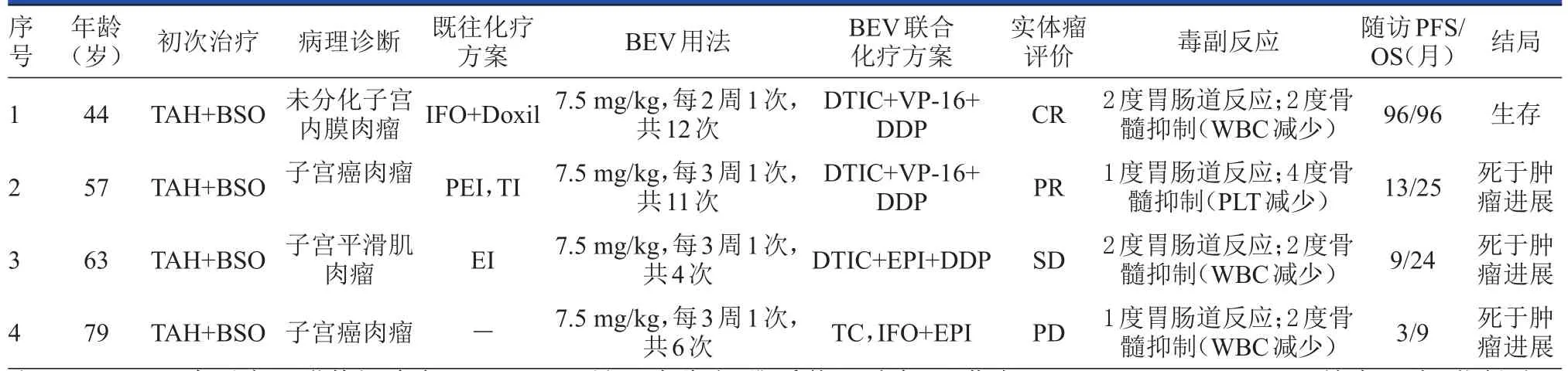
表1 .4例接受BEV BEV联合化疗治疗晚期持续//复发性子宫肉瘤患者资料
总之,BEV联合化疗治疗晚期持续/复发性子宫肉瘤有一定的疗效,且毒副反应小,部分患者可达到CR,甚至可以长期无瘤生存。因此,BEV联合化疗可能是治疗晚期持续/复发性子宫肉瘤的安全、有效的候选方案,可为今后开展大样本的临床研究提供理论依据。
[1]Nordal RR,Thoresen S.Uterine sarcomas in norway 1956-1992:incidence,survival and mortality[J].Eur J Cancer,19.3(6):907-911.
[2]Olah KS,Gee H,Blunt S,et al.Retrospective analysis of 318 cases of uterine sarcoma[J].Eur J Caner,2001,27(9):1095-1099.
[3]孙建衡.妇科肿瘤学[M].第2版.北京:北京大学出版社,2011.
[4]TropéCG,Abeler VM,Kristensen GB.Diagnosis and treatment of sarcoma of the uterus.A review[J].Acta Oncol,2012,51(6):694-705.
[5]Powell MA,Filiac VL,Rose PG,et al.PhaseⅡ Evaluation of paclitaxel and carboplatin in the treatment of carcinosarcoma of the uterus;a gynecologic oncology group study[J].JClin Oncol,2010,28(16):2727-2731.
[6]Miller BE,Blessing JA,Stehman FB,et al.A phaseⅡevaluation of weekly gemcitabine and docetaxel for second-line treatmentof recurrent carcinosarcoma of the uterus:a gynecologic oncology group study[J].Gynecol Oncol,2010,118(2):139-144.
[7]Yoo HJ,Lim MC,Lim S,et al.PhaseⅡ study of paclitaxel in combination with carboplatin for patients with recurrent or persistent uterine sarcoma[J].Arch Gynecol Obstet,2012,286(6):1529-1535.
[8]Gupta AA,Yao X,Verma S,et al.Chemotherapy(gemcitabine,docetaxel plus gemcitabine,doxorubicin,or trabectedin)in inoperable,locally advanced,recurrent,or metastatic uterine leiomyosarcoma:a clinical practice guideline[J].Curr Oncol,2013,20(5):e448-454.
[9]Bernstein-Molho R,Grisaro T,Soyfer V,et al.Metastatic uterine leiomyosarcomas:a single-institution experience[J].Int JGynecol Cancer,2010,20(2):255-260.
[10]Aghajanian C,Sill MW,Secord AA,et al.Iniparib plus paclitaxel and carboplatin as initial treatment of advanced or recurrent uterine carcinosarcoma:a gynecologic oncology group study[J].Gynecol Oncol,2012,126(3):424-427.
[11]Hensley ML,Sill MW,Scribner DR,et al.Sunitinib Malate in the treatment of recurrent or persistent uterine leiomyosarcoma;a gynecologic oncology group phaseⅡstudy[J].Gynecol Oncol,2009,115(3):460-465.
[12]Gupta AA,Yao X,Verma S,et al.Chemotherapy(gemcitabine,docetaxel plus gemcitabine,doxorubicin,or Trabectedin)for inoperable,locally advanced,recurrent,or metastatic uterine leiomyo-sarcoma:a clinical practice guideline[J].Curr Oncol,2013,20(5):e448-454.
[13]Olawaiye AB,Morgan JA,Goodman AK,et al.Epithelioid angiosarcoma of the uterus:a review of management[J].Arch Gynecol Obstet,2008,278(5):401-404.
[14]Homesley,Filiaci V,Markman M,et al.PhaseⅢ trial of ifosfamide with or without paclitaxel in advanceed uterine carcinosacroma:a gynecologic oncology group study[J].JCO,2007,25(5):526-531.
[15]Akihiko S,Junichi K,Yasunari M,et al.Amplication of the mdm-2 gene and p53 abnormalities in the sarcoma[J].Int JCancer,2007,73(1):33-37.
[16]Paweu MA,Filiaci VL,Rose PG,et a1.PhaseⅡevaluation of paditaxel and carboplatin in the treatment of carcinosarcoma of the uterus:a gynecologic oncology group study[J].J Clin Oncol,2010,28(16):2727-2731.
[17]Sanfilippo R,Grosso F,Jones RL,et a1.Trabectedin in advanced uterine leiomyosarcomas:a retrospective case series analysis from two reference centers[J].J Clin Oncol,2011,123(3):553-556.
[18]RGeva R,Vecchione L,Tejpar S,et al.Bevacizumab plus chemotherapy as salvage treatment in chemorefractory patients with metastatic colorectal cancer[J].Onco Targets Ther,2013,6:53-58.
[19]Sugimoto H,HamanoY,Charytan D,et al.Neutralition of culation vascularendothelial growth factor(VEGF)by anti-VEGF antibodyies and soluble VEGF receptorl(sF1t-1)induces proteinuria[J].Biol Chem,2003,278(15):1260-1268.
[20]Hensley ML,Sill MW,Scribner DR Jr,et a1.Sunitinib malate in the treatment of recurrent or persistent uterine leiomyosarcoma:a Gynecologic Oncology Group phaseⅡstudy[J].Gynecol Oncol,2009,115(3):460-465.
[21]Parker WH,Fu YS,Berek JS.Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyma[J].Obstet Gynecol,1994,83(3):414-418.
[22]Moskovic V,Macsweeney E,Law M,et al.Survival patterns of spread and prognostic factors in uterine sarcoma:a study of 76 patients[J].Br J Radiol,2003,66(791):1009-1015.
[23]Francis JM,John AB,Steven GS,et al.Prognostic factors in early-stage uterine sarcoma[J].Cancer,1993,71(4 Suppl):1702-1709.
[24]王丹,沈铿.贝伐珠单抗治疗卵巢上皮性癌的研究进展[J].中华妇产科杂志,2012,47(1):71-73.
——一对性格习性迥异的兄弟

