乳酸菌接种剂对红薯饮料渣青贮品质的影响
郑明利 王慧丽 郝 薇 宁婷婷 徐春城
(中国农业大学工学院,北京 100083)
伴随着我国工业化城镇化的快速推进,人口数量增长及城乡居民生活水平的提高,粮食需求呈刚性增长,受耕地减少、资源短缺等因素的制约,我国粮食的供求将长期处于紧平衡状态。饲料粮是粮食消费的重要组成部分,近年来,我国饲料粮占粮食消费的比重一直保持着较快速度增长。饲料粮变化对我国粮食供需平衡影响越来越大,为避免人畜争粮,将农业和工业副产品等生物资源转化为饲料,大力发展节粮型畜牧业是我国现代畜牧业发展的新趋势。
我国是最大的红薯(Ipomoea batatas)生产国,2009年红薯产量达到7.68×107t,占世界总产量的75%以上[1]。红薯有较高的营养价值,一般红薯块根中含有水分60%~80%、淀粉10%~30%、糖分5%及少量蛋白质、油脂、纤维素、半纤维素、果胶和灰分等;同时又具有很好的药用功效,红薯含有丰富的胡萝卜素和抗坏血酸等维生素和抗氧化物质,能够延缓衰老、抑制氧化类物质等[2]。近年来,红薯饮料作为一种新型的保健饮品备受消费者的青睐。红薯饮料渣是红薯饮料生产过程中产生的副产品,这些副产品中不仅含有淀粉、纤维素、矿物质、维生素及蛋白质等营养成分,而且水分含量高,如不及时处理极易受到微生物的污染而变质,从而造成资源的浪费和环境污染。目前,关于红薯饮料渣的开发与利用的研究较少。部分作为工业原料用于生产包装材料及提取伯醇[3-4],但以红薯饮料渣为原料进行工业生产面临着成本高、效率低、污染环境及难以实现工业化等问题。部分未经任何加工直接饲喂家畜,但由于红薯饮料渣的营养成分不平衡,直接饲喂饲料转化效率较低;而且由于水分含量高,各种细菌、真菌,特别是霉菌(例如黄曲霉、脱氧雪腐镰刀菌等)极易生长繁殖,并产生有毒代谢产物(例如黄曲霉毒素、呕吐毒素等),直接饲喂存在安全隐患。同时,由于红薯饮料渣季节性强,且没有建立安全贮藏体系,不能满足常年供应,也给红薯饮料渣的饲料化利用带来一定的困难。大部分红薯饮料渣被露天堆积或野外倾倒,造成环境污染及资源浪费。本试验旨在探究添加不同乳酸菌接种剂对红薯饮料渣青贮的发酵品质及营养成分的影响,为我国高效利用红薯饮料渣,发展节粮型畜牧业提供基础数据。
1 材料与方法
1.1 试验材料
1.1.1 红薯饮料渣
红薯饮料渣取自河北国投中鲁果蔬汁有限公司(河北省辛集市)。
1.1.2 乳酸菌接种剂
乳酸菌接种剂-Ⅰ:主要成分为植物乳杆菌(Lactobacillus plantarum KM005155),活菌数为1×108CFU/g。
乳酸菌接种剂-Ⅱ:主要成分为戊糖片球菌(Pediococcus pentosaceus KM005149),活菌数为5×108CFU/g。
乳酸菌接种剂-Ⅲ:主要成分为植物乳杆菌、戊糖片球菌及屎肠球菌(Enterococcus faecium KM005157),混合比例为 4∶4∶1,总活菌数为3×108CFU/g。
上述乳酸菌接种剂均为本实验室分离纯化的菌种通过复配而成。
1.2 试验设计
试验采用随机区组设计,共设4个组。对照(CK)组不添加乳酸菌接种剂;3个乳酸菌接种剂组分别按照原料鲜重的1.0 g/kg添加(乳酸菌数分别为1×105、5×105和 3×105CFU/g),依次编号为T1、T2、T3。每个组各调制3袋,各组于青贮后第60天分别开封,进行发酵品质和化学成分分析。
1.3 试验方法
1.3.1 青贮饲料的调制
取红薯饮料生产过程中产生的新鲜红薯饮料渣立即进行青贮调制。根据试验设计分别添加乳酸菌接种剂,对照组添加等量的灭菌去离子水。原料充分混匀后,装入200 mm×150 mm的青贮专用聚乙烯袋,每袋约200 g,并迅速用真空包装机抽真空、封口,室温(18~25℃)条件下避光贮藏。
1.3.2 测定项目和分析方法
青贮袋开封后,将青贮料取出并充分混匀。取10 g样品装入灭菌的聚乙烯袋,于超净工作台内加入90 mL灭菌去离子水,用无菌均质器处理1 min,再通过4层纱布及定性滤纸过滤,得到青贮饲料浸提液,用于 pH及氨态氮(NH3-N)、乳酸(LA)、乙酸(AA)、丙酸(PA)、丁酸(BA)等挥发性有机酸含量的测定。剩余青贮饲料样品于65℃鼓风干燥48 h后,粉碎过1 mm筛备用。pH用pH计(Mettler Toledo-S20,Greifensee,Switzerland)测定。挥发性有机酸含量通过高效液相色谱仪(Shimadzu-10A,Japan)测定。色谱条件为色谱柱(Shodex RSpak KC-811 S-DVB gel Column 300×8 mm,Japan),检测器(SPD-M10AVP,Japan),流动相:3 mmol/L的高氯酸溶液,流速:1 mL/min,进样量:5μL,柱温:50℃,检测波长:210 nm。原料的微生物组成按照Xu等[5]的方法测定。干物质(DM)、粗蛋白质(CP)含量按照AOAC[6]的方法,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量采用 Van Soest等[7]的方法,NH3-N和可溶性碳水化合物(WSC)含量采用Wang 等[8]的方法测定。
1.4 数据处理与分析
利用Excel软件统计整理初始试验数据,采用SPSS 11.5软件中的LSD及S-N-K程序进行方差分析。
2 结果
2.1 红薯饮料渣的原料特性
如表1所示,红薯饮料渣的DM含量较低,仅为16.6%;而WSC 含量较高,达到21.1%DM;淀粉含量为17.0%DM。乳酸菌和好氧性细菌数量分别为1.04×105和3.25×105CFU/g,未检测到酵母菌、霉菌和肠细菌。
2.2 红薯饮料渣青贮的微生物组成
如表2所示,添加乳酸菌接种剂能够促进乳酸发酵并抑制有害微生物的繁殖。与CK组相比,3个乳酸菌接种剂组中乳酸菌数量显著提高(P<0.05),酵母菌及好氧性细菌数量显著降低(P<0.05)。各组中均未检测到霉菌及肠细菌。
2.3 红薯饮料渣青贮的发酵品质
如表3所示,各组的发酵品质良好,表现在pH低于 3.8,氨态氮/总氮(NH3-N/TN)低于 0.1%,未检测到PA和BA。与CK组相比,添加乳酸菌接种剂进一步提高了红薯饮料渣青贮的发酵品质,表现在显著降低了pH(P<0.05),显著提高了LA含量(P<0.05)。T1组青贮料的AA含量最低但与CK组差异不显著(P>0.05),NH3-N/TN 显著高于CK组(P<0.05)。T2组青贮料中AA含量及NH3-N/TN与CK组差异不显著(P>0.05)。T3组青贮料的 pH最低,LA及 AA含量最高,NH3-N/TN较CK 组无显著差异(P>0.05)。
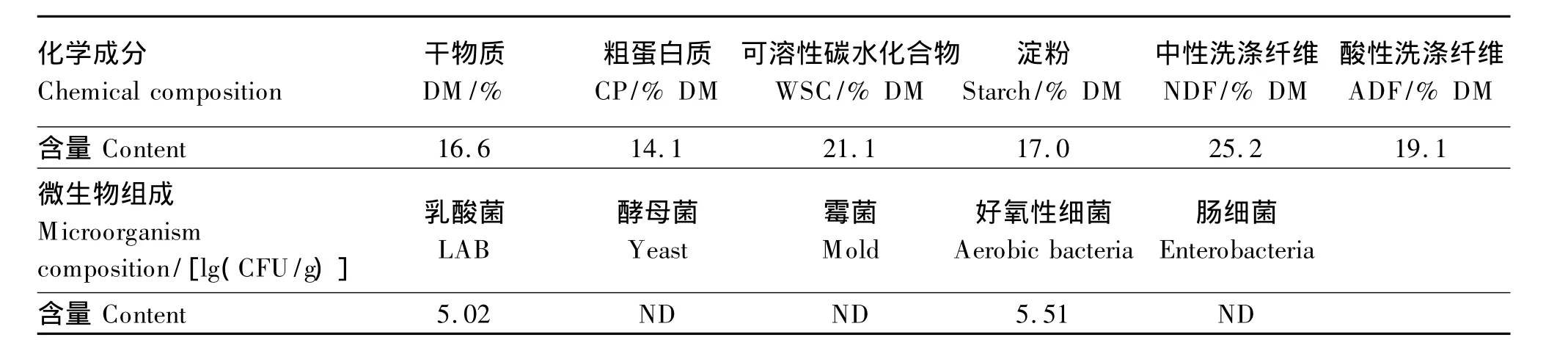
表1 红薯饮料渣的原料特性Table 1 Characterization of sweet potato beverage residue raw

表2 红薯饮料渣青贮的微生物组成Table 2 Microorganism composition of sweet potato beverage residue silage lg(CFU/g)

表3 红薯饮料渣青贮的发酵品质Table 3 Fermentation quality of sweet potato beverage residue silage
2.4 红薯饮料渣青贮的化学成分
如表4所示,经过发酵后的红薯饮料渣的CP含量为14.82% ~15.75%DM,高于原料中14.1%DM;WSC 含量为14.88% ~20.73%DM,低于原料中21.1%DM;NDF和ADF含量与原料相比略有增加的倾向。与CK组相比,添加乳酸菌接种剂降低了红薯饮料渣青贮的DM及WSC含量,提高了CP含量。T1组各化学成分含量与CK组无显著差异(P>0.05)。T2组DM 含量显著低于CK组(P<0.05),其他化学成分与 CK组差异不显著(P>0.05)。T3组的 DM及 WSC含量最低,CP含量最高,且均与CK组差异显著(P<0.05)。

表4 红薯饮料渣青贮的化学成分Table 4 Chemical composition of sweet potato beverage residue silage
3 讨论
3.1 红薯饮料渣的原料特性
红薯饮料渣是生产红薯饮料过程中的副产品,水分含量高达85%左右,干物中富含WSC、淀粉、蛋白质和纤维成分,是反刍动物良好的能量饲料来源。本试验的红薯饮料渣中,CP含量明显高于马铃薯淀粉渣的9.1%DM,与玉米淀粉渣基本持平;淀粉含量低于马铃薯淀粉渣的38.3%DM,而高于玉米淀粉渣;NDF含量与马铃薯淀粉渣基本相同,明显低于玉米淀粉渣的52.1%DM[9]。由于水分含量高,富含碳水化合物和蛋白质等营养物质,因此红薯饮料渣极易变质,必须在短时间内进行青贮或干燥等加工处理。
乳酸菌作为乳酸发酵的启动菌,在青贮过程中起到主导作用。一般情况下,当原料表面附着乳酸菌数量达到或超过105CFU/g时,才能确保青贮的顺利进行[10-11]。制作青贮饲料时,要使乳酸菌能够快速生长繁殖,青贮原料应具有适宜的DM含量、一定的WSC含量及较低的缓冲能[10-11]。本试验中的红薯饮料渣虽然乳酸菌含量达到1.04×105CFU/g,但好氧性细菌高达3.25×105CFU/g,而且由于水分含量高,不是比较理想的青贮原料。Purwin等[12]报道,DM含量较低是导致青贮饲料质量下降的一个重要原因,这种情况会增加梭菌(Clostridia)生长繁殖的机率,引起丁酸发酵,进而降低动物对饲料的采食量。因此,为了调制优质的红薯饮料渣青贮,本试验采取添加乳酸菌接种剂来促进乳酸发酵,提高青贮发酵品质。
3.2 乳酸菌接种剂对红薯饮料渣青贮发酵品质的影响
添加乳酸菌接种剂进一步改善了红薯饮料渣青贮的发酵品质,与CK组相比,试验组pH显著降低,LA 含量显著增加,这与以前的报道相同[5,8,13]。添加乳酸菌接种剂可以增加青贮早期原料中的乳酸菌数量,并有效利用原料中的WSC,在短时间内成为优势菌群主导发酵过程产生大量LA,快速降低pH,有效抑制有害微生物的活动,从而阻止BA的产生和蛋白质的降解。
乳酸菌接种剂组中,随乳酸菌多样性增加LA含量显著提高。一方面是由于乳酸球菌的作用。Cai等[14]认为,产酸的乳酸球菌像肠球菌(Enterococcus)、片球菌(Pediococci)、乳球菌(Lactococcus)、明串珠菌(Leuconostoc)等在青贮时往往作为发酵启动菌株,在青贮初期快速繁殖产生大量LA,迅速降低pH。在青贮的发酵期及稳定期,耐酸的乳酸杆菌才逐渐占据优势,成为最后发酵的主要菌群。另一方面是由于乳酸菌种类增加导致乳酸菌间的协同作用及乳酸菌对于其他微生物的抑制或拮抗作用增强。
添加植物乳杆菌接种剂的T1组与添加戊糖片球菌接种剂的T2组,其青贮中的AA含量与CK组无显著差异,与之前的研究相符。Tabacco等[15]及Rota等[16]的研究表明,添加植物乳杆菌或植物乳杆菌与戊糖片球菌的混合接种剂的全株玉米青贮中AA含量与对照组无显著差异。T3组的AA含量显著高于CK组,这可能是由于该组中添加了屎肠球菌,而屎肠球菌在代谢过程中可以产生大量的AA所致[17]。
发酵品质较好的青贮中NH3-N/TN一般小于10%[10-11]。本试验中 NH3-N/TN 不足 0.1%,达到了优质青贮的要求。但值得注意的是乳酸菌接种剂组中 NH3-N/TN均高于 CK组。Tabacco等[15]报道,添加植物乳杆菌后,高粱青贮的NH3-N/TN高于对照组但差异不显著;Sadeghi等[18]的研究也发现,接种植物乳杆菌、戊糖片球菌、费氏丙酸杆菌(Propionibacter freudenreichii)的高水分全株玉米青贮中NH3-N/TN显著高于对照组。这可能是由于添加乳酸菌接种剂后,青贮体系原有的微生态平衡被打破,某些耐酸的梭菌或肠细菌等有害微生物活动相对增强,促进蛋白质的降解[19]。
3.3 乳酸菌接种剂对红薯饮料渣青贮营养成分的影响
WSC作为乳酸菌等微生物的发酵底物,在青贮过程被不断消耗,这是导致3个乳酸菌接种剂组的DM及WSC含量均低于CK组的原因。T3组中乳酸菌活性最强,消耗的DM及WSC最多。3个乳酸菌接种剂组的CP、NDF及ADF含量略高于CK组,且与原料相比有增加的趋势,这可能是由于WSC等供乳酸菌发酵的基质损失,导致其他组分在干样中的相对含量升高。
4 结论
添加乳酸菌接种剂明显改善了红薯饮料渣的青贮品质。综合考虑,青贮品质优劣次序为:T3>T2>T1>CK。说明乳酸球菌与乳酸杆菌混合使用比单独使用乳酸杆菌或乳酸球菌对于改善青贮品质的效果更好。
[1] FAO.Selected indicators of food and agricultural development in the Asia-Pacific region 2000-2010[EB/OL].2011,http://www.fao.org/docrep/014/i2371e/i2371e00.htm.
[2] 刘惠知,王升平,周映华,等.红薯渣及其利用[J].饲料博览,2013(7):41-43.
[3] JIANG D.Sweet potato juice producing process and packing material of sweet potato residue fiber:China,CN1672562-A;CN1316918-C[P].2005-4-12.
[4] KIM Y N,PARK K M,CHOI S J,et al.Optimizing conditions for TEMPO/NaOCl-mediated chemoselective oxidation of primary alcohols in sweet potato residue[J].Food and Bioprocess Technology,2013,6(3):690-698.
[5] XU C C,CAI Y M,ZHANG J G,et al.Ensiling and subsequent ruminal degradation characteristics of barley tea grounds treated with contrasting additives[J].Animal Feed Science and Technology,2008,141(3/4):368-374.
[6] AOAC.Official Methods of Analysis[M].16th ed.Virginia,USA:Association of Official Analytical Chemists,1995.
[7] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and non-starch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[8] WANG R R,WANG H L,LIU X,et al.Effect of different additives on fermentation characteristics and protein degradation of gereen tea grounds silage[J].Asian-Australasian Journal of Animal Sciences,2011,24(5):616-622.
[9] 雷恒,王慧丽,郝薇,等.利用物理化学参数评价糟渣类副产品的饲料特性[J].饲料工业,2014,35(7):20-25.
[10] MCDONALD P,EDWARDSR A,GREENHALGH JF D,et al.Animal nutrition[M].6th ed.London:Prentice Hall,2002.
[11] 徐春城,杨富裕,张建国,等.现代青贮理论与技术[M].北京:科学出版社,2013:68-73.
[12] PURWIN C, ŁANIEWSKA-TROKENHEIM Ł,WARMIN’SKA-RADYKO I,et al.Silage quality:microbiological,health-promoting and production aspects[J].Medycyna Weterynaryjna,2006,62(8):865-869.
[13] 王蓉蓉,赵海燕,徐春城.杏饮料残渣青贮饲料的发酵品质研究[J].饲料工业,2010,31(13):31-34.
[14] CAI Y M,KUMAI S,ZHANG J G,et al.Comparative studies of lactobacilli and enterococci associated with forage crops as silage inoculants[J].Animal Science Journal,1999,70(4):188-194.
[15] TABACCO E,PIANO S,CAVALLARIN L,et al.Clostridia spore formation during aerobic deterioration of maize and sorghum silages as influenced by Lactobacillus buchneri and Lactobacillus plantarum inoculants[J].Journal of Applied Microbiology,2009,107(5):1632-1641.
[16] ROTA C,PIRONDINI M,MALAGUTTI L,et al.Evaluation of fermentative parameters,aerobic stability and in vitro gas production of whole crop maize silage treated with a microbial inoculant containing Pediococcus pentosaceus and Lactobacillus plantarum[C]//Proceedings of the XVI International Silage Conference.Helsinki,Finland:MTT Agrifood Research Finland,2012.
[17] JIN L Z,MARQUARDT R R,ZHAO X.A strain of Enterococcus faecium(18C23)inhibits adhesion of enterotoxigenic Escherichia coli K88 to porcine small intestine mucus[J].Applied and Environmental Microbiology,2000,66(10):4200-4204.
[18] SADEGHI K,KHORVASH M,GHORBANI G R,et al.Effects of homo-fermentative bacterial inoculants on fermentation characteristics and nutritive value of low dry matter corn silage[J].Iranian Journal of Veterinary Research,2012,13(4):303-309,350.
[19] ROSSI F,DELLAGLIO F.Quality of silages from Italian farms as attested by number and identity of microbial indicators[J].Journal of Applied Microbiology,2007,103(5):1707-1715.

