代乳品能量和蛋白质水平对肉犊牛生产性能和瘤胃发酵的影响
郭 峰 屠 焰 邹彩霞 郭 群 苗 忠 刁其玉*
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京 100081;2.新疆农业大学动物科学学院,乌鲁木齐 830052;3.中国农业科学院广西水牛研究所,南宁 530001;4.山东省曹县畜牧局,曹县 274400)
我国南方地区肉牛养殖业起步晚、基础较差,但有着丰富的草地和农副产品资源,并且有广大的消费市场,所以我国南方肉牛的发展存在巨大的发展潜能[1]。犊牛的培育是成年的基础,直接关系到产业的发展,世界各国的牛场给犊牛饲喂牛奶或者代乳品并且配合补饲开食料的培育方法非常盛行,此方法不仅能够促进犊牛瘤胃发育[2],而且能够缩短断奶日龄,最终降低犊牛培育的成本[3],同时还能使产后母牛及早恢复体况,提高母牛繁殖率,增加经济效益。犊牛的培育离不开饲粮中能量和蛋白质水平的合理设计,蛋白质是犊牛饲粮中重要的营养素,蛋白质不足不利于犊牛生长发育,过量不仅会造成环境污染而且造成不必要的经济损失,因此适宜的蛋白质水平在生产实践中起到重要指导作用[4]。能量是肉犊牛维持生长、繁殖必须的营养,其主要来源于饲料碳水化合物、脂肪和蛋白质[5]。有研究表明含22%粗蛋白质(CP)的代乳品有助于犊牛的生长代谢[6],总能为19.66 MJ/kg的代乳品可提高氮的利用率[7],随着饲粮能量水平提高,氮的沉积率也在提高[8],但此类研究大多基于奶犊牛,肉犊牛研究报道极少。我国南方地区以养殖肉牛为主,为迅速发展肉牛产业,需要犊牛尽早断奶,及早育肥,母牛及早恢复体况。目前我国有关肉用犊牛代乳品蛋白质和能量需要量还未形成统一的饲养标准,先前的研究主要限于奶犊牛,现阶段对奶犊牛的研究也主要关注犊牛早期培育对后期乳腺的发育[9]以及对肉品质[10]的影响,对肉用犊牛的早期培育缺少报道。因此本试验使用不同能量和蛋白质水平的4种代乳品,研究了不同能量和蛋白质组合对南方地区肉犊牛生长性能及瘤胃发酵的影响,进而为南方肉用犊牛哺乳至断奶阶段饲养提供理论依据。
1 材料和方法
1.1 试验地点与动物
试验于2014年7—9月在广西省金泰丰肉牛扩繁场开展。选择40头新生健康的德国黄牛与夏南牛杂交犊牛,记录初生重和初生体尺,按日龄和体重相近原则随机分为4组,每组10头犊牛,各组犊牛平均初生重分别为 35.98、36.20、36.63、37.11 kg(SEM=0.706 8,P=0.601 1),21 日龄时各组犊牛平均体重分别为 42.66、43.34、43.46、42.46 kg(SEM=0.928 0,P=0.717 2)。
1.2 试验设计和饲养管理
试验采用双因素试验设计。4组犊牛分别饲喂高能量高蛋白质(HEHP组,消化能16 MJ/kg,粗蛋白质25%)、高能量低蛋白质(HELP组,消化能16 MJ/kg,粗蛋白质22%)、低能量高蛋白质(LEHP组,消化能14 MJ/kg,粗蛋白质25%)、低能量低蛋白质(LELP组,消化能14 MJ/kg,粗蛋白质22%)的代乳品,牛栏提供足够的水槽、食槽;犊牛达到21日龄时进入正式试验,断母乳并饲喂相应的代乳品,饲喂次数为每日3次,分别于07:00、14:00和17:00饲喂,饲喂量按犊牛体重1.2%的理论值和实际犊牛饮食情况进行调整;开食料也于21日龄开始补饲,犊牛饮食代乳品后于料槽中添加犊牛开食料,任其自由采食;犊牛达到35日龄开始补饲粗饲料,粗饲料为粉碎的青绿象草,每天保持食槽中粗饲料不断;90日龄断代乳品,试验结束。犊牛圈舍每天进行2次清理粪便,每7 d进行1次冲洗牛栏和栏位消毒。
1.3 试验饲粮
代乳品由中国农业科学院饲料研究所研制,选择2个能量水平和2个蛋白质水平,采用2×2试验设计4组代乳品,代乳品A:HEHP组,代乳品B:HELP组,代乳品C:LEHP组,代乳品D:LELP组,饲喂方法:将加热沸腾的水冷却到50℃左右,按1∶7的比例把代乳品稀释、溶解、混匀,待温度降至38~39℃时饲喂犊牛。开食料由广西南宁都旺畜牧科技有限公司提供;粗饲料为当地种植的象草。饲粮组成及营养水平见表1。
1.4 测定样品及方法
1.4.1 饲料样品
代乳品、开食料和粗饲料每2周采集1次,混合后冷冻保存,并回实验室后于烘箱中48 h制备风干样,粉碎后以《饲料分析及饲料质量检测技术》的方法测定饲粮干物质(DM)、粗蛋白质、粗脂肪(EE)、粗灰分(ash)、钙(Ca)、磷(P)含量。增重净能计算参考文献[11]。
增重净能=消化能×Kf。
式中:Kf为消化能转化为增重净能的效率,Kf=0.523×(消化能/总能)×0.005 89;消化能=总能×能量消化率,能量消化率=94.280 8-61.537 0×有机物中中性洗涤纤维。
1.4.2 犊牛生长性能
分别于犊牛 1、21、35、49、77、90 日龄称量犊牛体重和测量犊牛体尺,每日记录每头犊牛采食量。
1.4.3 犊牛瘤胃液采集与分析
犊牛到达77~85日龄阶段后从口腔采集瘤胃液,用4层高压灭菌后的纱布过滤后,立即测定瘤胃液pH,然后将滤液分装于2个15 mL高压灭菌后的离心管中,-20℃冷冻保存,测定时解冻5 000 r/min离心后,一份用分光光度计测定氨态氮(NH3-N)浓度,另一份用仪器测定挥发性脂肪酸(VFA)的浓度。
1.5 数据处理
本试验采用2×2试验设计,数据用SAS 9.2的GLM模型进行分析,差异显著则用LSD法进行多重比较,统计结果以P<0.05表示差异显著。

表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air-dry basis) %
2 结果
2.1 日增重
由表2可见,不同能量和蛋白质水平对犊牛整个正式试验期(21~90日龄)日增重影响显著(P<0.05),LELP 组显著低于其他各组(P<0.05);77~90日龄阶段LEHP组日增重显著高于LELP组(P<0.05);低蛋白质水平随能量升高犊牛日增重有增长趋势,LELP组后期生长较慢呈现出缓慢生长的趋势。
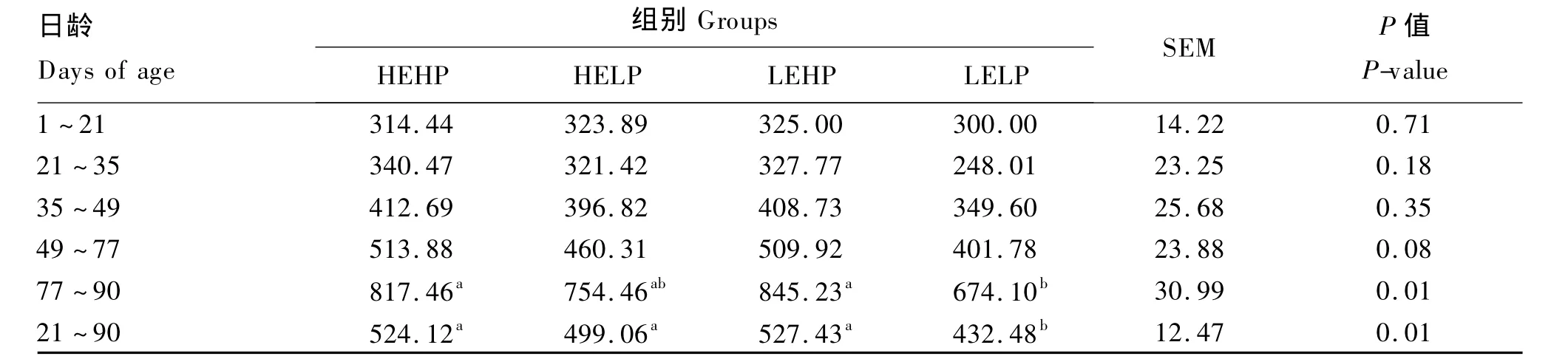
表2 代乳品能量和蛋白质水平对犊牛日增重的影响Table 2 Effects of energy and protein levels of milk replacer on daily gain of calves g
2.2 体尺
由表3可见,饲喂不同能量和蛋白质水平的代乳品后,各组间犊牛体高、体斜长、腹围、腰角宽在不同日龄间差异均不显著(P>0.05);但胸围在77和90日龄出现差异,HEHP组显著高于LELP组(P<0.05)。

表3 代乳品能量和蛋白质水平对犊牛体尺的影响Table 3 Effects of energy and protein levels of milk replacer on body measurements of calves cm
2.3 采食量
由表4可见,高能量水平下,随着蛋白质水平的升高,犊牛代乳品、开食料、粗饲料采食量都未出现显著差异(P>0.05);低能量水平下,随着蛋白质水平的升高,代乳品(35~49日龄、49~77日龄、77~90日龄)、开食料(49~77日龄、77~90日龄)、粗饲料采食量(49~77日龄、77~90日龄)都呈现显著增加的趋势(P<0.05),随日龄的增长LELP组各采食量低于其他各组的差距逐渐加大。
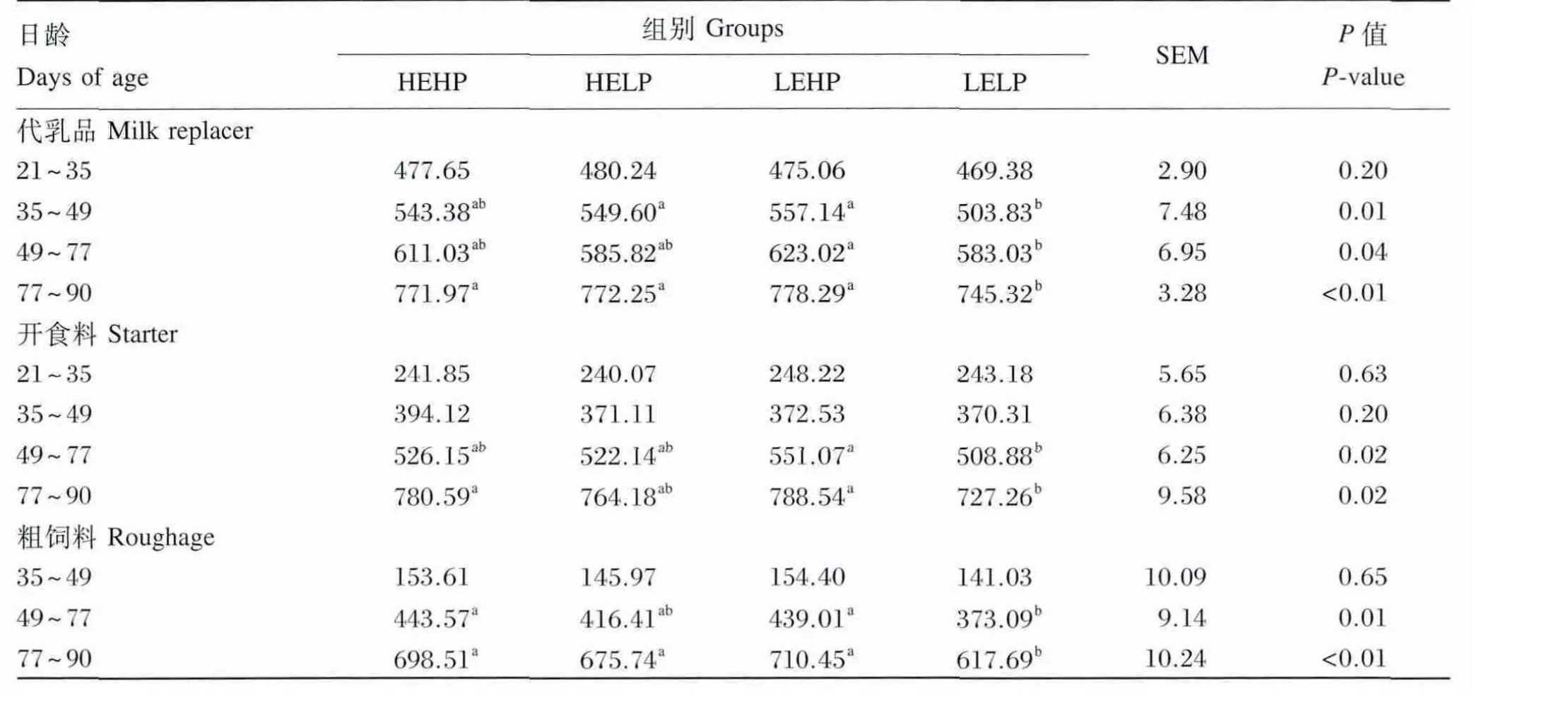
表4 代乳品能量和蛋白质水平对犊牛哺乳期采食量的影响Table 4 Effects of energy and protein levels of milk replacer on feed intake of calves in milking period g
2.4 瘤胃发酵
由表5可见,各组瘤胃液 pH在6.62~6.75之间,没出现显著性差异(P>0.05);瘤胃液氨态氮浓度LEHP组显著高于LELP组和HELP组(P<0.05),相同蛋白质水平的2组差异不显著(P>0.05);高蛋白质水平的2组较高;饲喂不同能量和蛋白质水平的代乳品对犊牛瘤胃液乙酸、丙酸、丁酸、戊酸含量和乙酸/丙酸均无显著性差异(P>0.05),但LELP组丙酸含量较低,HELP组异丁酸含量显著高于 LELP组(P<0.05),LELP组异戊酸含量显著小于其他各组(P<0.05)。
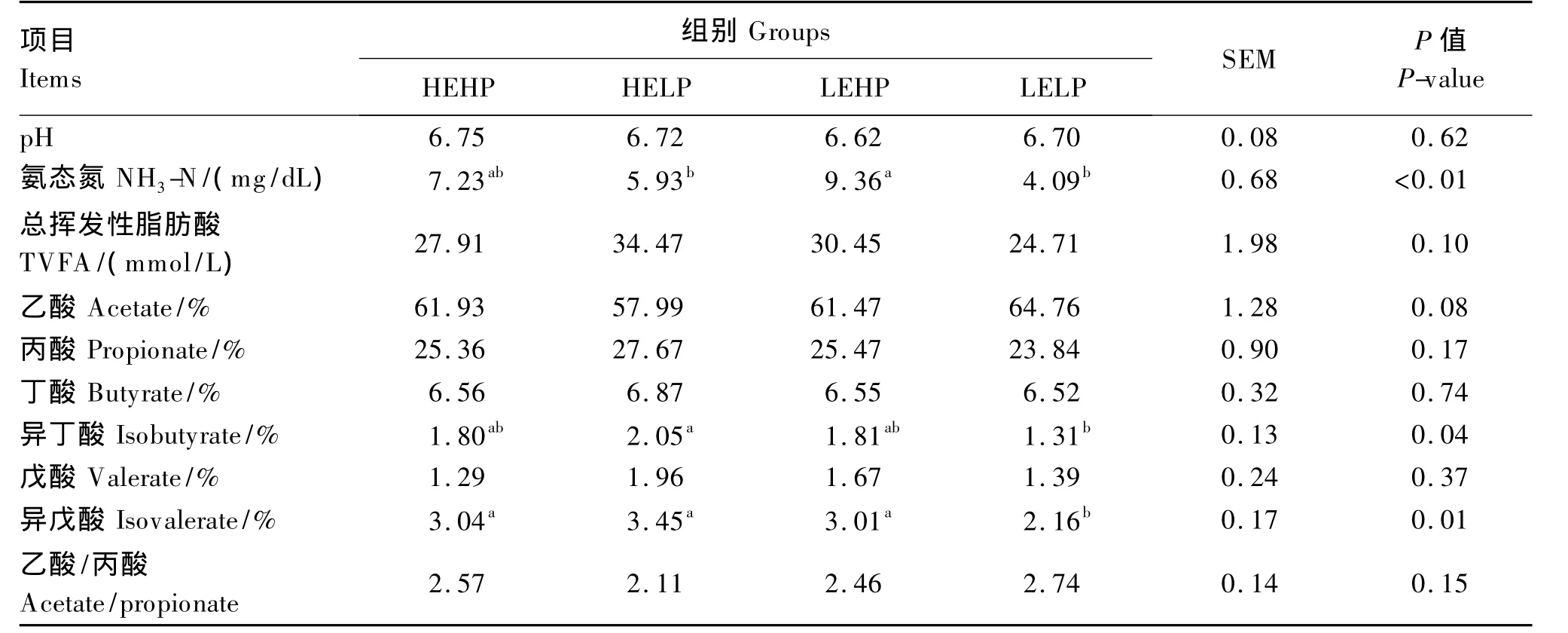
表5 代乳品能量和蛋白质水平对犊牛瘤胃发酵的影响Table 5 Effects of energy and protein levels of milk replacer on rumen fermentation of calves
3 讨论
3.1 代乳品能量和蛋白质水平对犊牛体重、体尺的影响
目前对反刍动物饲粮的配制主要立足于能量和蛋白质水平,其水平的高低对犊牛生长发育的影响很大,特别是幼畜,低营养水平会直接反映到犊牛的生长性能[12],但两者之间并不是相互孤立的,也不意味着二者的水平越高,动物的生产性能和健康状况越好[13]。犊牛从代乳品中吸取的蛋白质和能量很大程度上影响犊牛日增重和肉质中蛋白质和脂肪的沉积[14],而能量和蛋白质水平的不平衡会导致瘤胃微生物所提供的能量和氮水平不平衡,从而影响瘤胃微生物生长,进一步影响进入小肠的蛋白质的流量,最终影响动物生产性能的发挥[15],基于这些研究大多针对奶犊牛,但肉犊牛研究报道甚少。本试验正式试验期犊牛日增重因处理不同出现显著差异,LELP组犊牛日增重低于其他组犊牛,并且在犊牛21~35日龄断母乳过渡为代乳品阶段产生断奶应激对该组日增重影响更为明显,可能原因是低能量低蛋白质的营养水平不能满足生长发育的需要,并且受断奶应激能力较弱,造成犊牛出现消化和吸收障碍,77~90日龄阶段其日增重也显著小于HEHP组和LEHP组,说明低能量水平下,蛋白质水平较高的代乳品有利于犊牛体重的增加。体尺是动物不同组织和器官生长发育统一协调的结果,在本试验条件下LELP组在犊牛77、90日龄胸围显著小于HEHP组,可能是该营养水平下犊牛能量和蛋白质失衡,致使犊牛胃肠道对营养物质的消化吸收出现障碍,影响犊牛采食开食料和粗饲料的量,进而影响犊牛瘤胃中微生物的生长和发育,从而影响瘤胃发育和瘤胃微生物发酵。
3.2 代乳品能量和蛋白质水平对犊牛瘤胃发酵的影响
瘤胃液pH是评价发酵状态最直观的指标之一,正常的pH范围为6.0~6.8,过低和过高都不利于微生物的生长与繁殖,最为理想的pH接近6.5,而瘤胃微生物生长速度最大的pH在6.0以上[16],本试验pH范围在6.62~6.75之间,在正常pH 范围内,而且较接近理想的pH,各组间未出现显著差异,可能原因是犊牛在21日龄补饲开食料、35日龄起开始补饲粗饲料,增加了犊牛咀嚼时间,分泌的唾液(含有碳酸氢钠和磷酸盐)流入瘤胃中对酸起到缓冲作用,进而使各组pH趋于稳定。
饲料中的蛋白质和非蛋白氮在瘤胃中分解为氨态氮,同时作为瘤胃微生物合成蛋白质的主要氮源。瘤胃中氨态氮浓度过高会造成氮素损失,严重可引起氨中毒,过低会限制微生物合成蛋白质的效率。Preston等[17]报道6~30 mg/dL是微生物生长对氨态氮浓度耐受的临界范围。Clark等[18]指出瘤胃液中的氨态氮浓度在2 mg/dL时,即可满足瘤胃微生物合成蛋白质的需要。本试验中氨态氮浓度范围在4.09~9.36 mg/dL 之间,相同能量水平,高蛋白质组氨态氮浓度较高,相同蛋白质水平,能量高低对氨态氮浓度影响较小,可能是液体饲料通过食管沟直接进入真胃,供动物消化利用,高蛋白质代乳品已满足犊牛对氮的需要,而吸收瘤胃氨态氮的量较少,导致所测瘤胃液氨态氮较高,低蛋白质代乳品恰恰相反,因无法满足犊牛需要而从瘤胃吸收大量氨态氮,导致瘤胃液氨态氮浓度较低,同蛋白质水平氨态氮浓度无显著变化,可能该蛋白质水平已与低消化能水平达到一个动态平衡。
反刍动物瘤胃微生物对饲料中的碳水化合物发酵代谢产生VFA,为动物提供的主要能量来源。乙酸、丙酸、丁酸大约占瘤胃发酵总挥发性脂肪酸(TVFA)的95%,因此很多研究都基于研究这3种VFA浓度或者含量来反映牛瘤胃发酵,有研究发现给试牛饲喂低能量饲粮时,乙酸的含量高[19],瘤胃液乙酸含量随饲粮能量水平的升高而降低[20],也有研究并没有发现乙酸显著下降[21]。李凌岩等[22]研究发现随着能量水平提高,牛瘤胃液乙酸含量下降,丙酸含量上升。张腾等[23]指出瘤胃中可消化的淀粉越多,瘤胃中微生物发酵产生的丙酸含量也会增加,而饲粮中粗饲料比例越高,瘤胃发酵所产生的乙酸含量越高,反刍动物体内所需主要葡萄糖来源于动物体内肝脏组织的糖原异生,丙酸为糖原异生的前体物质[24],丙酸也是唯一生糖 VFA[25],乙酸可参与三羧酸循环被分解为CO2和H2O同时释放出ATP来供应能量[24]。犊牛3月龄阶段是瘤胃发育较快的阶段,补饲开食料和粗饲料有助于瘤胃上皮乳头状结构的生长和瘤胃容积增加,而随之进入瘤胃的微生物可形成稳定的微生物区系,进而发酵利用饲料中的营养物质并产生VFA,促进瘤胃的发育。断奶前以液体饲料为主要营养来源,液体饲料的营养水平势必影响犊牛采食及健康状况,进而影响瘤胃的发育,本试验犊牛以代乳品为主要的能量和蛋白质供体,21日龄开始补饲开食料,35日龄补饲粗饲料,研究发现随着饲粮能量和蛋白质升高,各组间TVFA浓度,乙酸、丙酸、丁酸、戊酸含量均未出现显著差异,低能量水平下,蛋白质水平较低的代乳品瘤胃中异戊酸含量显著降低,丙酸呈现较低趋势,试验揭示了LELP组存在潜在的营养不足。一些研究发现,瘤胃液VFA被吸收进入血液后,丙酸主要用于动物体脂的合成,乙酸则主要用于合成乳脂,因此在肉牛生产中适当增加饲粮能量饲料比例,有利于肉牛体脂的沉积,本试验中能量较高组犊牛瘤胃液丙酸含量虽未表现出统计差异,但其数值有较高趋势,此现象也与犊牛日增重有相互呼应之处,并且HELP组犊牛瘤胃液TVFA浓度较高,可能是代乳品中能量含量高,相对蛋白质水平低,能量物质具有促进瘤胃发酵的特点。因此在实际生产中根据具体的生产目的,调控动物产品的组成是行之有效和非常必要的。
4 结论
高能量水平(消化能16 MJ/kg)代乳品有助于肉用犊牛生长性能发挥和瘤胃发酵,高蛋白质水平(粗蛋白质25%)代乳品能为犊牛提供充足蛋白质供其吸收利用,低能量低蛋白质水平(粗蛋白质22%,消化能14 MJ/kg)的代乳品不利于犊牛生长发育。
[1] 曹兵海,苏华维.我国南方肉牛产业现状与发展战略之我见[C]//第四届全国牛病防制及产业发展大会论文集.武汉:全国牛病大会组委会,2012:18.
[2] MILLER-CUSHON E K,MONTORO C,IPHARRAGUERRE I R,et al.Dietary preference in dairy calves for feed ingredients high in energy and protein[J].Journal of Dairy Science,2014,97(3):1634-1644.
[3] GÓRKA P,KOWALSKI Z M,PIETRZAK P,et al.Is rumen development in newborn calves affected by different liquid feeds and small intestine development?[J].Journal of Dairy Science,2011,94(6):3002-3013.
[4] 李辉,刁其玉,张乃锋.不同蛋白水平对犊牛生长、营养代谢及氨基酸消化率的影响[J].畜牧兽医学报,2008,39(11):1510-1516.
[5] 穆阿丽.肉牛生长期能量和蛋白质代谢规律及其需要量的研究[D].硕士学位论文.泰安:山东农业大学,2006.
[6] 李辉,刁其玉,张乃锋,等.不同蛋白水平对犊牛消化代谢及血清生化指标的影响[J].中国农业科学,2008,41(4):1219-1226.
[7] 张蓉,刁其玉,屠艳,等.能量水平对早期断奶犊牛消化代谢及血清指标的影响[J].中国农业科学,2009,42(3):1024-1029.
[8] 穆阿丽,杨在宾,吴乃科,等.不同能量水平下犊牛蛋白质需要量及其代谢规律的研究[J].中国牛业科学,2006,32(4):18-22.
[9] BROWN E G,VANDEHAAR M J,DANIELS K M,et al.Effect of increasing energy and protein intake on mammary development in heifer calves[J].Journal of Dairy Science,2005,88(2):595-603.
[10] BROWN E G,VANDEHAAR M J,DANIELS K M,et al.Effect of increasing energy and protein intake on body growth and carcass composition of heifer calves[J].Journal of Dairy Science,2005,88(2):585-594.
[11] 中华人民共和国农业部.NY/T 815-2004肉牛饲养标准[S].北京:中国农业出版社,2004.
[12] 王美美,李秋凤,高艳霞,等.饲喂不同营养水平代乳粉对犊牛生长性能的影响[J].中国奶牛,2013(15):17-20.
[13] 张卫兵,刁其玉,张乃锋,等.日粮蛋白能量比对中国荷斯坦犊牛生长性能及饲料利用率的影响[J].中国畜牧兽医,2009,36(6):5-10.
[14] HILL T M,BATEMAN H G,ALDRICH J M,et al.Effects of fat concentration of a high-protein milk replacer on calf performance[J].Journal of Dairy Science,2009,92(10):5147-5153.
[15] 卜登攀,卢德勋,崔慰贤,等.瘤胃能氮同步释放对瘤胃微生物蛋白质合成的影响[J].中国畜牧兽医,2008,35(12):5-10.
[16] VAN HOUTERT M F J.The production and metabolism of volatile fatty acids by ruminants fed roughages:a review[J].Animal Feed Science and Technology,1993,43(3/4):189-225.
[17] PRESTON T R,LENG R A.Matching ruminant production systems with available resources in the tropics and sub-tropics[M].Armidale,Australia:Penambul Books,1987.
[18] CLARK J H,KLUSMEYER T H,CAMERON M R.Microbial protein synthesis and flows of nitrogen fractions to the duodenum of dairy cows[J].Journal of Diary Science,1992,75(8):2304-2323.
[19] YANG W Z,BEAUCHEMIN K A,RODE L M.Effects of grain processing,forage to concentrate ratio,and forage particle size on rumen pH and digestion by dairy cows[J].Journal of Dairy Science,2001,84(10):2203-2216.
[20] NOCEK J E,TAMMINGA S.Site of digestion of starch in the gastrointestinal tract of dairy cows and its effect on milk yield and composition[J].Journal of Dairy Science,1991,74(10):3598-3629.
[21] KHORASANI G R,OKINE E K,KENNELLY J J.Effects of forage source and amount of concentrate on rumen and intestinal digestion of nutrients in late-lactation cows[J].Journal of dairy Science,2001,84(5):1156-1165.
[22] 李凌岩,何阳,汪先友,等.不同能量蛋白水平日粮对夏南牛瘤胃发酵、消化代谢及血液生理生化指标的影响[C]//2013中国反刍动物营养需要与饲料资源研讨会论文集.北京:中国畜牧兽医学会,2013:215-229.
[23] 张腾,庄苏,董文超,等.不同精粗比日粮对奶山羊瘤胃液pH值、VFA及血液VFA含量的影响[J].畜牧与兽医,2013,45(4):5-10.
[24] 翁秀秀.饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D].博士学位论文.兰州:甘肃农业大学,2013.
[25] REYNOLDS C K,AIKMAN P C,LUPOLI B,et al.Splanchnic metabolism of dairy cows during the transition from late gestation through early lactation[J].Journal of Dairy Science,2003,86(4):1201-1217.

