单唾液酸神经节苷脂鞘内注射治疗恢复期脊髓损伤的临床研究
赖福生 李惠俊 焦冬生 王燕燕 钱时德 赵 全 卢少军解放军第454医院神经科 南京 210002
单唾液酸神经节苷脂鞘内注射治疗恢复期脊髓损伤的临床研究
赖福生 李惠俊 焦冬生 王燕燕 钱时德 赵 全 卢少军
解放军第454医院神经科 南京 210002
目的 观察单唾液酸神经节苷脂(GM1)鞘内注射治疗恢复期脊髓损伤的临床疗效。方法 46例脊髓损伤恢复期患者随机分为2组,对照组(n=23)给予综合性康复训练;治疗组(n=23)在对照组基础上给予GM1 40mg鞘内注射,每周1次,共3次。分别在治疗前和治疗第2个月末,采用ASIA评分标准对所有患者进行功能评定。结果 治疗后2组患者ASIA评分均较治疗前显著增高(P<0.05),治疗组与对照组相比明显增高(P<0.05);3例鞘内注射后次日双下肢肌力明显增加;所有穿刺脑脊液压力均在正常范围内,脑脊液常规、生化和细胞学检测均未见异常;治疗中未出现严重不良反应。结论鞘内注射GM1治疗恢复期脊髓损伤效果良好,费用低廉,安全可行。
脊髓损伤恢复期;单唾液酸神经节苷脂;鞘内注射
本文采用小剂量单唾液酸神经节苷脂(GM1)多次鞘内注射治疗恢复期脊髓损伤,效果良好,现报告如下。
1 资料和方法
1.1 入选标准(1)所有入选病例均符合美国脊髓损伤学会(American Spinal Injury Association,ASIA)诊断标准[1];(2)已接受椎管减压和(或)内固定,植骨融合术治疗;(3)经CT或MR证实脊柱骨折合并脊髓损伤;(4)病程为伤后30~90d。本研究经我院伦理委员会批准,患者及家属知情同意。1.2 排除标准(1)患有其他神经系统疾病,如脑外伤、脑血管病、帕金森病、精神分裂症、癫痫等;(2)患其他系统严重疾病,如心、肝、肾功能障碍、不稳定糖尿病、慢性阻塞性肺病、恶性肿瘤等;(3)不能按要求接受或完成治疗者。
1.3 一般资料 选取2009-09—2014-06符合上述条件的神经科住院脊髓损伤恢复期患者46例,随机分为治疗组和对照组。对照组23例,男18例,女5例;年龄19~52(35.2± 10.3)岁;颈髓损伤3例,胸腰髓损伤20例;病程31~82(45.0±11.2)d。治疗组23例,男16例,女7例;年龄21~55(36.2±12.5)岁;颈髓损伤4例,胸腰髓损伤19例;病程30~85(44.7±10.8)d。2组患者性别、年龄、病程等经统计学分析差异均无统计学意义(P>0.05)。
1.4 治疗方法(1)对照组给予综合性康复训练:包括常规物理治疗、日常生活训练、针灸、推拿按摩、心理疏导以及对症支持治疗,2次/d,共训练1个月。(2)治疗组在对照组基础上给予GM1鞘内注射治疗:腰椎穿刺注射GM1(申捷,齐鲁制药有限公司)40mg,1次/周,共3次。具体操作步骤:患者侧卧腰椎穿刺成功后测脑脊液初压,抽取脑脊液30mL,注入GM1 40mg,地塞米松2mg,回注脑脊液15mL,拔除穿刺针,去枕平卧6h后继续卧床18h。剩余脑脊液作常规、生化和细胞学检测。
1.5 疗效判定 采用ASIA评分标准对所有患者进行功能评定[1]:运动评定:选择上、下肢10块代表肌肉,左右两侧分别检查,按照Levet肌力标准(0~5级)评分,运动总分100分。感觉评定包括皮节的痛觉和触觉两部分,选择全身28个关键点,左右两侧分别检查针刺痛觉和轻触觉。按标准评分:缺失,0分;障碍,1分;正常,2分。痛觉共112分,触觉共112分。分别在开始治疗前和治疗开始后第2个月末进行评分。
1.6 统计学处理 应用SPSS 12.0统计软件,计量资料采用均数±标准差(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组治疗前后ASIA评分比较 治疗前2组ASIA各项评分无明显差异。治疗后2组患者各项评分均较治疗前显著增高(P<0.05)。治疗后治疗组各项评分均显著高于对照组(P<0.05)。见表1。
表1 2组治疗前后脊髓损伤患者ASIA评分(±s)
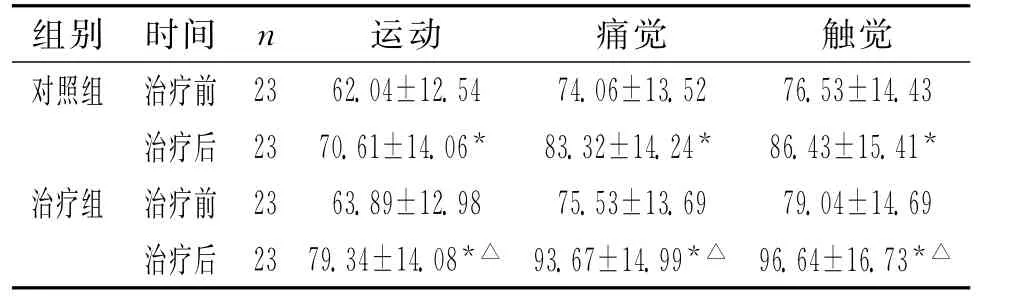
表1 2组治疗前后脊髓损伤患者ASIA评分(±s)
注:与治疗前相比,*P<0.05;与对照组相比,△P<0.05
组别 时间n 运动 痛觉 触觉对照组 治疗前23 62.04±12.54 74.06±13.52 76.53±14.43治疗后 23 70.61±14.06* 83.32±14.24* 86.43±15.41*治疗组 治疗前 23 63.89±12.98 75.53±13.69 79.04±14.69治疗后 23 79.34±14.08*△93.67±14.99*△96.64±16.73*△
2.2 脑脊液情况 所有腰椎蛛网膜下腔穿刺测得脑脊液压力均在正常范围内,脑脊液常规、生化和细胞学检测均未见异常。
2.3 不良反应 治疗组3例第1次鞘内注射治疗后次日双下肢肌力明显增加。1例1次腰椎穿刺后起床时出现低颅压头痛,予卧床补液后症状消失;3例共4次诉注射后当天轻度头晕,未予处理,自行好转;3例共5次治疗当天兴奋失眠;1例共2次治疗后出现低热,未处理自行恢复正常。
3 讨论
神经节苷脂是一类含唾液酸的鞘糖脂,在神经组织中非常丰富,是构成神经细胞膜的成分之一。该类物质能促进神经细胞分化,神经突生长以及突触形成,参与神经可塑性调节和脑损伤后的功能恢复。GM1是迄今研究最为深入的神经节苷脂。基础研究证实,外源性GM1作用机制包括神经营养,调节细胞内Ca2+稳态,抗兴奋毒性,抗氧化等[2]。Geistor等[3-4]应用大剂量GM1(100mg)静滴治疗早期脊髓损伤,明显改善受损神经功能。此后绝大多数研究也均强调早期、大剂量和静脉给药。与其他用于治疗脊髓损伤的药物相比GM1具有以下特点[5]:(1)药物本身是细胞膜成分:(2)外源性GM1可透过血脑屏障;(3)可多种途径给药;(4)机体耐受性好;(5)无明显不良反应。
实验证实,GM1具有明显的促进神经组织修复的作用。给予外源性GM1可促进体外培养神经元芽生和轴索生长。GM1可嵌入细胞膜,起到保护细胞膜的作用;后期对神经功能恢复起到明显促进作用[6]。
脊髓损伤急性期由于血-脊髓屏障受到破坏,血液中GM1可聚集到损伤部位,发挥治疗作用,静脉给药有一定优势。急性期过后血-脊髓屏障恢复,这种聚集作用明显减退。静脉给药的效果取决于GM1透过血-脊髓屏障的能力。
Ogura等[7]对GM1药代动力学进行详细研究,将氚标记的GM1注射到小鼠腹腔,8h后每克湿质量肝脏放射性活性是肾脏、脾脏、肺的10倍,是大脑的100倍。Dumontet等[8]给Wistar大鼠静脉注射3H-GM1,3h后大鼠肝脏蓄积放射性活性占总量的75%,肾、肺、脑中的放射性活性分别占总量的10.6%、5.2%、3.2%。由此可见,外源性GM1进入体内后,绝大多数通过肝脏代谢,进入神经组织的数量非常有限。
Coombs等[9]将GM1注入母羊蛛网膜下腔10mg/d,持续24周,进行GM1的神经毒理性研究。实验动物行为无异常,其脑组织和脑脊液中无GM1积聚,病理切片未发现神经细胞受损、胶质细胞增生、神经脱髓鞘等改变,证明GM1鞘内注射是安全的。
本实验GM1剂量远远低于常规静脉给药剂量。通过鞘内注射,药物可避开血-脑脊液屏障直接进入蛛网膜下腔,保证了脑脊液中有较高剂量的GM1,达到良好的治疗效果。我们认为,短时间内脑脊液中高浓度GM1有利于该药顺着浓度梯度向脊髓内部扩散,因脊髓本身较为细小,这种扩散效果相对明显。治疗组中3例鞘内注射后次日肌力明显增加,提示受损脊髓的恢复期可能需要GM1作为原料,或GM1有激活神经细胞的功能。治疗组无明显不良反应,表明鞘内注射GM1是安全的。究竟多大剂量,怎样的疗程更合理有待进一步探索。
[1]Manyard FM,Bracken KB,Creasey G,et al.International standards for neurological and functional classification of spinal cord injury patients[J].Spinal Cord,1997,35:266-274.
[2]董强.神经节苷脂GM1与神经系统疾病[J].国际脑血管病杂志,2009,17(12):881-888.
[3]Geisler FH,Dorsey FC,Coleman WP.Recovery of motor function after spinal cord injury-a randomized,placebo-controlled trial with GM-1ganglioside[J].N Engl J Med,1991,324(26):1 829-1 838.
[4]Geisler FH,Dorsey FC,Coleman WP.GM-1ganglioside in human spinal cord injury[J].J Neurotrauma,1992,9(Suppl):S407-S415.
[5]傅强,侯铁胜,鲁凯伍,等.神经节苷脂对急性脊髓损伤的治疗作用[J].中华创伤杂志,2000,16(12):720-722.
[6]Skaper SD,Leon A.Monosialogangliosides,neuroprotection,and neuronal repair processes[J].J Neurotrauma,1992,9(Suppl):S507-S512.
[7]Ogura K,Handa S.Metabolism of exogenous gangliosides GM1 and chemically modified GM1in mice[J].J Biochem,1988,104(1):87-92.
[8]Dumontet C,Rebbaa A,Portoukalian J.Kinetics and organ distribution of[14C]-sialic acid-GM3and[3H]-sphingosine-GM1 after intravenous injection in rats[J].Biochem Biophys Res Commun,1992,189(3):1 410-1 416.
[9]Coombs DW,Colburn RW,McCarthy LE,et al.Neurotoxi-cology of chronic infusion of the ganglioside GM1in the ewe:phaseⅠ.Intrathecal administration[J].Anesth Analg,1993, 77(3):507-515
(收稿2014-10-10)
Clinical study of intrathecal administration of GM1 ganglioside in the treatment of spinal cord injury duringconvalescence
Lai Fusheng,Li Huijun,Jiao Dongsheng,Wang Yanyan,Qian Shide,Zhao Quan,Lu Shaojun
Department of Neurology,No.454 Hospital of PLA,Nanjing210002,China
Objective To investigate the curative effect of intrathecal administration of GM1ganglioside in treating spinal cord injury(SCI)during convalescence.Methods A total of 46patients with SCI during convalescence were randomly divided into two groups,the control group(n=23)was treated by comprehensive rehabilitation training;on the basis of comprehensive rehabilitation training,the treatment group(n=23)was given 40mg GM1through intrathecal injection for 3times,once a week.ASIA assessments were used to observe the patients before the treatment and at the end of second month of the treatment.Results ASIA scores were improved significantly after treatment in both two groups(P<0.05).The scores of treatment group were improved significantly than that of control group(P<0.05).The leg strengths of three patients in treatment group increased significantly in the next day after intrathecal administration of GM1.In every subarachnoid puncture,all the detection indexes of cerebrospinal fluid were normal.There was no serious adverse reaction in the treatment.Conclusion In the treatment of SCI during convalescence,intrathecal administration of GM1is effective,cheap and practicable.
Spinal cord injury during convalescence;GM1ganglioside;Intrathecal injection
R744
A
1673-5110(2015)15-0010-03

