高产丁醇菌株诱变选育及发酵研究
王义强 王启业 ,华连滩 ,彭牡丹 ,钟 洁 ,罗 浪
(1. 中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004;2.中南林业科技大学生物技术实验室,湖南 长沙 410004;3. 国家林业局生物乙醇研究中心,湖南 长沙 410004)
高产丁醇菌株诱变选育及发酵研究
王义强1,2,3,王启业2,华连滩2,彭牡丹2,钟 洁2,罗 浪2
(1. 中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004;2.中南林业科技大学生物技术实验室,湖南 长沙 410004;3. 国家林业局生物乙醇研究中心,湖南 长沙 410004)
菌株是丁醇发酵生产的重要因素,优良丁醇菌株的选育及发酵条件优化是提高丁醇产量的有效途径。本研究选取工业上重要的产丁醇菌株——拜氏梭菌Clostridium beijerinckiiATCC 55025为对象,进行紫外诱变,获得了一株丁醇产量高、耐受性强和稳定性好的优良突变株Clostridium beijerinckiiU-57,由中国典型培养物保藏中心保存,注册号为CCTCC M 2013208。该突变株发酵产丁醇和总溶剂(丙酮、丁醇、乙醇)分别为6.44 g/L、10.57 g/L,较原始菌株分别提高了7.15%、6.98%。采用Plackett-Burman设计以及Box-Behnken响应面设计,对突变株U-57的最佳培养基组分进行了筛选。进一步通过正交实验对突变株U-57的最佳发酵条件进行了优化,发酵得丁醇和总溶剂产量分别为7.85 g/L、12.28 g/L,比优化前分别提高了21.9%、15.3%。研究结果为进一步工业化应用提供了基础。
拜氏梭菌;诱变;响应面法;丁醇发酵
在化石能源大量消耗和环境污染日益严重的今天,找寻环境友好型,经济可行性,能够替代化石能源的可持续发展能源是全球共同关心的热点问题[1-2]。丁醇不仅是重要有机溶剂和化工原料,也是可再生能源。作为生物燃料,丁醇具有能量密度大,燃烧值高,蒸汽压较低;与汽油能以任意比例混合;挥发性低,可管道输送;腐蚀性较小、水溶性低、污染轻等优点[4]。因此,丁醇燃料现已成为新一代可再生能源研究开发的热点与重点。
目前,丁醇的生产方法分为化学法和生物法,化学法主要包括乙醛醇醛缩合法和丙烯羰基合成法,生物法为微生物发酵法[3]。20世纪中叶起,随着石油化工业的迅速发展,当时的发酵法已被以丙烯为原料的羰基合成法取代,因此发酵法生产丁醇的发展受到阻碍。近年来,由于石油资源大量开采和利用而变得日益紧缺,导致其价格也快速上涨,从而导致化学法生产丁醇成本的不断增加。发酵法生产丁醇技术重新显示出其优越性,发酵法生产丁醇实现了以可再生资源替代不可再生的石油资源原料,与国家能源的可持续发展战略相符合[5-8]。
利用可再生原料通过微生物发酵生产丁醇受到人们的普遍关注。工业上常用的产丁醇菌有Clostridium beijerinckiiBA101、Clostridium beijerinckiiATCC 55025、Clostridium acetobutylicum824、Clostridium acetobutylicumNCIB 8052、Clostridium saccharobutylicumATCC BAA-117等,选育高产丁醇菌株是提高生产效益的重要途径之一。在自然环境中,菌种的突变频率低、幅度小,而通过人工诱发的突变是最常见的微生物菌种选育方法[7,9-10]。高产菌株的选育主要包括诱变选育和构建基因工程菌。前者通过非定向诱变,再进行选择性筛选,从大量的突变体中筛选出产量高、性状优良的突变株;后者通过定向改变丁醇代谢途径中决定丁醇产量高低的某一个或者多个基因,来提高菌种目标代谢产物。
本研究选用工业上重要的产丁醇菌株——拜氏梭菌Clostridium beijerinckiiATCC 55025为出发株,采用紫外诱变方法筛选得到了1株遗传稳定性好的高产突变株,并对高产突变株发酵培养基和发酵条件进行了优化,为进一步工业化应用提供了基础。
1 材料与方法
1.1 材料
1.1.1 菌种
拜氏梭菌Clostridium beijerinckiiATCC 55025,来源于美国典型培养物保藏中心(American type culture collection),为工业上重要的产丁醇菌株。
1.1.2 主要仪器
电鼓风干燥箱101-1AB:天津泰斯特;纯水机:艾科浦;pH计:德国赛多利斯;高压灭菌锅HVE-50:日本Hirayama;超净工作台W-CJID:天津泰斯特;生化培养箱:宁波莱福科技;722型分光光度计:上海舜宇恒平科学仪器;恒温振荡器:深圳市宝域科技;厌氧培养盒:日本三菱;气相色谱仪GC-14C:日本岛津;离心机KITMAN-T24:日本TOMY。
1.1.3 主要试剂
胰蛋白胨、牛肉膏(Oxoid公司);酵母浸粉(Aobox公司);琼脂(Biosharp公司);葡萄糖、氯化钠、可溶性淀粉、L-半胱氨酸盐酸盐、乙酸钠、K2HPO4、KH2PO4、MgSO4、FeSO4·7H2O、 醋酸铵、水解干酪素、MnSO4、天冬酰胺、溴甲酚紫、CaCO3、氨基苯甲酸、硫胺等均为国产分析纯(国药集团)
1.1.4 培养基
(1)普通培养基:胰蛋白胨10.0 g、牛肉膏10.0、酵母浸粉3.0 g、葡萄糖5.0 g、氯化钠5.0 g、可溶性淀粉1.0 g、L-半胱氨酸盐酸盐0.5 g、乙酸钠3.0 g、蒸馏水1.0 L。充分溶解,调pH到6.8,121 ℃高压蒸汽灭菌,20 min。斜面培养加1.5%的琼脂。
(2)YEM筛选培养基:葡萄糖40 g、酵母浸粉2 g、牛肉膏2 g、K2HPO40.5 g、MgSO40.2 g、FeSO4·7H2O 0.01g、醋酸铵 3 g、琼脂 15 g、蒸馏水1.0 L。充分溶解,调pH到6.8,115℃高压蒸汽灭菌20 min。
(3)BCP筛选培养基:葡萄糖10 g、酵母浸粉8 g、水解干酪素2.2 g、MnSO40.01 g、FeSO4·7H2O 0.01 g、天冬酰胺4g、溴甲酚紫0.4g、琼脂15 g、蒸馏水1.0 L。充分溶解,调pH到7.0,115℃高压灭菌20 min。
(4)丁醇耐受性选择培养基:在普通培养基中分别加入0 g、5 g、10 g、15 g、20 g、25 g丁醇。
(5)种子培养基:葡萄糖20g、酵母浸粉2 g、醋酸铵 3 g、KH2PO40.5 g、MgSO40.1 g、FeSO4·7H2O 0.01 g、MnSO40.01 g、L-半 胱 氨 酸 盐 酸盐0.5g,蒸馏水1 L。充分溶解,调PH到6.8,115℃高压灭菌20 min。
(6)发酵培养基:葡萄糖50 g、酵母浸粉1 g、醋 酸 铵 3 g、KH2PO40.5 g、MgSO40.2 g、FeSO4·7H2O 0.01 g、MnSO40.01 g、CaCO32 g、L-半胱氨酸盐酸盐0.5 g,蒸馏水1 L。充分溶解,调pH到6.8,115℃高压蒸汽灭菌20 min。
1.2 方法
1.2.1 菌培养方法
平板培养:涂布平板后,37℃厌氧培养2~3天。厌氧盒使用前喷洒75%酒精并紫外照射20 min。
种子培养:100 mL摇瓶,装液量80%,37℃厌氧恒温培养24 h。
发酵培养:100 mL摇瓶,装液量80%,37℃厌氧恒温培养72 h。
1.2.2 ATCC 55025菌悬液的制备及紫外诱变
取长势好的菌液,3000 r/min离心10 min,去上清液,加入无菌生理盐水,摇匀洗涤,3 000 r/min离心10 min,去上清液,加入无菌生理盐水,打撒菌体摇匀,再用无菌生理盐水稀释至108个/mL。
取上述单细胞悬液10 mL,于直径为9 cm的培养皿中,磁力搅拌下距20W紫外灯20 cm,处理 10 s、25 s、40 s、55 s、70 s,取每个照射时间的菌悬液0.1 mL,加无菌生理盐水稀释到1 mL,适当稀释后取0.1 mL涂布平板,37℃厌氧培养2~3 d,记录菌落数,计算致死率,绘制时间-致死率曲线。
1.2.3 高产突变菌株的筛选
(1)平板筛选
取1 mL处理液经梯度分别稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7倍后,涂布到YEM平板,每个梯度3个平板,避光37℃厌氧培养2 d。用无菌牙签挑取YEM平板上的菌落,转接到BCP平板,避光37℃厌氧培养培养36 h,黄色透明圈为正常菌落,紫色为产酸较低的突变株。
(2)发酵筛选
将平板筛选得到的突变株接到接种到种子培养基,37℃厌氧培养24 h后,以5%的接种量接种到装有80%发酵培养基的100 mL摇瓶中,37℃厌氧恒温培养72 h后,气相色谱检测发酵液中丁醇及总溶剂的含量,得到高产丁醇突变株。以同样的方法进行复筛。
1.2.4 遗传稳定性
将筛选得到的高产丁醇菌接到种子培养基中,37℃厌氧培养2 d作为F1代,后再连续继代6次,得到 F2、F3、F4、F5、F6、F7代,并且在继代的同时将各代菌株接种到发酵培养基中37℃厌氧培养72 h,气相色谱测发酵液中丙酮、丁醇和乙醇含量,根据测定结果判断其稳定性。
1.2.5 突变株与原始菌株丁醇耐受性比较
将出发菌ATCC 55025和高产丁醇突变株分别接到含有不同浓度梯度丁醇的耐受性选择培养基平板[8]上,37℃厌氧培养2 d,观察比较菌株间对丁醇的耐受性。
1.2.6 发酵培养基主要组分的Plackett-Burman筛选实验
在上述单因素实验的基础上,利用实验设计和数据分析软件Minitab15进行Plackett-Burman设计,根据软件给出的实验矩阵表确定各实验组的编码与取值[11-15]。本实验对葡萄糖、酵母粉、醋酸铵、KH2PO4、MgSO4、FeSO4·7H2O、CaCO3、L- 半 胱氨酸盐酸盐8个因素进行全面考察,选用N=12的PB设计,并根据单因素实验结果确定低水平(-1)值,高水平(1)为低水平的1.25倍,以丁醇产量(Y)为响应值。通过实验,软件分析数据,筛选出重要影响因素。
1.2.7 对丁醇发酵影响较大培养基组分响应面实验
对上述Plackett-Burman实验选出影响丁醇产量的重要因子,采用Box-Behnken设计实验,并利用软件做响应面分析,从而获得培养基中各重要因子的最佳组合[16-18]。
1.2.8 初始pH、接种量及装液量对发酵结果影响的正交实验
根据上述发酵条件的单因素实验结果,通过正交实验进一步考察初始pH、接种量和装液量三个条件因素对实验指标的影响。选择L9(34)正交表进行发酵实验,每组3个重复。利用方差分析实验结果,从而确定发酵条件的最佳组合[19-21]。
1.2.9 发酵产物气相色谱检测
采用气相色谱测定发酵液中溶剂的含量。气相色谱条件为色谱柱:安捷伦HP-INNOWAX,30 m×0.25 mm;检测器:FID;N2为载气,流速为35 mL/min,H2流速为35 mL/min,空气流速为350 mL/min;初始柱温45℃,保留1 min,然后以5℃/min升至150℃,保留2 min;进样口温度为180℃;检测器温度为200℃;进样量为1 μL,分流比为1:60,外标法定量。
2 结果与分析
2.1 紫外诱变及突变株的筛选
2.1.1 诱变剂量的选择
通过图1可以得出,紫外照射时间增加,ATCC 55025菌体的致死率也随之升高。在初期致死率升高较快,但是在100 s之后,随着照射时间的增加ATCC 55025菌体致死率变化幅度却在逐渐下降。100 s时,致死率已经达到87.6%,145 s时,致死率达到98.3%。经验认为致死率在80%~90%之间的处理较佳,所以选择致死率为87.6%时的100 s作为处理时间。
2.1.2 高产丁醇突变株的选育
出发菌株紫外诱变后经筛选培养基初筛和摇瓶发酵复筛后,获得一株性能优良的突变株,命名为Clostridium beijerinckiiU-57。在初始糖浓度为50 g/L的摇瓶发酵培养基中发酵72 h,结果见表1,从表1可以看出,丁醇、丙酮、乙醇、总溶剂产量都比出发菌株高,说明此突变菌株从葡萄糖到丁醇、丙酮和乙醇代谢通路都有增强。丁醇和总溶剂的产量较原始菌株分别提高了7.15%、6.98%。
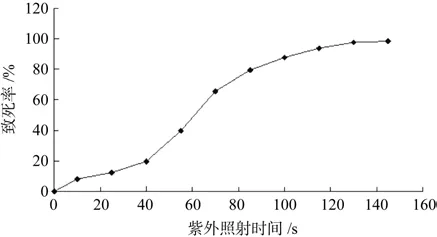
图1 ATCC 55025紫外照射致死率曲线Fig.1 Percentage dead after treatment of Clostridium beijerinckii ATCC 55025 with ultraviolet radiation

表1 在葡萄糖的发酵培养基中出发菌株和突变菌株溶剂的产生情况Table 1 Solvents production by the original and mutant strains in fermentation medium with glucose
2.1.3 突变株U-57遗传稳定性检测
突变株U-57遗传稳定性结果分别见表2。由表可知,突变株U-57经6次传代获得的7代菌株(F1~F7)发酵特性没有明显变化,丙酮、乙醇、丁醇和总溶剂产量基本趋于平稳,说明此突变菌株遗传稳定性好,适合进一步研究及工业化应用。

表2 突变株U-57遗传稳定性Table 2 Genetic stability of mutated strain U-57
2.1.4 突变株U-57与原始菌株丁醇耐受性比较
原始菌ATCC 55025与突变株U-57丁醇耐受性结果见表3。从表中可知,丁醇对菌体的毒性较大,丁醇浓度在30 g/L及以上时,原始菌株和突变株U-57都无法生长。当丁醇浓度在10~20 g/L时,突变株U-57生长情况比原始菌好,说明突变株U-57在一定丁醇浓度范围内对丁醇的耐受性强于原始菌株。
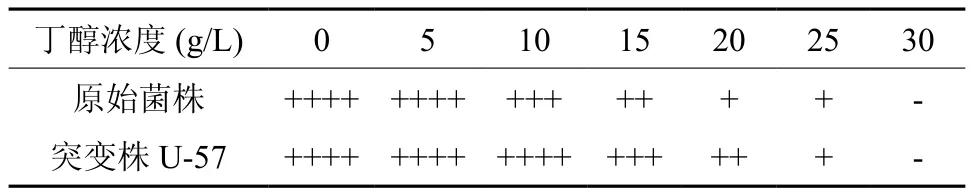
表3 丁醇对菌株生长的影响†Table 3 Effect of butanol on the growth of strain
2.2 突变株U-57发酵培养基与条件优化
2.2.1 影响丁醇产量的主要培养基组分
利用实验设计和数据分析软件Minitab15的Plackett-Burman模块设计实验,得到的实验设计与结果见表4。进一步对表4的结果用此软件进行分析,结果见表5。从表5中可得知,A、C和G三因素的P值都小于0.05,在大于95%的概率水平上差异显著;其余5个因素B、D、E、F和H的P值都大于0.05,在大于95%的概率水平上差异不显著。因此,葡萄糖(A)、醋酸铵(C)和CaCO3(G)是影响丁醇产量的主要因素。
图2为各因子贡献Pareto图,它是侧重于显示引起问题的因素之间的相对大小,在显著水平为0.05时,同样可以得出对丁醇产量影响显著的因素为葡萄糖、醋酸铵和CaCO3。

表4 Plackett-Burman实验设计与结果Table 4 Experimental design and results of the Plackett-Burman
2.2.2 产丁醇发酵培养基优化
在单因素实验的基础上,通过Plackett-Burman实验[11-13]筛选出了葡萄糖(X1)、醋酸铵(X2)、CaCO3(X3)是影响丁醇产量的主要因素,采用Box-Behnken设计,对这三个因素,采用响应面法进行三因素三水平实验优化。以Y(丁醇产量)为响应值,响应面实验[13-15]设计及结果见表6。
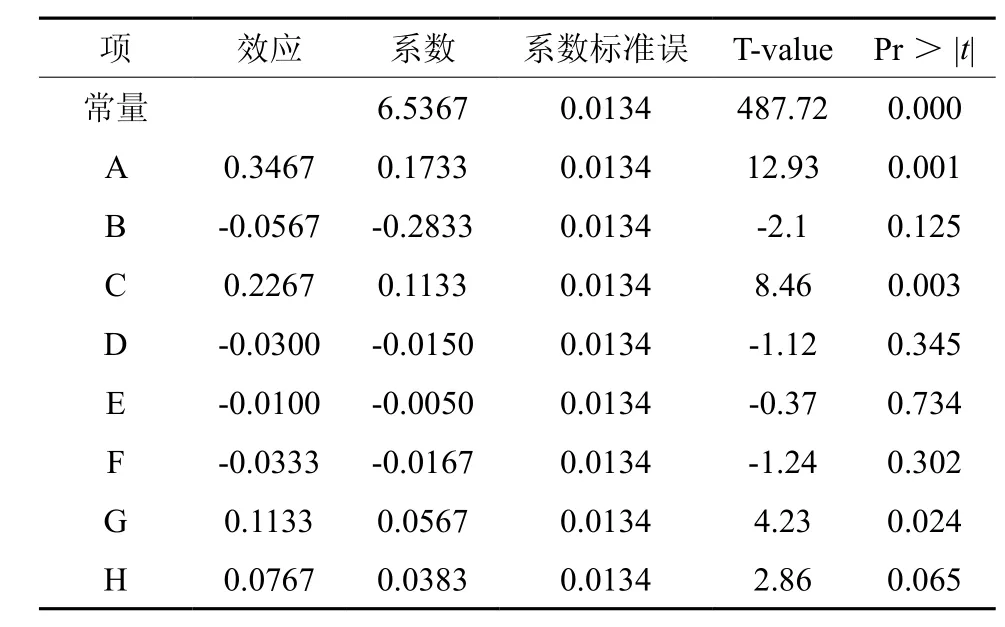
表5 各因素影响的主效应分析†Table 5 Analysis of main effects of factors for Plackett-Burman design
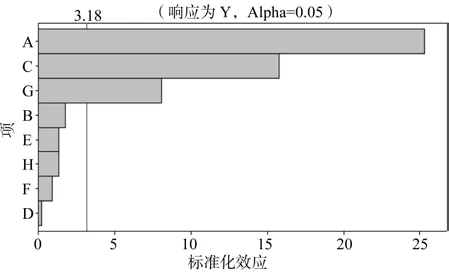
图2 8个因素的效应Pareto图分析Fig.2 Pareto chart of eight-factor standard effects on production of butanol
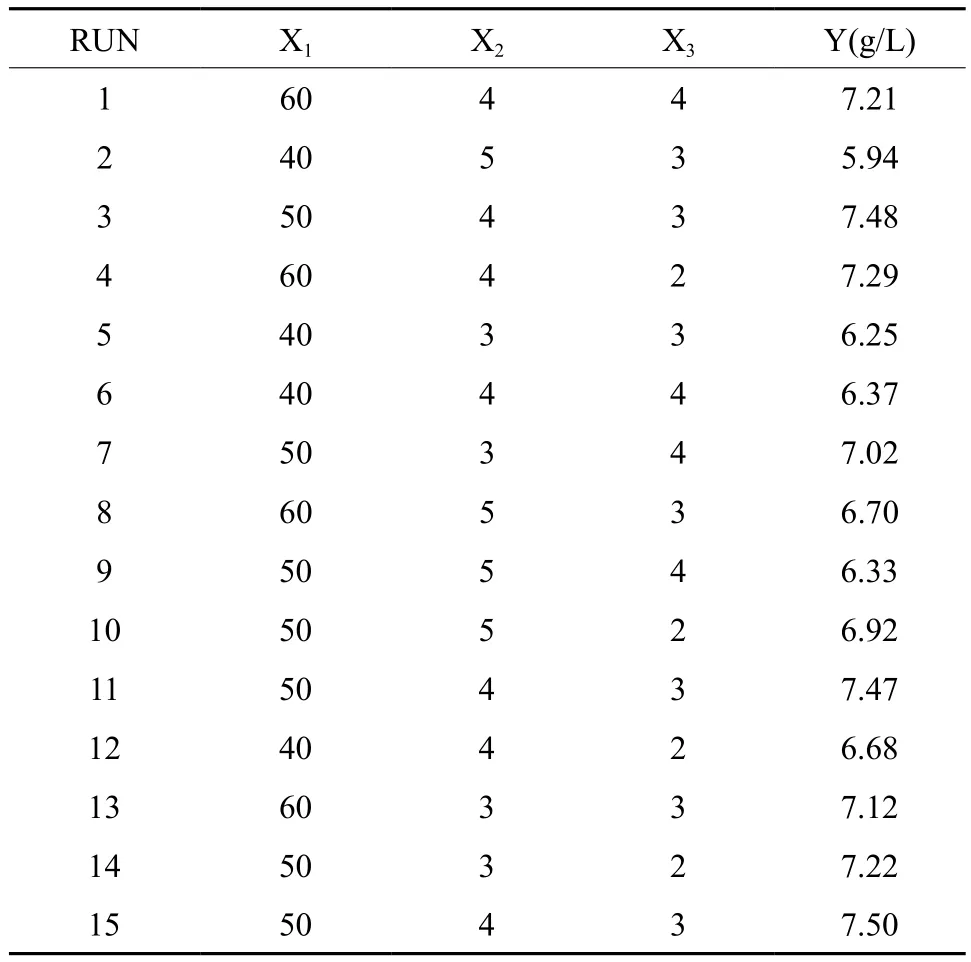
表6 响应面实验设计及结果Table 6 Result of the response surface test
以丁醇产量(Y)为响应值,三因素质量浓度为自变量,对数据进行多元回归拟合,获得回归方 程 为:Y=7.54+0.38X1-0.21X2-0.15X3-0.27X1X2+0.57X1X3-0.1X2X3-0.51X12-0.53X2
2-0.14X3
2。对该模型进行方差分析和显著性检验结果为表7,由此可知,葡萄糖、醋酸铵和碳酸钙三个因素的质量浓度对丁醇产量影响均达到显著水平。对回归方程中一次项系数的绝对值和回归系数检验性进行比较,判断因子影响丁醇产量的大小顺序为:葡萄糖>醋酸铵>CaCO3。二次回归模型的R2为0.990 7,方程P值<0.05,失拟检验P值为0.124 7>0.05,失拟不显著,实验结果可靠。因此模型选择正确,可用于预测丁醇产量。
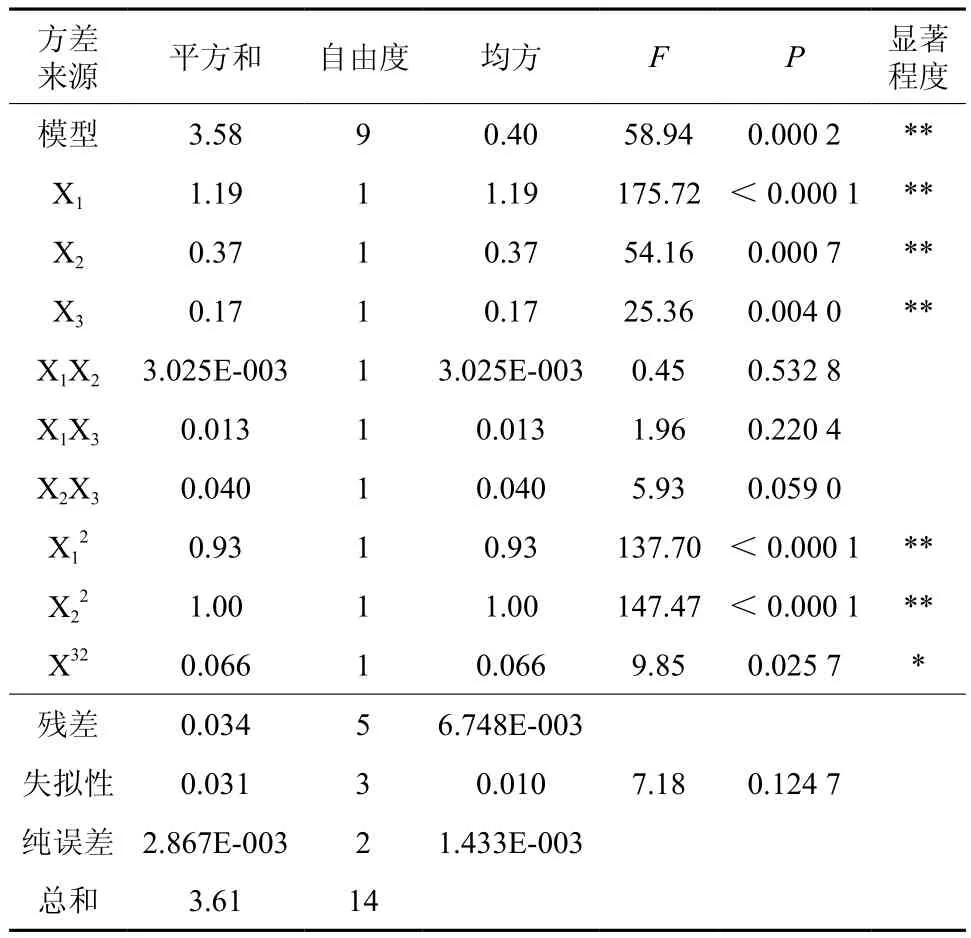
表7 方差分析及显著性检验Table 7 Variance analysis and significance test
进一步利用软件Design-Expert绘制模型Y的响应面立体曲面图和等高线图(图3、4、5)。从响应面分析图可知响应面变量Y有最大值,即X1、X2和X3存在极值点。利用Design-Expert软件进行分析后可知丁醇产量(Y)最大响应值为7.64 g/L,各因素的最佳取值分别为:葡萄糖质量浓度为53.66 g/L,醋酸铵质量浓度为3.82 g/L,CaCO3质量浓度为2.60 g/L。
根据模型预测的最优值,优化发酵培养基[15-17]进行发酵实验,对模型的适用性进行验证。丁醇的平均产量为7.55 g/L,与模型理论值相差1.19%,可见该模型能够预测丁醇产量的情况。
2.2.3 产丁醇发酵条件优化
在单因素实验基础上,确定发酵温度37℃,对发酵初始pH(A)、接种量(B)、装液量(C)进行正交实验采用L9(34)正交表设计实验。通过L9(34)正交表设计的方案,进行发酵实验,正交实验方案及结果见表8。对正交实验进行方差分析,分析结果见表9。根据上述正交实验并结合图表得出突变株U-57的最佳发酵条件为:发酵温度37℃、初始pH 6.5、接种量6%、装液量85%,此时的丁醇和总溶剂产量分别为7.85、12.28 g/L。
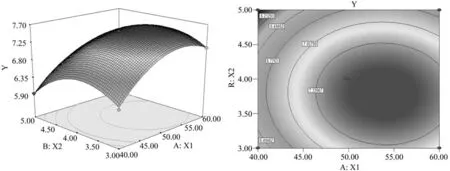
图3 葡萄糖与醋酸铵交互作用的响应面及等高线图Fig.3 Response surface and the contour of interaction of glucose and ammonium acetate
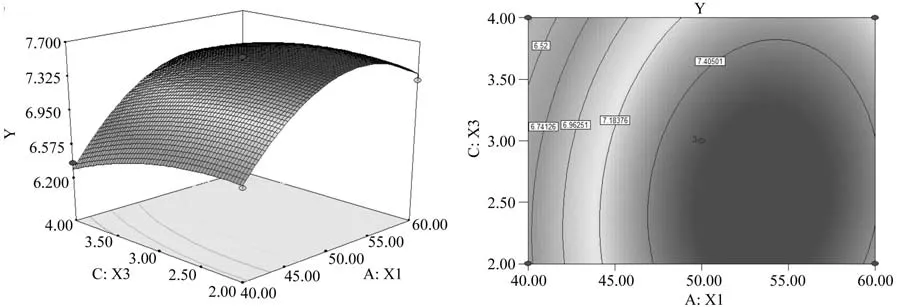
图4 葡萄糖与CaCO3交互作用的响应面及等高线图Fig.4 Response surface and the contour of interaction of glucose and CaCO3
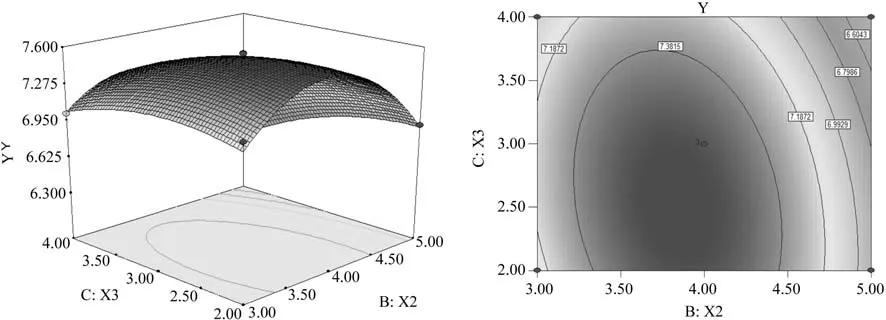
图5 醋酸铵与CaCO3交互作用的响应面及等高线图Fig.5 Response surface and the contour of interaction of CaCO3 and ammonium acetate
3 结 论
以Clostridium beijerinckiiATCC 55025为出发菌株,采用紫外诱变,获得最适紫外照射时间为100 s,对经过紫外线诱变之后的菌落进行平板初筛,发酵复筛,最终得到丁醇和总溶剂产量高的突变株U-57。经过7代发酵试验,突变株U-57遗传稳定性好,丁醇耐受性较强,发酵葡萄糖产总溶剂10.57 g/L,其中丁醇为6.44 g/L,较原始菌株分别提高了6.98%和7.15%。

表8 正交实验结果Table 8 Results of orthogonal experiment
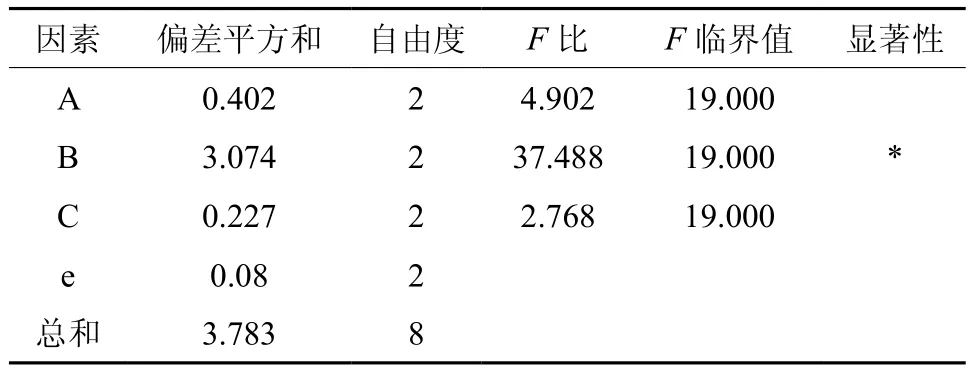
表9 正交实验方差分析和显著性检验Table 9 Variance analysis and significant of orthogonal experiment
在对发酵培养基中11个组分单因素实验的基础上,选取了8个对丁醇产量影响较明显的8个因素进行Plackett-Burman设计实验,经过实验得到了影响丁醇产量的3个显著性因素,即葡萄糖质量浓度、醋酸铵质量浓度和CaCO3质量浓度。在Plackett-Burman设计实验的基础上,对影响丁醇产量显著的3个因子做响应面实验,以丁醇产量(Y)为响应值,得到了预测丁醇产量的模型:
Y=7.54+0.38X1-0.21X2-0.15X3-0.27X1X2+0.57X1X3-0.1X2X3-0.51X12-0.53X22-0.14X3
2,其中X1为葡萄糖质量浓度、X2为醋酸铵质量浓度、X3为CaCO3质量浓度。
通过软件预测和验证实验,得到了发酵培养基的最佳组成为:葡萄糖53.66 g/L、酵母浸粉1.5 g/L、醋酸铵3.82 g/L、KH2PO40.75 g/L、MgSO40.2 g/L、FeSO4·7H2O 20 mg/L、MnSO410 mg/L、CaCO32.60 g/L、L-半胱氨酸盐酸盐0.5 g/L、对氨基苯甲酸3 mg/L、硫胺2 mg/L。
在发酵培养基优化的基础上,对发酵条件做单因素实验,然后根据单因素实验,设计发酵条件的正交实验,得到最佳发酵条件为:温度37℃、初始pH 6.5、接种量6%、装液量85%。最终得到的丁醇和总溶剂产量分别为7.85、12.28 g/L,其中丁醇产量提高了21.9%,总溶剂产量提高了15.3%。
本研究获得了一株高产丁醇的优良突变株Clostridium beijerinckiiU-57,保存在中国典型培养物保藏中心(注册号:CCTCC M 2013208),同时优化了其发酵培养基与发酵条件,为进一步工业化应用提供了基础。
[1]沈佩芝, 任 诚. 丁醇、辛醇生产技术与市场需求预测[J].化工进展 ,2005, 24(2): 216-220.
[2]黄格省, 李振宇, 张兰波, 等. 生物丁醇的性能优势及技术进展[J]. 石化技术与应用, 2012, 30(3): 254-259.
[3]顾 阳, 蒋 宇, 吴 辉, 等. 生物丁醇制造技术现状和展望 [J]. 生物工程学报 , 2010, 26(7): 914-923.
[4]Parekh M, Formanek J, Blaschek HP. Pilot-scale production of butanol byClostridium beijerinckiiBA101 using a low cost fermentation medium based on corn steep water[J]. Applied Microbiology and Biotechnology, 1999, 51: 152-157.
[5]Qureshi N, Saha B C, Cotta M A. Butanol production from wheat straw hydrolysate usingClostridium beijerinckii[J]. Bioprocess and Biosystems Engineering, 2007, 30: 419-427.
[6] 夏子义, 倪 晔, 孙志浩, 等. 利用Clostridium saccharobutylicumDSM 13864连续发酵生产丁醇[J]. 化工进展,2013,32(1):156-160.
[7]裴建新, 左文朴, 庞 浩,等. 高产生物丁醇新菌株的筛选、鉴定及发酵研究[J]. 可再生能源, 2011, 29(5): 99-102.
[8]刘 剑, 刘君昂, 周国英, 等. 竹材木质素高效降解菌的分离筛选及鉴定[J]. 中南林业科技大学学报, 2014, 34(8): 48-52.
[9]毛绍名, 章怀云. 丙酮丁醇梭菌高耐丁醇突变株的选育及其生理特性的研究[J]. 中南林业科技大学学报,2012,32(8):103-107.
[10]毛绍名, 章怀云. 丙酮丁醇梭菌丁醇耐受性[J]. 中国生物工程杂志 , 2012, 32(9): 118-124.
[11]杨承剑, 黄兴国, 李 伟,等. Plackett-Burman设计在益生菌生长主要影响因子筛选中的应用[J].饲料工业,2007,28(16):31-33.
[12]Pan CM, Fan YT, Xing Y,et al.Statistical optimization of process parameters on biohydrogen production from glucose byClostridiumsp. Fanp2[J]. Bioresource Technology, 2008, 99(8):3146-3154.
[13]Cai MH, Zhou XS, Sun XQ,et al. Statistical optimization of medium composition for aspergiolide a production by marine-derived fungusAspergillus glaucus[J]. J Ind Microbiol Biotechnol, 2009,36(3):381-389.
[14]Li YQ, Jiang HX, Xu YQ,et al. Optimization of nutrient components for enhanced phenazine-1-carboxylic acid production by gacA-inactivatedPseudomonassp. M18G using response surface method[J]. Appl Microbiol Biotechnol,2008,77(6): 1207-1217.
[15]Yuan LL, Li YQ, Wang Y,et al.Optimization of critical medium components using response surface methodology for phenazine-1-carboxylic acid production byPseudomonassp. M-18Q[J]. J Biosci Bioeng, 2008, 105(3):232-237.
[16]Trupkin S, Levin S, Forchiassin F. Optimization of a culture medium for lig-ninolytic enzyme production and synthetic dye decolorization using response surface methodology[J]. J Ind Microbiol Biotechnol,2003, 30(12): 682-690.
[17]Ratnam BVV, Narasimha RM, Dmodar RM,et al. Optimization of fermentation conditions for the production of ethanol from sago starch using response surface methodology[J].World Journal of Microbiology and Biotechnology, 2003,19(5): 523-526.
[18]吕 杰, 钟海雁, 袁英姿, 等. 油茶籽多酚微波辅助提取响应面法的优化[J]. 经济林研究, 2010, 28(3): 40-44.
[19]周海旭, 李忠海, 钟海雁, 等. 樟树叶多酚超声波法提取工艺的响应面优化[J]. 经济林研究, 2013, 31(4): 152-156.
[20]罗 倩, 黎继烈, 王 卫, 等. 重组毕赤酵母发酵产 PGA 的条件优化[J]. 中南林业科技大学学报, 2013, 33(5): 101-104.
[21]代志凯, 张 翠, 阮 征. 试验设计和优化及其在发酵培养基优化中的应用[J]. 微生物学通报, 2010, 37(6): 894-903.
Study on breeding and fermentation conditions of a high-yielding butanol strain mutant
WANG Yi-qiang1,2,3, WANG Qi-ye2, HUA Lian-tan2, PENG Mu-dan2, ZHONG Jie2, LUO Lang2
(1. Key Lab ofNon-wood Forest Nurturing and Protection of National Ministry of Education, Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Biotechnology Laboratory of Central South University of Forestry and Technology,Changsha 410004, Hunan, China; 3.Bio-ethanol ResearchCenter of State Forestry Administration, Changsha 410004, Hunan, China)
Strain is an important factor of butanol fermentation production, excellent butanol strains breeding and fermentation condition optimization is an effective way to increase butanol production.Clostridium beijerinckiiATCC 55025,an industry important butanol producing strain, was taken as the original strain ,treated with UV mutation. Finally we have got a mutant which has high butanol yield,strong butanol tolerance and good genetic stability, namedClostridium beijerinckiiU-57 which conserved in China Center for Type Culture Collection, registration number for CCTCC M 2013208.The yield of butanol and total solvent produced by mutant U-57 were 6.44 g/L and 10.57 g/L, which were 7.15% and 6.98% higher than the original strain. Through the Plackett-Burman design and Box-Behnken response surface design, the best medium components for the mutant strain U-57 fermentation was screened. Further through the orthogonal experiment, fermentation conditions of mutant U-57 were optimized. Under the best conditions, the yield of butanol and total solvent produced by mutant U-57 were 7.85 g/L and 12.88 g/L, which were 21.9% and 15.3% higher than before. The results provides a basis for further industrial application.
Clostridium beijerinckii; Mutation; Response surface methodology; Butanol fermentation
S718.8
A
1673-923X(2015)10-0120-07
10.14067/j.cnki.1673-923x.2015.10.021
2014-03-25
国家林业局“948”项目“木质纤维生物炼制丁醇汽油及聚乳酸生物塑料技术引进”(2011-4-13)
王义强,教授,博导,E-mail:wangyiqiang12@163.com
王义强,王启业,华连滩,等. 高产丁醇菌株诱变选育及发酵研究[J].中南林业科技大学学报,2015, 35(10):120-126,133.
[本文编校:吴 彬]

