低温和气调对不同色泽‘红富士’苹果贮藏期间果皮褪色现象的影响
陈 磊,郭玉蓉*,白 鸽,袁 莉
(陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
低温和气调对不同色泽‘红富士’苹果贮藏期间果皮褪色现象的影响
陈 磊,郭玉蓉*,白 鸽,袁 莉
(陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
研究低温和气调对不同色泽‘红富士’苹果贮藏期间果实理化指标的影响。以采收时2 种不同色泽的‘红富士’苹果为试材,分别测定贮藏期间果实硬度、可溶性固形物含量、pH值,果皮花青苷含量、多酚含量、9 种单体酚分含量和多酚氧化酶(PPO)、过氧化氢酶(POD)活性的变化。采收时,着色差的‘红富士’苹果果皮花青苷和多酚含量显著低于着色好的苹果,但其PPO、POD活性显著高于着色好的苹果;贮藏过程中,着色差的苹果果皮花青苷和多酚降解速度显著高于着色好的苹果。与冷藏相比,气调贮藏能有效地抑制花青苷和多酚的降解,延缓PPO、POD活性的上升,维持果实的品质指标。贮藏方式相同时,着色差的‘红富士’苹果比着色好的苹果更易发生果皮褪色现象;采收时色泽相同,则冷藏的‘红富士’苹果比气调贮藏的苹果更易发生果皮褪色现象。
苹果;花青苷;多酚;果皮色泽;冷藏;气调贮藏
苹果的果皮颜色直接影响果实的商品价值,尤其在中国,红色的苹果往往更容易被消费者所接受[1-2]。研究[2-3]表明,‘红富士’苹果果皮的色素由花青苷、类胡萝卜素、叶绿素组成,其中花青苷对果实的红色色泽起决定作用,其积累的多少和分布状况决定了果皮红色着色的程度。花青苷作为苹果多酚的主要成分,是重要的强抗氧化剂,具有很高的营养价值,能显著降低患动脉粥样硬化、神经退行疾病、癌症等相关疾病[4]。但由于苹果基因型[5]、采收时苹果着色程度[6]及贮藏条件[7]等因素,苹果贮藏过程中通常会出现果皮褪色现象[6-7],严重影响苹果的营养价值和商品价值。保持苹果贮藏期间的果皮色泽既满足了消费者的营养需求又满足了消费者的感官需求,因此具有重要的实际意义。
花青苷的体内降解是由多种酶催化共同完成,其中多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)、花色素苷酶被认为是负责花青苷降解的酶类[8-9],但是花色素苷酶的活性目前仅在微生物和荔枝中检测到。事实上,苹果采后贮藏期间果皮花青苷含量变化除了受上述相关酶活性变化的影响外,还受外部因素影响,例如,低温能促 进果实中花青苷积累并诱导相关酶基因的表达[11];1-甲基环丙烯(1-methlcyclopropene,1-MCP)能明显延长‘红富士’苹果贮藏寿命,抑制贮藏前期花青苷的积累,延缓花青苷的后期降解[10];气调贮藏能抑制果实花青苷及多酚的降解,诱导相关酶基因的表达[5-6];采收时果实着色程度会显著影响贮藏过程中花青苷的降解速率[6]。但尚未见低温和气调对不同色泽‘红富士’苹果贮藏期间果皮花青苷、多酚及其组分含量和PPO、POD活性影响的相关报道。本实验以采收时苹果果皮红色面积不小于80%和红色面积不大于20%的‘红富士’苹果为试材,研究采后冷藏和气调贮藏对苹果果实品质指标,果皮花青苷、多酚含量及PPO、POD活性的影响,并分析着色程度和贮藏方式对苹果花青苷和多酚组分的影响及二者之间的相关性,以期为‘红富士’苹果贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料
实验于2013—2014年在陕西华圣果业有限公司贮藏室和陕西师范大学食品学院实验室进行,材料为陕西洛川农家果园的不套袋‘红富士’(Malus domestica Borkh. cv. Red Fuji)苹果,选择大小基本一致、果形端正、成熟度一致的无损伤、无病虫危害的果实,并按照果实颜色将其分成两组:着色好(红色≥80%)和着色差(红色≤20%)。
1.2 仪器与设备
压蒜器 苏泊尔有限公司;糖度计 日本Atago公司;全波长酶标仪 美国Thermo公司;pH计 上海Ιnesa公司;液相色谱仪(C18柱:Dikma 250 mm×4.6 mm,5 μm) 美国Dionex公司。
1.3 方法
1.3.1 果实处理及分组
将每组6 筐苹果(每筐60 个)平均分成两部分,分别放入陕西华圣果业有限公司的冷库(0±0.5) ℃和气调库((0±0.5) ℃;O2:2.5%~3.0%;CO2: 1.0%~1.1%;相对湿度:90%~95%;1-MCP:1.01 μL/L处理24 h)进行贮藏,贮藏期间完全按照陕西华圣果业贮藏条件进行管理。2 组苹果在2 种贮藏方式中均设置3 个重复。贮藏过程中,每组每种贮藏方式分别定期取30 个果实,取出后立即用冰壶带回实验室,并测定硬度、可溶性固形物含量和pH值后,将果实皮(厚度约0.5 mm)、肉分开,并用液氮速冻,然后保存到-80 ℃冰箱贮藏,用以后续实验。
1.3.2 指标测定
1.3.2.1 品质指标的测定
果实硬度测定:采用硬度计测 定。八分法取果肉,用手持压蒜器榨汁后分别测定可溶性固形物含量和果汁pH值[12-13]。
1.3.2.2 果皮花青苷总量测定
参照Xie等[14]的方法稍加改动。用液氮研磨果皮样品后,取1.0 g样品,按料液比1∶4加入 1% HCl-甲醇溶液,充分混匀后,4 ℃冰箱黑暗浸提24 h,将提取液在4 ℃、12 000 r/min离心10 min,上清液分别测定553 nm和600 nm波长处吸光度。以每克果皮鲜质量的提取液的吸光度变化值A553nm-A600nm= 0.01作为1个花青苷单位,以U表示。每个处理重复3 次,以鲜质量计。
1.3.2.3 花青苷含量的测定
参照王延玲等[15]的方法稍加修改,将上述总花青苷提取液经0.22 μm的有机系滤膜过滤后,取400 μL转移至进样瓶中等待进样。Dionex UPLC液相分析系统和Dikma HPLC柱(250 mm×4.6 mm,5 μm);溶液A(乙腈)和溶液B(1‰三氟乙酸溶液)。利用溶液B进行梯度洗脱:0 min,88% B;1 min,88% B;15 min,70% B;20 min,70% B;25 min,88% B;30 min,88% B。柱温:30 ℃;流动相速率:1.0 mL/min,进样量:20 μL,在500 nm波长进行花青苷成分的检测,与标品出峰时间比对鉴定花青苷的成分。每个处理,重复3 次,用峰面积值表示各物质含量。
1.3.2.4 果皮多酚含量的测定
参照孙建霞等[16]的方法稍加改动。用液氮研磨样品后,取1.0 g样品,按料液比1∶4 加入 65%乙醇溶液,充分混匀后,58 ℃水浴35 min,将提取液在 4 ℃、12 000 r/min离心10 min,取上清液。取1.0 mL上清液液加入12.0 mL饱和NaCO3溶液和1.0 mL福林酚,定容至25.0 mL。室温避光反应1 h后,用全波长酶标仪测定765 nm波长处吸光度。每个处理,重复3 次。
1.3.2.5 多酚组分的测定
将上述多酚提取上清液经 0.45 μm的有机系滤膜过滤后,取4 0 0 μ L转移至进样瓶中等待进样。Dionex UPLC 液相分析系统和Dikma HPLC柱(250 mm×4.6 mm,5 μm);溶液 A(甲醇)和溶液B(3‰ 三氟乙酸溶液)。利用溶液B 进行梯度洗脱:0 min,80% B;10 min,80% B;12 min,78% B;20 min,78% B;22 min,68% B;40 min,68% B;42 min,60% B;50 min,60% B;52 min,55% B;70 min,55% B;72 min,50% B;80 min,45% B;88 min,80% B;95 min,80% B。柱温:30 ℃;流动相速率:1.0 mL/min;进样量:20 μL。在280 nm波长进行多酚组成的检测,和标品出峰时间进行比对鉴定多酚的成分。每个处理,重复3 次,用峰面积值表示各物质相对含量。
1.3.2.6 POD和PPO活性的测定
果皮POD活性参照Jiang Yueming等[17]的方法测定,果皮PPO 活性参照Sarni等[18]的方法测定。
1.4 数据处理
利用SPSS 18.0软件进行平均值、标准差、显著性和相关性统计分析,利用Microsoft Offi ce Excel 2007软件进行其他数据计算及作图。
2 结果与分析
2.1 冷藏和气调贮藏对苹果果实品质指标的影响
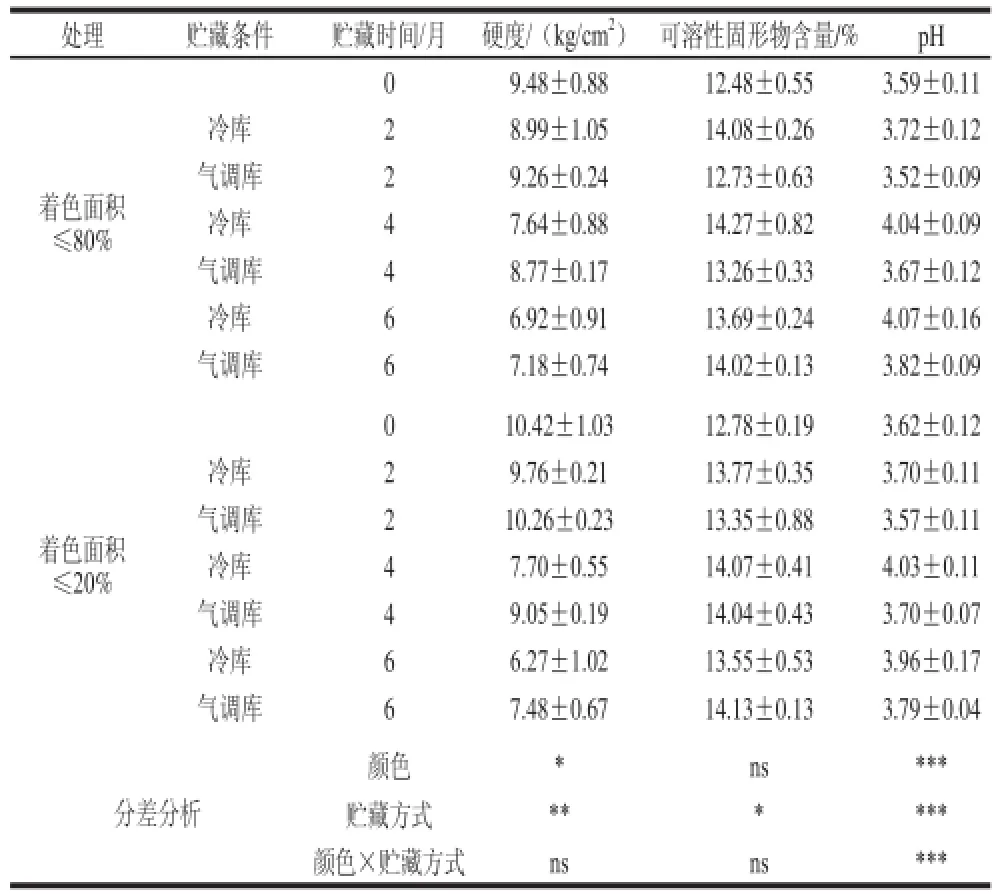
表1 ‘红富士’苹果贮藏过程中理化指标的变化(x±s,n = 1100)Table1 Changes in physicochemical indexes in‘Red Fuujjii’ apppllee during storaggee ((x ± s,, n = 1100))
表1显示果实颜色和贮藏方式对贮藏过程中果实品质指标的影响。采收时,着色差的‘红富士’苹果的果实硬度和pH值均大于着色好的‘红富士’苹果。随着贮藏时间的延长,2 种不同色泽的苹果硬度均逐渐下降,pH值逐渐均升高,气调贮藏果实的可溶性固形物含量逐渐升高,冷藏果实的可溶性固形物含量呈先升高(4个月达到最大值)后降低趋势。相同贮藏方式,着色差的苹果果实品质指标变化幅度大于着色好的苹果。贮藏期间,颜色对硬度和可溶性固形物无显著性影响,但对pH值有极显著(P<0.001)的影响,这是因为果皮花青苷含量与pH值之间有密切的相关性[9]。与冷藏相比,气调库贮藏能显著延缓果实硬度(P<0.01)和可溶性固形物含量(P<0.05)下降,并能极显著(P<0.001)延缓pH值升高,上述现象说明气调贮藏能延长果实后熟时间,延缓果实衰老。气调贮藏比冷藏更有效延缓果实衰老的主要原因在于气调库具有的较高浓度CO2和1-MCP能抑制乙烯合成及相关酶活性,进而延缓果实后熟和衰老,较好地维持果实理化指标[6,10],进而延长贮藏寿命[19]。
2.2 冷藏和气调贮藏对苹果果皮花青苷含量的影响
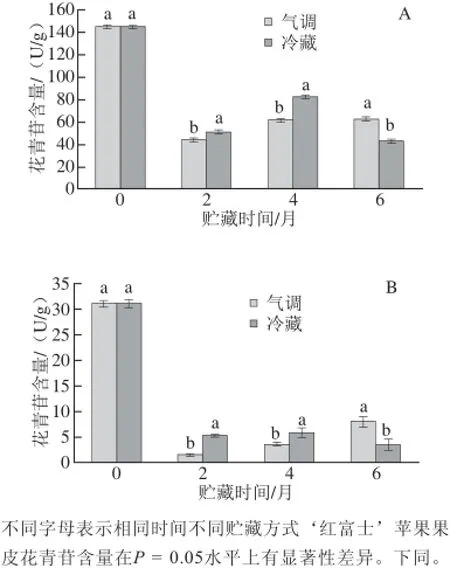
图1 着色好(A)和着色差(B)‘红富士’苹果在贮藏过程中果皮花青苷含量变化F ig.1 Changes in anthocyanin content of well-colored (A) and bad-colored (B) ‘Red Fuji’ apple peels during storage
由图1可见,着色好的苹果收获时总花青苷含量为144.56 U/g,在冷藏和气调贮藏两个月后总花青苷含量分别下降到51.42 U/g和44.07 U/g,到贮藏4 个月时花青苷含量均有所回升,分别达到82.52 U/g和60.93 U/g,到贮藏6 个月时花青苷含量分别达到42.97 U/g和62.84 U/g,其含量下降幅度分别为42.92%~70.28%和56.53%~69.51%。着色差的苹果收获时总花青苷含量为31.10 U/g,在冷藏和气调贮藏两个月后总花青苷含量分别下降到5.32 U/g和1.46 U/g,到贮藏4 个月时花青苷含量均有所回升,分别达到5.83 U/g和3.60 U/g,到贮藏6 个月时花青苷含量分别达到3.46 U/g和7.94 U/g,其含量下降幅度分别为81.25%~88.87%和74.47%~95.31%。
综上所述,就贮藏方式而言,贮藏前期,2 种色泽的苹果均表现为冷藏果实的花青苷含量高于气调贮藏果实,且在第4个月达到峰值,随后冷藏果实花青苷含量开始下降;气调贮藏苹果花青苷含量从第2个月开始持续缓慢上升,直到贮藏6个月。这是因为气调贮藏中1-MCP处理及高体积分数的CO2会抑制乙烯的合成,推迟果实衰老进程的同时,同时也会形成高体积分数CO2和低温双重逆境的刺激,会导致花青苷合成相关基因表达量显著降低[6],相关合成酶活性显著下降[10],因此贮藏前期果实花青苷合成起抑制作用,所以贮藏前4 个月相同着色程度的冷藏果实花青苷含量高于气调贮藏果实花青苷含量;但随着贮藏时间的延长,果实逐渐适应贮藏环境,相关酶活性逐渐升高,果实开始衰老时,气调贮藏抑制花青苷降解相关酶(如PPO、POD)活性,所以气调贮藏表现为:延长花青苷积累过程,延缓花青苷降解。就着色程度而言,着色差的果实在贮藏期间花青苷的下降幅度明显大于着色好的果实。上述现象与Harb等[7]的研究相同,究其原因,花青苷是强抗氧化剂[4],着色好的苹果果皮中因具有较高浓度的花青苷,所以比着色差的苹果具有更强的抗逆能力[7],进而相同贮藏条件下,着色好的果实更有利于果实色泽的保存。
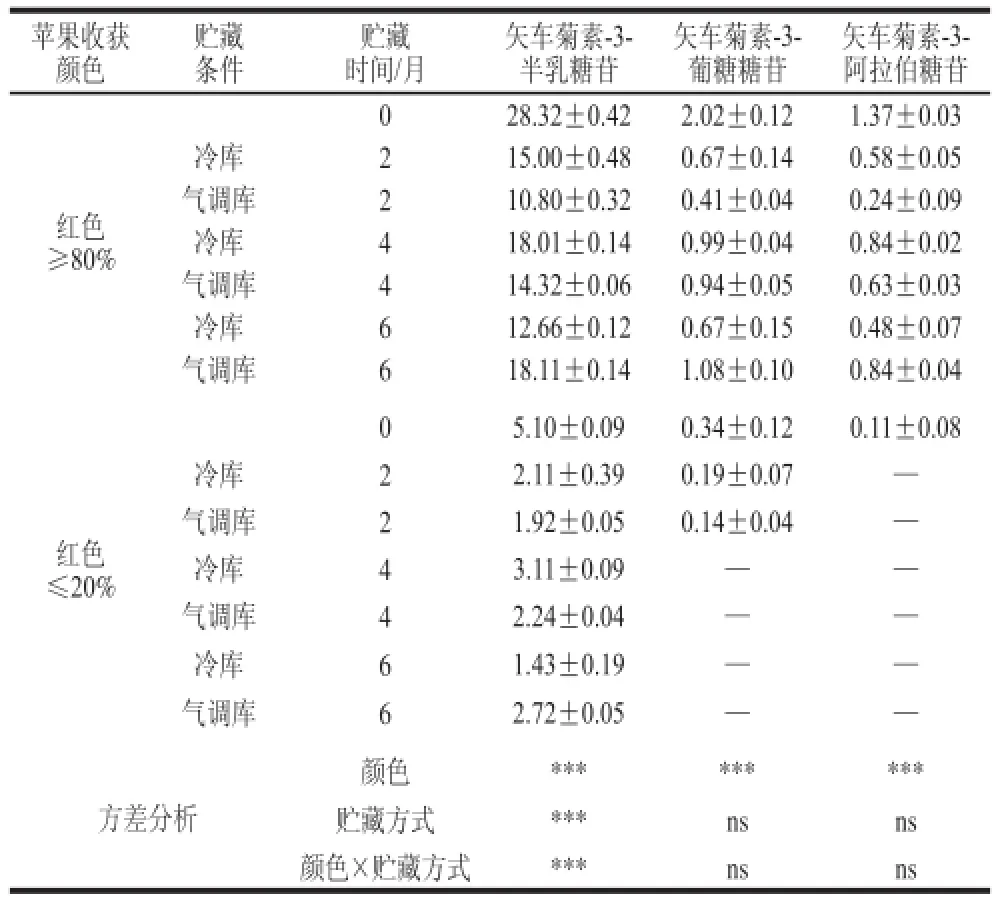
表2 ‘红富士’苹果贮藏过程中果皮中矢车菊素-3-半乳糖苷、矢车菊素-3-葡萄糖苷和矢车菊素-3-阿拉伯糖苷相对含量变化(x ±s,n == 33)Table2 Concentrations of cyaniding-3-galactoside, cyaniding-3-glucoside (Cy-glu) and cyaniding-3-arabinoside in ‘Red Fuujjii’ apple peels during storage (x ± s,, n == 33))
目前苹果果皮的花青苷组分已经确定了5 种,分别是矢车菊素-3-半乳糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷、矢车菊素-3-芸香糖苷、矢车菊素-3-木糖苷,其中前3 种占总花青苷的90%左右[10]。由表2可知,矢车菊素-3-半乳糖苷的变化趋势与总花青苷变化趋势相同,但由于贮藏过程中着色差的果实果皮中矢车菊素-3-葡萄糖苷和矢车菊素-3-阿拉伯糖苷含量太低,高效液相色谱没能检测出,导致数据分析时出现缺失,但可以大胆推测,矢车菊素-3-葡萄糖苷和矢车菊素-3-阿拉伯糖苷也符合总花青苷的变化趋势。
2.3 冷藏和气调贮藏对苹果果皮多酚含量的影响
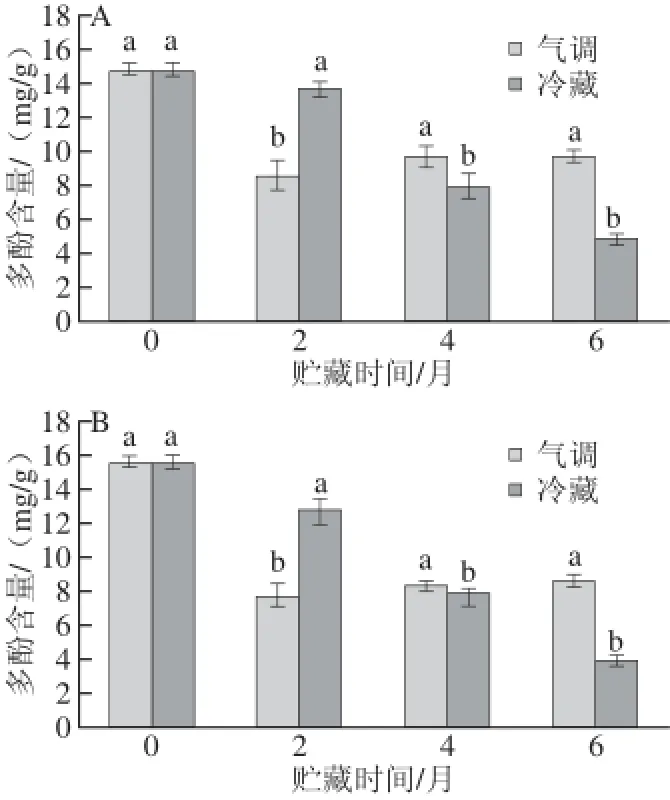
图2 着色好(A)和着色差(B)‘红富士’苹果在贮藏过程中果皮多酚含量变化Fig.2 Changes in content of total polyphenol contents of well-colored (A) and bad-colored (B) ‘Red Fuji’ apple peels during storage
由图2可看出,随着贮藏时间的延长,冷藏果实果皮多酚呈逐渐降低的变化趋势;气调贮藏果实果皮多酚在贮藏2 个月时,出现剧烈下降,随后多酚含量开始有所回升。相同贮藏方式,不同着色程度果实在贮藏过程中果皮多酚变化趋势相同,但着色差的果实果皮多酚下降幅度更大。着色好的果实冷藏多酚下降幅度为7.81%~67.83%,气调贮藏果实多酚下降幅度为34.45%~41.79%;着色差的果实冷藏多酚下降幅度为17.91%~75.18%,气调贮藏果实多酚下降幅度为45.11%~50.54%。
贮藏期间花青苷含量的快速降低(图1)会间接地影响果皮细胞膜的完整性[7],使酚类物质易与PPO、POD接触,导致多酚含量降低[10],所以着色差的果实花青苷降解幅度大于着着色好的果实,而本研究也证实了这一观点。气调贮藏中的1-MCP[9]、高体积分数CO2会抑制PPO、POD的活性,所以气调对贮藏能延缓苹果果皮多酚的降解。
贮藏条件对苹果果皮多酚成分含量变化的影响,目前主要有2 种不同的观点:一种认为,果皮中槲皮素-3-半乳糖苷和槲皮素-3-葡萄糖苷的含量会在贮藏过程中大幅度上升[20]。另一种认为,果皮中矢车菊素-3-半乳糖苷、绿原酸和根皮苷的含量在贮藏过程中基本保持不变[21]。
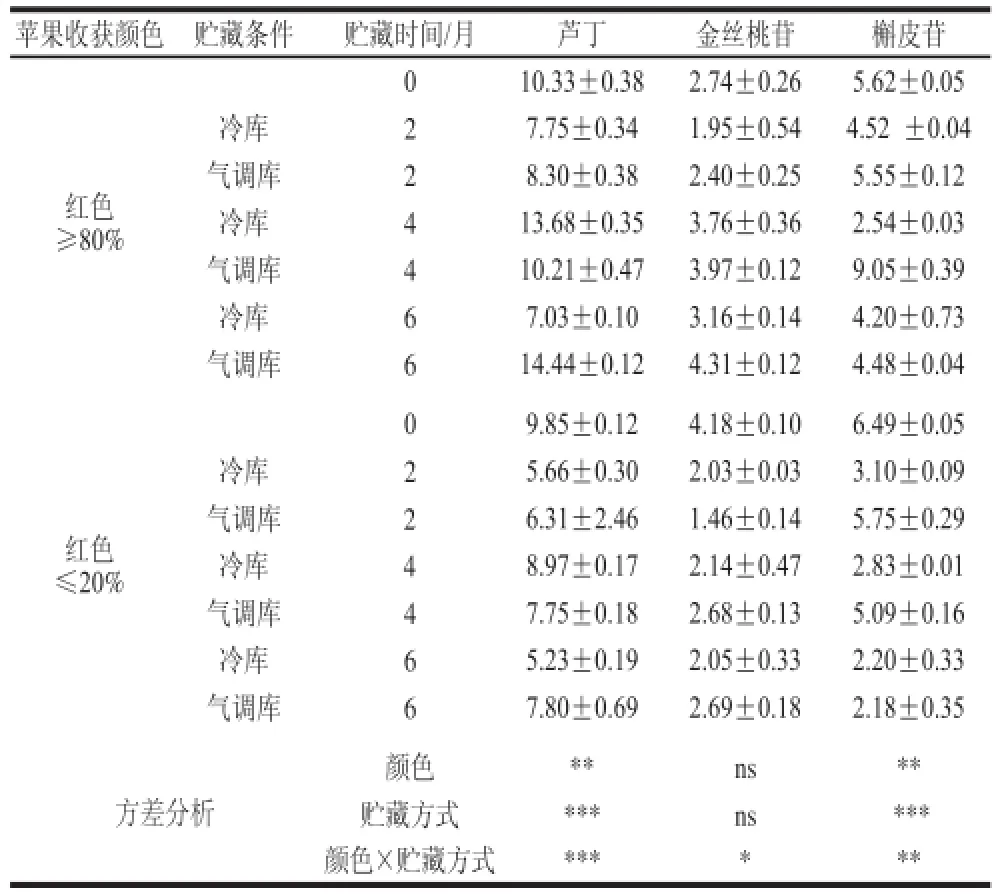
表3 ‘红富士’苹果贮藏过程中果皮中芦丁、金丝桃苷和槲皮苷的相对含量变化(x±s,n = 1100)Table3 Changes in concentrations of rutin, hyperin and quercitrin in‘Red Fuujjii’ apple peels during storage (x ± s,, n = 1100))
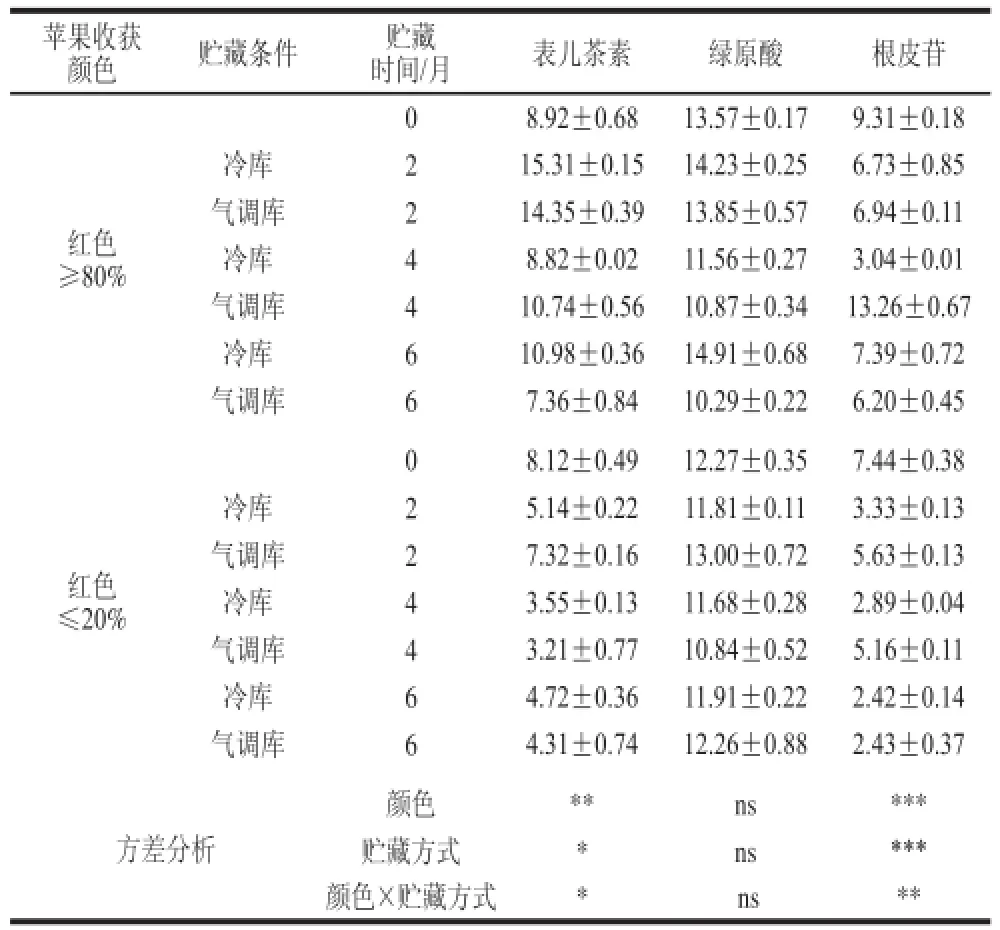
表4 ‘红富士’苹果贮藏过程中果皮中表儿茶素、绿原酸和根皮苷相对含量变化(x±s,n = 1100)Table4 Changes in concentrations of catechin, chlorogenic acidand phloridzinn iinn ‘Red Fuujjii’ apple peels during storage (x ± s,, n = 1100))
表3显 示了贮藏方式和果实色泽对果皮中的芦丁、金丝桃苷和槲皮苷含量的影响。贮藏期间着色好的苹果中的芦丁和槲皮苷与矢车菊素-3-半乳糖苷的变化趋势基本一致,均呈先下降后上升再下降的趋势;芦丁在冷藏4个月时达到最大值,气调贮藏则在6 个月时达到最大;槲皮苷在冷藏2 个月达到峰值,气调贮藏则是4 个月达到最大值;金丝桃苷含量虽在贮藏初期有所降低,但随着贮藏时间的延长,含量逐渐增加,尤其着色好的苹果中含量大于收获时果皮中金丝桃苷含量。表4显示了贮藏方式和果实着色程度对苹果果皮中表儿茶素、绿原酸和根皮苷含量的影响。贮藏期间,表儿茶素、绿原酸和根皮苷均呈先上升后下降的趋势,但着色好的苹果果皮表儿茶素和根皮苷含量始终高于着色差苹果;而绿原酸和根皮苷则不受苹果着色程度影响;3种多酚含量均在冷藏4 个月时达到峰值,在气调贮藏6 个月时达到峰值。
正是因为多酚单体之间的协同效应,使植物具有抗逆的能力[19],比如减缓花青苷降解。然而,基于本实验结果可知,着色差的‘红富士’苹果在贮藏过程中黄酮类物质(矢车菊素-3-半乳糖苷、金丝桃苷、根皮苷和表儿茶素)含量的大幅度下降,导致果皮抗氧化能力和抗逆能力的大幅度降低[23-24],进而导致果皮褪色这一生理失调现象发生。
2.4 冷藏和气调贮藏对PPO、POD活性的影响
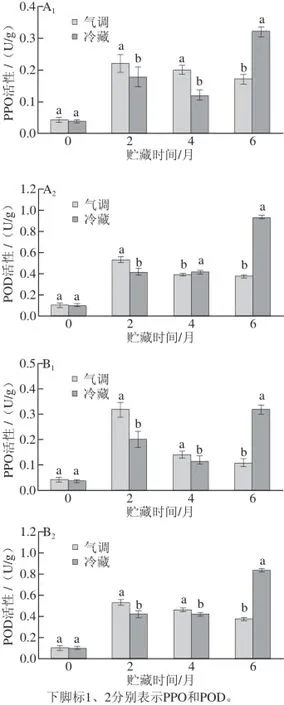
图3 着色好(A)和着色差(B)‘红富士’苹果在贮藏过程中果皮PPO和POD活性变化Fig.3 Changes in activities of PPO and POD of well-colored (A) and bad-colored (B) ‘Red Fuji’ apple peels during storage
相关研究认为,降解苹果体内花青苷的酶主要是PPO和POD,但PPO并不能直接促进花色苷的降解,而是通过PPO催化酚类物质形成醌类化合物,在该醌类物质存在的条件下进一步氧化降解[16];与PPO相似,POD通过依赖H2O2和其他酚类的存在,才能使花青苷降解[17],这也进一步解释花青苷成分与部分酚类物质呈正相关这一现象[7]。
由图3可知,就贮藏方式而言,冷藏期间,PPO和POD活性变化趋势相同,均呈升-降-升的变化趋势;气调贮藏期间,PPO和POD活性均呈先升后降的变化趋势,且下降幅度明显减小;贮藏2个月时,气调贮藏果实的PPO、POD活性均显著高于冷藏果实酶活性,这与气调贮藏2 个月时花青苷含量显著低于冷藏果实花青苷含量现象相符合,但原因尚不清楚,推测可能与CO2伤害有关,具体细节还需进一步研究。随着贮藏时间的延长,冷藏和气调贮藏果实的PPO、POD活性开始逐渐被抑制,这与果实贮藏的环境有关。冷藏果实在贮藏6 个月时酶活性又开始大幅度上升,这是因为贮藏后期果实衰老,细胞膜完整性下降,细胞透过性增强,大量酚类物质与PPO和POD接触。因此,气调贮藏通过抑制果实PPO和POD活性的上升,延缓花青苷降解;从着色程度来看,着色差苹果贮藏期间PPO和POD活性均高于着色好苹果的,这也进一步解释了着色差果实花青苷降解速度更大的现象。
3 结 论
‘红富士’苹果贮藏过程中发生‘果皮褪色’主要有以下几种原因:1)苹果贮藏过程花青苷降解与苹果收获时的颜色关系密切,苹果收获时着色差的苹果果皮花青苷和多酚含量低,导致果皮抗氧化性能力弱,进而导致苹果在贮藏过程中抗逆性能力变弱,造成生理失调,比如,果实褪色。2)随着贮藏时间的延长,果实pH值变大,苹果皮多酚含量降低,花青苷的合成前体物质减少,花青苷合成相关基因表达量下降及合成酶活性降低等综合因素共同决定花青苷合成速率降低。3)贮藏后期花青苷降解酶活性升高,花青苷降解速率变大,花青苷的降解大于合成能力,表现为花青苷降解。4)随着贮藏时间的延长,果实逐渐衰老,果皮细胞膜酯化度逐渐升高,致使更多的酚类物质与PPO、POD接触而被氧化,花青苷参与该反应加速了自身的降解,而气调贮藏中1-MCP处理和高体积分数CO2通过抑制果实乙烯的合成及释放,延缓果实的衰老,抑制PPO、POD活性的上升,所以延缓花青苷的降解,进而表现出花青苷积累,但积累速度逐渐降低,最终表现出花青苷降解。
综上所述,‘红富士’苹果贮藏过程中果皮褪色是一个综合现象,不能单一地认为由花青苷含量低所引起,与果实自身所在贮藏环境,果实中糖含量、pH值、花青苷合成相关基因表达量和花青苷降解酶活性等综合因素共同决定,因此仍需系统地研究花青苷降解与上述因素之间的相关度、花青苷降解分子机制,确定导致花青苷降解的主要因素,以期为‘红富士’苹果贮藏品质的研究提供理论依据。
[1] SAURE M. External control of anthocyanin formation in apple: a review[J]. Scientia Horticulturae, 1990, 42(3): 181-218.
[2] JU Zhiguo. Fruit bagging, a useful method for studying anthocyanin synthesis and gene expression in apple[J]. Scientia Horticulturae, 1998, 77: 155-164.
[3] 李秀菊, 刘用生, 束怀瑞. 红富士苹果套袋果实色泽与激素含量的变化[J]. 园艺学报, 1998, 25(3): 209-213.
[4] WOLFE K, WU X Z, LIU R H. Antioxidant activity of apple peels[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 609-614.
[5] LATA B, TOMALA K. Apple peel as a contributor to whole fruit quantity of potentially healthful bioactive compounds. Cultivar and year implication[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 10795-10802.
[6] HARB J, SALEH O, KITTEMANN D, et al. Upregulation of polypenolrelated genes prevents ‘skin burning’ of well-colored ‘Cameo’ apples stored under stressful controlled atmosphere conditions[J]. Postharvest Biology and Technology, 2013, 77: 121-127.
[7] HARB J, KITTEMANN D, NEUWALD D A, et al. Correlation between changes in polyphenol composition of peels and incidence of CO2skin burning of ‘Cameo’ apples as influenced by controlled atmosphere storage[J]. Journal of Agricultural and Food Chemistry, 2013, 61: 3624-3630.
[8] OREN-SHAMIR M. Does anthocyanin degradation play a signifi cant role in determining pigment concentration in plants[J]. Plant Science, 2009, 177: 310-316.
[9] 孙建霞, 张燕, 胡小松, 等. 花色苷的结构稳定性与降解机制研究进展[J]. 中国农业科学, 2009, 42(3): 996-1008.
[10] 李秀芳, 饶景萍, 马秋诗, 等. 红富士苹果采后1-MCP处理对果皮色素及相关酶活性的影响[J]. 园艺学报, 2014, 41(3): 447-455.
[11] LOPIERO A R, PUGLISI I, RAPISARDA P, et al. Anthocyanin accumualtion and related gene expression in red orange fruit induced by low temperature storage[J]. Journal of Agricultural and Chemistry, 2005, 53: 9083-9088.
[12] 聂继云, 李海飞, 李静, 等. 基于159 个品种的苹果鲜榨汁风味评价指标研究[J]. 园艺学报, 2012, 39(10): 1999-2008.
[13] 聂继云, 李志霞, 李海飞, 等. 苹果理化品质评价指标研究[J]. 中国农业科学, 2012, 45(14): 2895-2903.
[14] XIE L, WANG Z H, CHENG X H, et al. 5-Aminolevulinic acid promotes anthocyanin accumulation in Fuji apples[J]. Plant Growth Regulation, 2012, 69: 295-303.
[15] 王延玲, 张艳敏, 冯守千, 等. 新疆红肉苹果皮果肉呈色差异机理[J].中国农业科学, 2012, 45(13): 2771-2778.
[16] 孙建霞. 苹果多酚的提取分离及其主要功能活性研究[D]. 泰安: 山东农业大学, 2005.
[17] JIANG Yueming. Role of anthocyanin, polyphenol oxidase and phenols in lychee pericarp browning[J]. Journal of the Science of Food and Agriculture, 2000, 80: 305-310.
[18] SARNI P, FULCRAND H, SOUILLOL V, et al. Mechanisms of anthocyanin degradation in grape must-like model solution[J]. Journal of the Science of Food and Agriculture, 1995, 69: 385-391.
[19] MACLEAN D D, MURR D P, DEELL J R, et al. Inhibition of PAL, CHS, and ERS1 in ‘Red Anjou’ pear (Pyrus communis L.) by 1-MCP[J]. Postharvest Biology and Technology, 2007, 45: 46-55.
[20] NGA H, GOLDING J, WILKES M. The effect of postharvest 1-MCP treatment and storage atmosphere on ‘Cripps Pink’ apple phenolics and antioxidant activity[J]. Food Chemistry, 2011, 127: 1249-1256.
[21] van der SLUIS A, DEKKER M, de JAGER A, et al. Activity and concentration of polyphenolic antioxidants in apple: effect of cultivar, harvest year, and storage conditions[J]. Journal of Agricultural and Chemistry, 2001, 49: 3606-3613.
[22] STINTZING F, STINTZING N, CARLE R, et al. Color and antioxidant properties of cyaniding-based anthocyanin pigments[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 6172-6181.
[23] AWAD M, de JAGER A, WESTING L M. Flavonoid and chlorogenic acid levels in apple fruit: characterisation of variation[J]. Scientia Horticulturae, 2000, 83: 249-263.
[24] MAYR U, TREUTTER D, SANTOS-BUELGA C, et al. Developmental changes in the phenol concentrations of ‘Golden delicious’ apple fruits and leaves[J]. Phytochemistry, 1995, 38: 1151-1155.
Effects of Low Temperature Storage and Controlled Atmosphere (CA) Storage on Skin Burning in Two Different Kinds of Colored ‘Red Fuji’ Apples
CHEN Lei, GUO Yurong*, BAI Ge, YUAN Li
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710062, China)
The aim of this study was to explore the effects of low temperature storage and controlled atmosphere (CA) storage on physical and chem ical indicators in two different kinds of colored ‘Red Fuji’ apples in order to provide a theoretical basis for preventing ‘skin burning’. Two kinds of colored ‘Red Fuji’ apples at harvest were used as materials to study the changes in firmness, pH, the contents of total soluble solids, anthocya ni ns and 9 individual polyphenols in apple peels by hardometer, refractometric saccharometer, UV spectrophotometry, and HPLC during the storage period. At harvest, the contents of anthocyanin and polyphenols in bad-colored apple were lower than in the well-colored apple, but the activities of PPO and POD were signifi cantly higher than in the well-colored apple. During storage, the degradation rates of anthocyanin and polyphenols in the bad-colored apple were signifi cantly higher than in the well-colored apple. Compared with low temperature storage, CA storage effectively inhibited the degradation of anthocyanin and polyphenols, retarded the increases in the activities of PPO and POD and maintained the quality index of fruit. “Skin burning” more likely happened in bad-colored ‘Red Fuji’ apples than in the well-colored apples during storage under the same conditions, and in low temperature stored apples than in CA-stored apples regardless of the color at harvest.
apple; anthocyanin; polyphenols; skin color; cold storage; controlled atmosphere storage
S661.1
A
1002-6630(2015)22-0210-06
10.7506/spkx1002-6630-201522040
2015-01-13
国家现代农业产业技术体系建设专项(GK661001)
陈磊(1988—),男,硕士,主要从事食品生物技术与食品储藏研究。E-mail:chen122148@163.com
*通信作者:郭玉蓉(1962—),女,教授,博士,主要从事食品生物加工研究。E-mail:guoyurong730@163.com

